Diagnostica oftalmologica
Inquadramento generale diagnostico delle malattie ipotalamo-ipofisarie
Anatomia chirurgica della regione sellare e sovrasellare
Giovanni Lasio, Martina Revay
Neurochirurgia, Istituto Clinico Humanitas, Rozzano (MI)
L'osso sfenoide, situato al centro della base cranica, è in stretto rapporto con le cavità nasali inferiormente e con l'ipofisi superiormente, contenuta nella struttura ossea, detta sella, situata centralmente nel corpo dello sfenoide e che aggetta nel seno sfenoidale. I nervi olfattori, il giro retto, la parte posteriore del lobo frontale, il pavimento del III ventricolo, il ponte, il mesencefalo ed il chiasma ottico sono le strutture nervose a più stretto contatto con lo sfenoide. I nervi cranici dal II al VI sono pure in stretti rapporti con l'osso sfenoide, in quanto i forami da cui escono/entrano nel cranio sono tutti localizzati nell'osso sfenoide stesso: canale ottico (II), fessura orbitaria superiore (III, IV, VI e branca orbitaria del V), forame rotondo (branca mascellare del V), forame ovale (branca mandibolare del V).
Oltre che importanti rapporti con strutture nervose, l'osso sfenoide ha intimi rapporti con strutture vascolari arteriose e venose. Le arterie carotidi attraversano lo sfenoide prima di entrare nel cranio, l'arteria basilare è addossata alla sua faccia posteriore, mentre il poligono di Willis è situato al di sopra della sua porzione centrale. I seni cavernosi sono appoggiati all'osso sfenoide, che ne forma la parete laterale, mentre la dura sellare ne forma la parete mediale; protrudono all'interno del seno sfenoidale. I seni cavernosi sono uniti dai seni inter-cavernoso superiore ed inferiore, che delineano la parete anteriore della sella e la parete inferiore. Il seno basilare poi connette i seni cavernosi posteriormente al dorsum sellae ed è usualmente il seno di maggiori dimensioni. I seni petrosi inferiori e superiori si uniscono al seno basilare.
La parte successiva è divisa in 3 sezioni: anatomia della regione sellare propriamente detta (vista dal basso) e della regione soprasellare (vista dall'alto), anatomia della ghiandola ipofisaria.
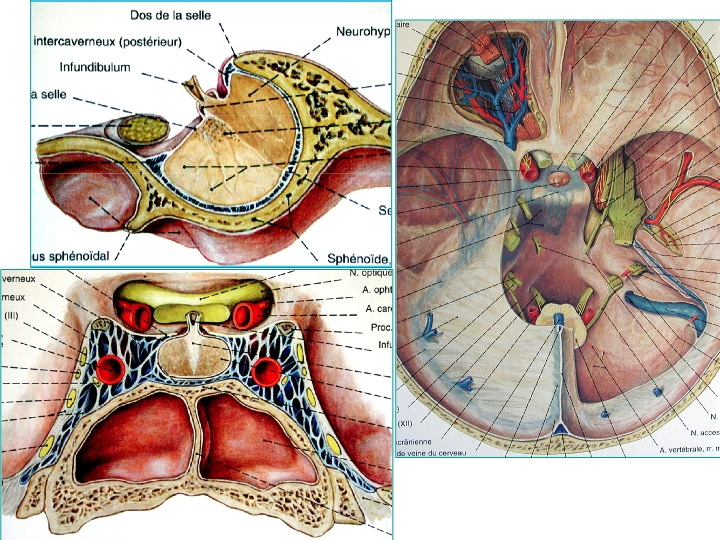
Anatomia della regione sellare in proiezione sagittale (in alto a sinistra), coronale dal basso (in basso a sinistra) e assiale dall' alto (a destra).
Anatomia della regione sellare propriamente detta (vista dal basso)
Il corpo dello sfenoide contiene il seno sfenoidale, che è in comunicazione con le cavità nasali tramite due osti, simmetrici. Il seno sfenoidale è soggetto a una considerevole variabilità di dimensione, forma e pneumatizzazione. Nell'adulto esistono tre tipi di seno sfenoidale: concale, presellare e sellare, così definiti in base alla pneumatizzazione, assente nel tipo concale e ben presente nel tipo sellare (75%). Il seno sfenoidale è poi attraversato da setti, assai variabili come numero, forma, direzione, spessore, ecc. I canali ottici protrudono nella porzione supero-laterale del seno sfenoidale, mentre la II branca del trigemino protrude nella sua parte infero-laterale. Il recesso ottico-carotideo è situato lateralmente e superiormente fra canale ottico e protuberanza carotidea.
La struttura ossea definita sella turcica, contenuta nella parte centrale del corpo dell' osso sfenoide, sporge all'interno del seno sfenoidale e ha confini anatomici precisi:
- postero-superiormente il dorso della sella, il cui margine libero termina lateralmente con i processi clinoidei posteriori e si continua inferiormente nel clivus;
- i seni cavernosi, che contengono sangue venoso, sono situati lateralmente alla sella. All'interno di essi decorre la porzione orizzontale della carotide interna ed un segmento del VI nervo cranico, mentre il III, il IV e la I branca del V nervo cranico si trovano nel tetto e nella parete laterale del seno cavernoso. Dal segmento intra-cavernoso della carotide nascono l'arteria meningo-ipofisaria, l'arteria del seno cavernoso inferiore e le arterie capsulari. La parete mediale del seno cavernoso è costituita da dura sottile, ma può presentare dei buchi od essere del tutto assente. La distanza fra arteria carotide e faccia laterale dell'ipofisi in condizioni normali varia fra 1 e 3 mm;
- anteriormente e superiormente il tubercolo della sella e il piano sfeno-etmoidale, separati dal solco chiasmatico;
- inferiormente il pavimento osseo della sella, che si continua con il clivus. Anteriormente la parete anteriore della sella, il clivus e la parete anteriore ossea dei seni cavernosi aggettano nella cavità del seno sfenoidale;
- il tetto della sella è costituito dal diaframma sellare, un setto orizzontale di dura che divide la loggia sellare dalla regione sovra-sellare, con un foro centrale per il passaggio del peduncolo ipofisario, struttura che connette l’ipotalamo all’ipofisi. Il diaframma è più sottile attorno al peduncolo e la sua apertura centrale è di solito più ampia di quanto necessario per il passaggio del peduncolo. In questi casi è presente un'invaginazione dell' aracnoide sovrasellare. La sella è internamente rivestita da periostio e contiene l'ipofisi.
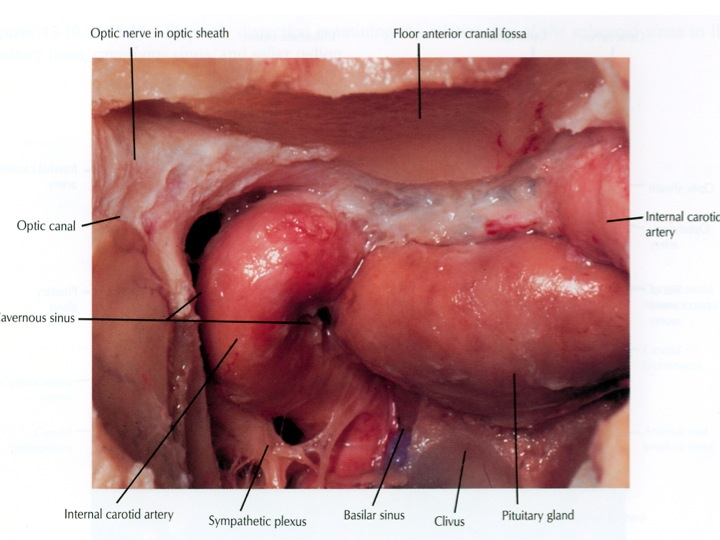
Visione endoscopica della sella, seno sfenoidale e carotidi clivali e cavernose dall’accesso TNS
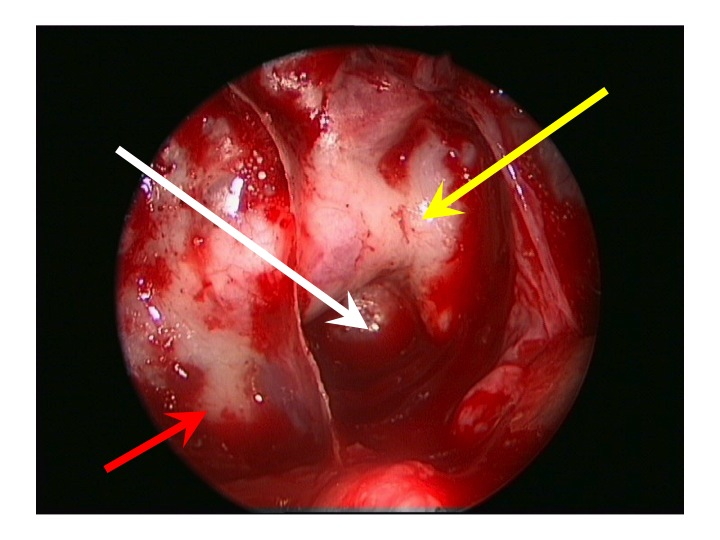
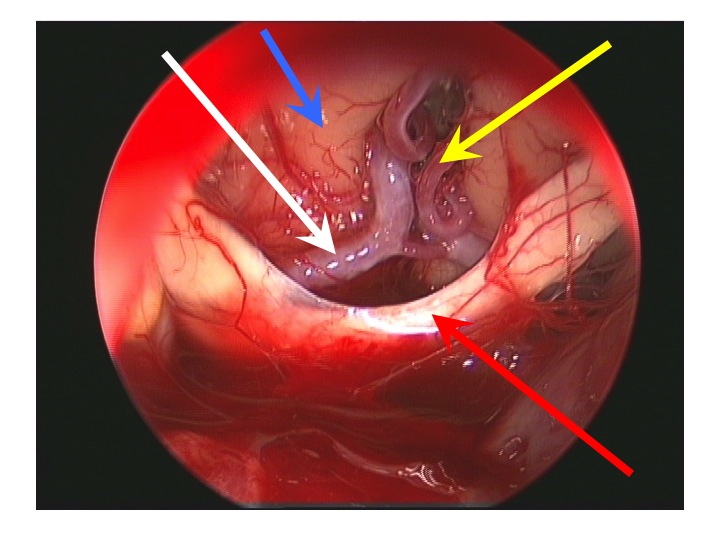
Visione endoscopica della regione sovrasellare (via TNS extended).
Nell'immagine in alto, la freccia rossa indica la carotide clivale dx, la gialla il seno cavernoso sinistro, la bianca attraversa la sella e indica il clivus.
Nell'immagine in basso, la freccia rossa indica il bordo anteriore del chiasma, la gialla l'arteria di Heubner sinistra, la bianca il tratto A1 della cerebrale anteriore dx, la blu la faccia inferiore del lobo frontale dx.
Anatomia della regione soprasellare (vista dall'alto)
La regione sovrasellare ha limiti più imprecisi. Può essere definita come la regione delimitata:
- anteriormente dal tubercolo sellare;
- inferiormente dal diaframma;
- posteriormente dalla membrana di Lillequist, una membrana aracnoidea che decorre fra il dorso della sella e la faccia anteriore dei corpi mammillari e che separa la cisterna chiasmatica dalla cisterna inter-peduncolare;
- superiormente dai nervi ottici, dal chiasma e dal pavimento del III ventricolo;
- lateralmente dalle carotidi.
Nervi e vasi della regione sono contenuti all'interno di cisterne limitate da aracnoide e contenenti liquor.
La regione sovrasellare è generalmente approcciata attraverso le cisterne che circondano la parte anteriore dell'incisura tentoriale, definita come uno spazio triangolare situato fra i margini liberi del tentorio. Il chiasma ed i nervi ottici attraversano lo spazio incisurale anteriore, i nervi ottici entrano nel cranio dai canali ottici medialmente alle clinoidi anteriori ed alle carotidi e sono diretti medialmente, posteriormente e superiormente verso il chiasma. Il chiasma è normalmente situato al di sopra del diaframma sellare.
Vista dall'alto la parete laterale del seno cavernoso si estende dalla fessura orbitaria superiore anteriormente, fino all'apice della porzione petrosa dell'osso temporale, posteriormente. Il III nervo cranico entra nel seno dal tetto, lateralmente al dorso sellare, il IV entra in posizione più posteriore e laterale, la branca oftalmica del V entra dalla parte inferiore della parete laterale e il VI entra dalla parete posteriore del seno fra carotide medialmente e III lateralmente.
Una volta entrate nel cranio inferiormente e poi lateralmente al nervo ottico, le carotidi si dirigono lateralmente e danno origine nell'ordine all'arteria oftalmica, alla comunicante posteriore, alla corioidea anteriore, per poi biforcarsi in cerebrale media e cerebrale anteriore, connessa alla cerebrale anteriore controlaterale dalla comunicante anteriore. Dalla carotide nasce l'arteria ipofisaria superiore, che raggiunge il tuber cinereum e si connette alla sua omologa controlaterale per formare un anello attorno all'infundibolo, cui è attaccata l'ipofisi tramite il peduncolo. Gli spazi subaracnoidei della regione sellare e parasellare sono poi attraversati da vasi perforanti che irrorano fra l'altro i nervi ottici, il chiasma, i tratti ottici, le pareti del III ventricolo e l'ipotalamo. Le vene della regione sellare e sovrasellare sono di piccolo calibro e la regione sovrasellare è quasi completamente drenata da tributarie delle vene basali.
Il III ventricolo è situato al centro della testa, superiormente alla sella ed è in stretto rapporto con il poligono di Willis e con il sistema venoso profondo del cervello. La manipolazione delle pareti del III ventricolo può causare disturbi ipotalamici (coscienza, termoregolazione, respirazione, secrezione ormonale, memoria...). E' delimitato da un pavimento, da un tetto, da pareti anteriori, posteriori e laterali. Visto dal basso il pavimento si estende dal chiasma all'acquedotto di Silvio, la metà anteriore è formata da strutture diencefaliche, la metà posteriore da strutture mesencefaliche. Dall'avanti verso l'indietro si trovano: il chiasma, l'infundibolo dell' ipotalamo, il tuber cinereum, i corpi mammilllari, la sostanza perforata posteriore e il tegmento del mesencefalo. L'infundibolo è una struttura imbutiforme localizzata fra il chiasma ed il tuber cinereum. L'ipofisi è connessa all'infundibolo e gli assoni infundibolari si estendono fino al lobo posteriore dell'ipofisi. Il tuber cinereum si fonde nell'infundibolo. La parete anteriore del III ventricolo si estende dai forami di Monro al chiasma inferiormente. L'unica parte visibile è la lamina terminale, un fine strato di sostanza grigia e pia, attaccata alla superficie superiore del chiasma e che riempie il gap fra chiasma e rostro del corpo calloso.
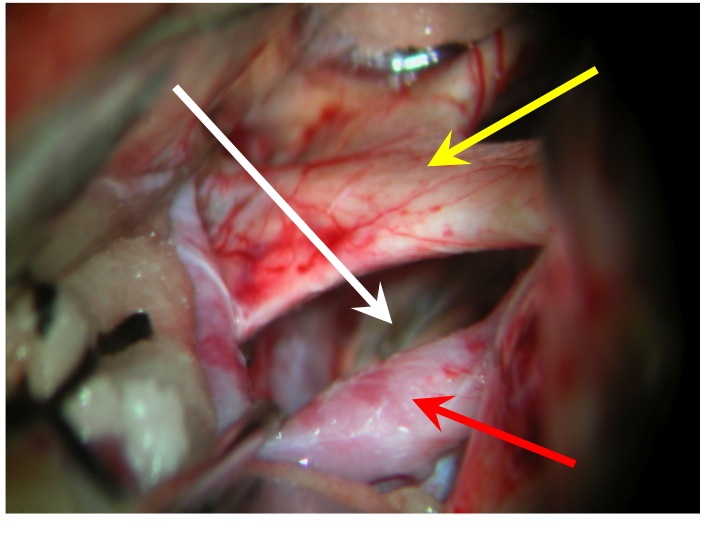
Vista della regione sovrasellare (via pterionale dx).
La freccia rossa indica la carotide dx, la gialla il nervo ottico dx e il chiasma, la bianca il diaframma sellare.
Anatomia dell'ipofisi
L’ipofisi è costituita da un lobo anteriore (adeno-ipofisi), che avvolge la parte più distale del peduncolo ipofisario, costituendo la pars tuberalis, e da un lobo posteriore (neuro-ipofisi), più aderente all'osso della sella di quanto non sia il lobo anteriore. Poichè il lobo anteriore è separato dal lobo posteriore, la pars tuberalis è più frequentemente inserita nel lobo posteriore. Cisti della pars intermedia sono di frequente riscontro.
Nell’adeno-ipofisi sono presenti 6 tipi cellulari diversi:
- le cellule tireotrope, che secernono il TSH;
- le cellule corticotrope, che secernono l’ACTH;
- le cellule lattotrope, che secernono la PRL;
- le cellule somatotrope, che secernono il GH;
- le cellule gonadotrope, che secernono le gonadotropine;
- le cellule follicolo-stellate, che potrebbero rappresentare cellule staminali ipofisarie e la cui funzione sembra importante per la secrezione di fattori di crescita e citochine e per mantenere i corretti rapporti (e quindi l’equilibrio paracrino) fra i diversi tipi cellulari.
Le cellule corticotrope e tireotrope tendono a raggrupparsi insieme nelle zone più centrali della ghiandola, mentre le cellule somatotrope si distribuiscono nelle porzioni più laterali e le cellule gonadotrope, lattotrope e follicolo-stellate sono diffusamente sparse nel parenchima adeno-ipofisario.
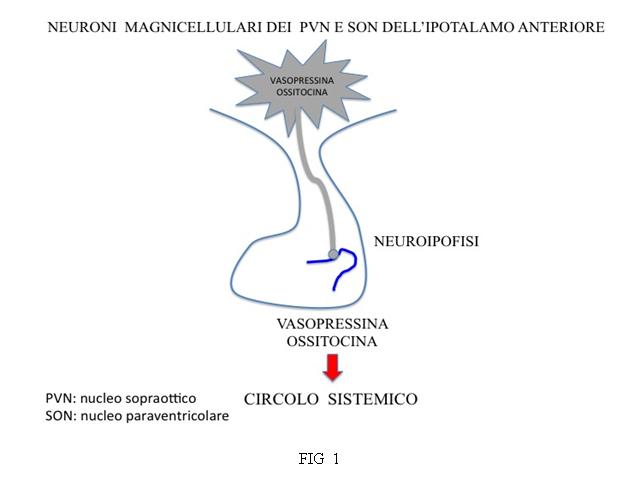
La neuro-ipofisi è costituita dalla parte terminale degli assoni delle cellule che secernono vasopressina e ossitocina, i cui corpi cellulari sono contenuti nell’ipotalamo (nei nuclei sopra-ottico e para-ventricolare).
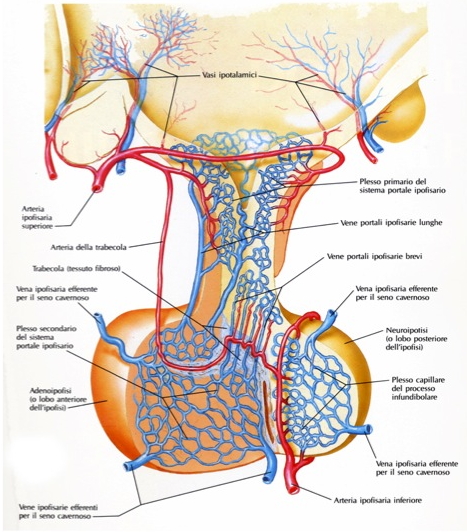
L’ipofisi è vascolarizzata dalle arterie ipofisarie superiori e inferiori e da rami delle arterie comunicanti posteriori, tutte originanti dalla carotide interna o da suoi rami. Le arterie ipofisarie superiori avvolgono la porzione superiore del peduncolo ipofisario, al cui interno comunicano con un plesso primario di capillari sinusoidali spiralizzati. Tali ramuscoli si tramutano in venule e quindi in vene lunghe e sottili che passano sotto il peduncolo ipofisario nella pars distalis dell’adeno-ipofisi, dove si forma un plesso secondario di capillari sinusoidali. Questa disposizione, doppia e parallela, dei plessi capillari prende il nome di sistema portale ipofisario. Il drenaggio venoso fa capo alle vene ipofisarie laterali che si aprono nel seno cavernoso.
Fisiologia ipotalamo-ipofisaria
Asse TRH-TSH-tiroide
Asse CRH-ACTH-surrene
Asse GHRH-GH-IGF
Asse GnRH-gonadotropine-gonade femminile
Generalità di fisiologia ipotalamo-ipofisaria
Chiara Martini & Pietro Maffei
Clinica Medica 3°, Azienda Ospedaliera di Padova
Negli ultimi decenni è apparsa sempre più evidente l’esistenza di un rapporto di regolazione bidirezionale fra sistema nervoso e sistema endocrino. A livello cerebrale vi sono neuroni in grado di produrre sostanze, di natura peptidica e non (neurormoni), che influiscono sul funzionamento del sistema endocrino e allo stesso tempo il sistema endocrino influenza lo sviluppo e le funzioni cerebrali. Il riconoscimento di questa interrelazione sta alla base della moderna neuroendocrinologia. Il sistema neuroendocrino è una rete altamente integrata di neuroni, ghiandole endocrine e tessuti non endocrini che svolge funzioni di coordinamento fondamentali per l’organismo, principalmente finalizzate al mantenimento dell’omeostasi (mantenimento di un equilibrio interno nonostante il variare delle condizioni esterne), ma anche implicate nella regolazione dell'apporto alimentare, nella risposta allo stress, nella regolazione del comportamento sessuale, nell’espressione delle emozioni. Messaggeri chimici (ormoni o neurotrasmettitori) ed impulsi elettrici (stimoli nervosi) rappresentano gli strumenti attraverso cui le diverse componenti del sistema dialogano fra loro. La regione ipotalamo-ipofisaria è il luogo anatomico per eccellenza ove si realizza questa integrazione.
L’ipotalamo, la regione diencefalica coinvolta nelle funzioni viscerali ed endocrine, è costituito da 2 porzioni simmetriche e separate dal terzo ventricolo. La sua posizione anatomica lo rende perfetto per la funzione di centro di regolazione e integrazione di differenti sistemi, mediante un continuo monitoraggio dell’ambiente interno e la registrazione delle sue modificazioni generate da stimoli esterni o interni. E’ quindi il luogo di regia delle fisiologiche risposte adattative dell’organismo al perturbamento della costanza delle condizioni interne, fondamentale per la sua sopravvivenza. La modalità attraverso cui il sistema neuroendocrino opera per mantenere il controllo omeostatico è rappresentata da riflessi che realizzano una risposta acuta e fisiologica a variazioni che si originano all’esterno dell’organismo o al suo interno; in risposta alla variazione di un determinato parametro che deve rimanere costante (set point) o nell’ambito di un ristretto range di valori, tali riflessi operano in senso contrario e tale da annullare l’iniziale variazione (feed-back negativo).
I neuroni dell’ipotalamo si riuniscono a formare masse nucleari più o meno distinte, chiamate nuclei ipotalamici, bilaterali e simmetrici, distribuiti in senso rostro-caudale in 3 regioni distinte (regione anteriore o sopraottica, regione media o tuberale e regione caudale o mammillare).
- Nella regione anteriore sono contenuti il nucleo sopraottico (SON) e il nucleo paraventricolare (PVN); i neuroni di questi 2 nuclei sono più grossi (magnicellulari) di quelli della sostanza grigia circostante e si colorano più intensamente. Da essi partono fibre dirette all’ipofisi posteriore. Fanno parte della regione anteriore anche il nucleo sovrachiasmatico (SCN), l’area ipotalamica anteriore (AHA) e il nucleo periventricolare che si continua caudalmente.
- Nell’ipotalamo mediano sono contenuti il nucleo arcuato (AN), l’area ipotalamica laterale (LHA), il nucleo ventromediale (VMN) e quello dorsomediale (DMN). I neuroni di questi 2 nuclei sono uniformemente piccoli e di forma ovoidale (parvicellulari).
- Alla regione posteriore infine appartengono il nucleo ipotalamico posteriore (PHN) e il nucleo premammillare (PMN).
Le afferenze nervose all'ipotalamo provengono prevalentemente dalla formazione reticolare ascendente, struttura deputata alla regolazione dello stato di vigilanza, dal talamo, ove approdano segnali sensoriali particolarmente coinvolti nella percezione del dolore, dal sistema limbico, luogo coinvolto nell’aspetto emozionale e della memoria e, infine, dal sistema visivo. Tali afferenze neuronali, registrate e integrate a livello ipotalamico con segnali umorali provenienti dalla periferia, generano una risposta neurormonale.
Il controllo delle funzioni sottoposte a regolazione ipotalamica, più che essere il risultato dell’attività di un singolo “centro”, che regola e sovraintende da solo a una determinata funzione, è il frutto di un’integrazione dell’attività delle popolazioni cellulari distribuite nei diversi nuclei ipotalamici. Tuttavia, vi sono alcuni nuclei che sono più specificatamente deputati al controllo di determinate funzioni, quali la regolazione del bilancio idro-elettrolitico, la pressione arteriosa, la contrattilità uterina (PVN e SON).
L’ipofisi è costituita da una porzione anteriore (adeno-ipofisi), di natura ghiandolare, costituita da differenti tipi cellulari deputati alla produzione di ormoni con funzioni specifiche, e da una porzione posteriore (neuro-ipofisi), costituita dagli assoni dei neuroni di nuclei ipotalamici (PVN e SON). L’eminenza mediana, la porzione medio-basale dell’ipotalamo, si continua con il peduncolo ipofisario per terminare nel lobo posteriore dell’ipofisi. Il sangue proveniente dalle arterie ipofisarie superiori irrora l’eminenza mediana e il peduncolo ipofisario per raggiungere il sistema di vasi portali e i sinusoidi dell’ipofisi anteriore. I neurormoni dei neuroni localizzati a livello dei nuclei ipotalamici possono venir rilasciati direttamente nel circolo sistemico a livello delle giunzioni neurovascolari dell’ipofisi posteriore e quindi agire a distanza (vasopressina e ossitocina) (Fig 1) o venir rilasciati nel sistema portale ipotalamo-ipofisario per regolare la funzione secretoria e il trofismo delle cellule target dell’ipofisi anteriore (fattori ipotalamici ad azione stimolante o inibente) (Fig 2).
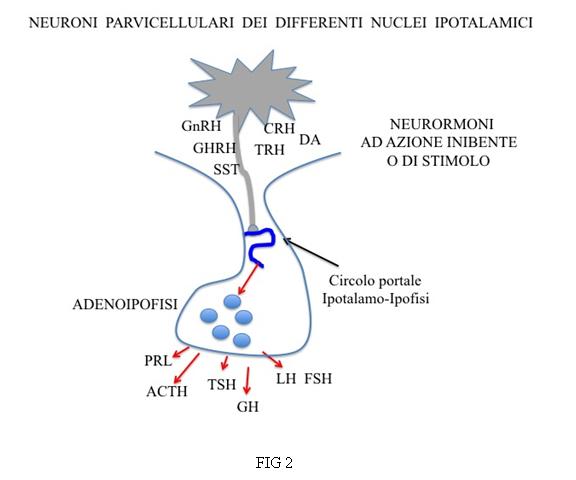
In definitiva sull’ipofisi convergono, controllandone l’attività, stimoli provenienti dalla regione ipotalamica, che si integrano con quelli provenienti dalla periferia, cioè dalle altre ghiandole endocrine di cui l’ipofisi rappresenta il centro di controllo. Gli ormoni prodotti a livello ipofisario sono essenziali per la riproduzione, la crescita, il metabolismo, la risposta allo stress e i singoli assi ipotalamo-ipofisi-organi bersaglio, siano essi endocrini o meno, rappresentano un anello fondamentale del processo di omeostasi, in cui sistema nervoso e sistema endocrino si integrano e cooperano. Gli assi ipotalamo-ipofisi-organi bersaglio presentano un’organizzazione a step multipli: l’ipotalamo, attraverso fattori di rilascio o di inibizione, controlla l’attività dell’ipofisi anteriore che a sua volta stimola gli organi bersaglio attraverso la secrezione delle sue tropine. Il cerchio viene chiuso dalla retroazione (feed-back) delle sostanze prodotte dagli organi bersaglio, rispettivamente sull’ipofisi e/o sull’ipotalamo. Un’azione di feed-back sull’ipotalamo viene esercitata anche dall’ipofisi (short loop feed-back). Tre sono gli assi organizzati in tal modo: l’asse ipotalamo-ipofisi-tiroide (HPT), l’asse ipotalamo-ipofisi-surrene (HPA) e infine l’asse ipotalamo-ipofisi-gonadi (HPG). La secrezione ipofisaria di GH e PRL è invece organizzata prevalentemente su due step, con produzione, da parte dei nuclei ipotalamici, di fattori di rilascio o di inibizione che regolano la sintesi e il rilascio dei 2 ormoni. Questi, a loro volta, influenzano in maniera retro-attiva il rilascio dei fattori ipotalamici, controllando così la loro stessa secrezione. Non esiste un singolo organo bersaglio per GH e PRL e quindi manca il terzo step, anche se l’IGF I, prodotta prevalentemente a livello epatico sotto lo stimolo del GH, è in grado di esercitare un’azione di feed-back a livello ipotalamico e ipofisario. Anche lo stato nutrizionale (adipochine) e fattori metabolici influiscono sul sistema ipotalamo-ipofisario agendo a diversi livelli dei siti di regolazione.
Dal punto di vista fisiologico è importante infine ricordare che il sistema endocrino è caratterizzato da un’organizzazione temporale, in cui oscillazioni ritmiche e pulsatili, il cui periodo spazia dai minuti sino all’anno, sono essenziali per l’efficacia e il risultato finale. Comprendere e considerare tale aspetto non è di poca importanza per l’endocrinologo clinico, per le sue implicazioni sia nell’ambito dei processi diagnostici (ottimizzazione dei momenti delle determinazioni ormonali) che del trattamento. La natura endogena (genetica) di tale orologio biologico è indubbiamente influenzata da fattori ambientali, fra i quali certamente l’alternanza luce/buio è il più ovvio. La comunicazione fra ipotalamo-ipofisi e organi bersaglio è per sua natura caratterizzata da un pattern secretorio di tipo ritmico, che si sovrappone a una secrezione basale costante e che appare aumentare l’efficienza della comunicazione stessa. La comunicazione ritmica/pulsatile fra ipotalamo e ipofisi, di cui caratteristiche importanti sono la frequenza e l’ampiezza dei pulse, ma anche la secrezione integrata, ha le sue basi in una predisposizione endogena, anche se è condizionata da fattori esterni (ambientali). Le cellule del nucleo soprachiasmatico (SCN) sembrano possedere le caratteristiche intrinseche di ritmicità circadiana (periodo di circa 24 ore) che fanno di tale nucleo “l’orologio endogeno”, la cui attività viene influenzata da fattori interni e ambientali. Ogni asse presenta in relazione al tempo un pattern di secrezione del tutto peculiare, che permette di ottenere il massimo effetto in termini di organizzazione temporale, efficienza energetica, capacità di rispondere a stimoli ripetuti e precisione di controllo.
Bibliografia
- Sam S, Frohman LA. Normal Physiology of Hypothalamic Pituitary Regulation. Endocrinol Metab Clin North Am 2008, 37: 1-22.
- Haus E. Chronobiology in the endocrine system. Adv Drug Deliv Rev 2007, 59: 985-1014.
- Veldhuis JD, Straume M, Iranmanesh A, et al. Secretory process regularity monitors neuroendocrine feedback and feedforward signalling strength in humans. Amer J Physiol Regul Integr Comp Physiol 2001, 280: R721-9.
Omeostasi dell'acqua
Marco Faustini Fustini
Endocrinologia, Ospedale Bellaria, Bologna
I compartimenti di distribuzione dell'acqua nell'organismo
Nell’uomo le oscillazioni del contenuto d’acqua (55-65% del peso corporeo) dipendono essenzialmente dal diverso contenuto di grasso corporeo e, conseguentemente, dall’età e dal sesso. Si stima che poco meno dei 2/3 dell’acqua corporea totale sia presente nel compartimento liquido intra-cellulare (LIC) e poco più di 1/3 nel compartimento liquido extra-cellulare (LEC). Solamente ¼ del LEC (ossia circa 1/12 dell’acqua corporea totale) è costituito dal fluido intra-vascolare (volume ematico in senso stretto), ma il volume arterioso efficace (ossia la quantità di sangue contenuta nei grossi vasi intra-toracici in grado di stimolare i barocettori) ne costituisce una parte ancor più ridotta. I restanti ¾ del LEC occupano lo spazio interstiziale.
Questa distribuzione dell’acqua nei vari compartimenti si modifica in condizioni fisiopatologiche particolari capaci di modificare questo equilibrio. L’acqua (a differenza della maggior parte dei soluti) può attraversare liberamente le membrane biologiche semipermeabili che separano i compartimenti, spostandosi in un compartimento a più elevata concentrazione di soluti, finché si raggiunge un nuovo stato di equilibrio. Motore di questi spostamenti d’acqua è la pressione osmotica, funzione delle concentrazioni dei soluti in un determinato compartimento fluido. Le pompe Na+/K+ legate alle membrane cellulari mantengono, con grande dispendio energetico, la maggior parte dello ione Na+ nel LEC e la maggior parte dello ione K+ nel LIC. Tuttavia, proprio in virtù delle leggi che governano il trasferimento di acqua attraverso le membrane semipermeabili e che tendono a far sì che le pressioni osmotiche nei diversi compartimenti debbano riequilibrarsi, il volume di distribuzione di questi due cationi è in realtà l’acqua corporea totale piuttosto che i due rispettivi compartimenti di riferimento. Se, ad esempio, si riduce il contenuto di Na+ nel LEC, l’acqua si sposterà dal LEC al LIC fino a quando le pressioni osmotiche nei due compartimenti saranno di nuovo eguali, ridistribuendo così il sodio, di fatto, in entrambi i compartimenti.
L’osmolalità, definita come la concentrazione di tutti i soluti in un dato peso d’acqua, si esprime in mOsm/Kg H20. L’osmolalità plasmatica può essere misurata direttamente mediante semplici apparecchiature di laboratorio oppure stimata mediante la formula:
Posm = 2 x sodiemia (mmol/L) + glicemia (mmol/L) + azotemia (mmol/L)
In particolari condizioni, in cui si accumulano nel plasma soluti permeabili alle membrane cellulari (urea, mannitolo, etanolo), l’osmolalità totale del plasma non corrisponde all’osmolalità efficace (nota anche come tonicità del plasma). Esempio paradigmatico è il paziente uremico, in cui l’incremento dell’osmolalità plasmatica può essere marcato, ma inefficace nell’indurre l’attivazione dei meccanismi di compenso (sete, secrezione di arginin-vasopressina) volti ad aumentare le riserve di acqua corporea totale. Infatti, l’urea può attraversare liberamente le membrane cellulari, distribuendosi proporzionalmente nel LIC e nel LEC senza indurre disidratazione intra-cellulare, che rappresenta lo stimolo efficace a promuovere il senso della sete e la secrezione di AVP.
Diverso è il caso del glucosio, che, pur non essendo in grado di attraversare liberamente le membrane cellulari come l’urea, in condizioni fisiologiche può comunque essere considerato un soluto inefficace, grazie a specifici meccanismi di trasporto di membrana che lo trasferiscono dal plasma alle cellule. Nel paziente diabetico i sistemi di trasporto del glucosio attraverso le membrane cellulari si saturano, trasformando il glucosio in un soluto efficace a indurre incremento della pressione osmotica nel LEC, con conseguente trasferimento di acqua dal LIC al LEC e, da ultimo, disidratazione intra-cellulare. Da qui, l’innesco dei meccanismi volti a correggere la perdita di acqua (sete, secrezione di AVP).
Meccanismi di regolazione
Il bilancio tra introito ed escrezione d’acqua è controllato principalmente da due meccanismi fisiologici finemente regolati - la secrezione dell’ormone ipotalamico arginin-vasopressina e la sete - che entrano in azione per compensare modificazioni della perdita d’acqua (renale o extrarenale) o, all’opposto, dell’introduzione d’acqua.
L’arginin-vasopressina (AVP) è il principale determinante dell’escrezione di acqua libera. E’ un peptide di nove aminoacidi, sintetizzato dai nuclei sopraottico e paraventricolare dell’ipotalamo; trasportato lungo il peduncolo ipofisario nella neuroipofisi, è qui immagazzinato in granuli di neurosecrezione, che riversano il loro contenuto nel torrente circolatorio in seguito a stimoli specifici. L’attività antidiuretica si esercita a livello del dotto collettore, dove l’ormone si lega ai recettori V2 e, mediante l’inserzione di un particolare canale dell’acqua (acquaporina-2) alla membrana apicale delle cellule principali, determina un’aumentata permeabilità all’acqua del dotto collettore, con conseguente riduzione del flusso urinario e incremento dell’osmolalità urinaria.
Il principale stimolo fisiologico alla dismissione nella circolazione sanguigna di AVP è l’aumento dell’osmolalità plasmatica, mediato dagli osmorecettori situati nell’ipotalamo anteriore: sopra la soglia di 280 mOsm/Kg H2O, esiste una relazione lineare tra osmolalità plasmatica e concentrazione ematica di AVP. Al secondo posto nella scala gerarchica degli stimoli capaci di immettere in circolo AVP ci sono l’ipovolemia e la riduzione della pressione ematica. In realtà, entrambi questi stimoli di volume sono di gran lunga meno potenti dello stimolo osmotico. Secondo alcuni studi, ad esempio, pare che solamente perdite cospicue del volume del LEC (> 8-10%) siano in grado di aumentare direttamente la secrezione di AVP, mentre deplezioni di volume extra-cellulare più modeste agiscano indirettamente, amplificando la sensibilità a secernere AVP in risposta all’aumento dell’osmolalità plasmatica (1-2) . Ne consegue che, a parità d’incremento dell’osmolalità plasmatica, la quantità di AVP immessa in circolo aumenterà in maniera ancor più consistente se il paziente è anche lievemente ipovolemico. Tra gli altri stimoli non osmotici in grado di stimolare la secrezione di AVP, una menzione particolare merita la nausea, che probabilmente è, in generale, ancor più potente dello stimolo osmotico nell’attivare la secrezione di AVP.
La sete, similmente alla secrezione di AVP, è stimolata soprattutto dall’aumento dell’osmolalità plasmatica, espressione biochimica di disidratazione intracellulare. Tuttavia, la soglia oltre la quale l’osmolalità plasmatica innesca la sensazione della sete (287-295 mOsm/Kg H2O, secondo alcuni studi non più recenti) è superiore a quella che determina la secrezione di AVP (2,3). In termini finalistici, la sete interviene quando la secrezione di AVP inizia a mostrare qualche oggettiva difficoltà nel produrre un’ulteriore riduzione del flusso urinario associato al relativo incremento dell’osmolalità urinaria, che nell’uomo non riesce a superare le 1200 mOsm/Kg H2O. La riduzione del volume del LEC e della pressione ematica sono gli stimoli non osmotici in grado di stimolare la sensazione della sete. Tuttavia, nei Primati solamente l’ipovolemia e/o l’ipotensione arteriosa di una certa entità stimolano la sete, probabilmente quale conseguenza dell’acquisizione della postura eretta. La sete rappresenta certamente un meccanismo omeostatico di rilevante importanza in condizioni patologiche che determinano disidratazione cellulare, con incremento dell’osmolalità plasmatica, o deplezione consistente del volume del LEC (emorragie cospicue, diarrea profusa, ecc). Tuttavia, non sembra intervenire nella fine regolazione giornaliera dell’osmolalità plasmatica, che solitamente oscilla di 1-2 mOsm/Kg H2O. L’introduzione di liquidi nell’uomo, peraltro, è spesso espressione di abitudini individuali o di gruppo (introito non controllato da meccanismi di omeostasi) piuttosto che la conseguenza di una reale sensazione di sete. Ne consegue che in condizioni fisiologiche l’omeostasi dell’acqua è mantenuta soprattutto grazie al controllo dell’eliminazione di acqua libera mediato dalla secrezione di AVP, mentre la sete compare solamente quando iniziano a manifestarsi segnali di disidratazione cellulare o di deplezione di volume del LEC.
Bibliografia
- Robertson GL. Posterior pituitary. In Felig P et al (eds) Endocrinology & Metabolism. New York: Mc Graw-Hill 1995: pp 385-432.
- Robertson GL. Thirst and vasopressin function in normal and disordered states of water balance. J Lab Clin Med 1983, 101: 351-71.
- Verbalis JG. Body water and osmolality. In Jamison RL & Wilkinson R (eds) Nephrology. London: Chapman & Hall Medical 1997: pp 89-94.
Fisiologia PRL
Enrica Ciccarelli
S.S. Patologie Endocrino-Metaboliche, Ospedale E. Valdese, Torino
La PRL è un ormone polipeptidico di 199 aa con peso molecolare 23 KDa, prodotto principalmente dalle cellule lattotrope dell'ipofisi anteriore.
La sua azione principale è lo stimolo della lattazione e la lattogenesi.
La PRL è anche prodotta da cellule specializzate di utero, placenta e sistema immunitario ed è classificata tra le citochine.
L'azione della PRL avviene mediante uno specifico recettore di membrana sulle cellule bersaglio.
La PRL è un ormone secreto in modo pulsatile con variazioni nell'arco delle 24h, regolata dall'ipotalamo in modo prevalentemente inibitorio. Infatti i livelli di PRL aumentano quando vi sia una lesione del peduncolo ipofisario o dell'eminenza mediana. Il principale regolatore della PRL è la dopamina (DA), secreta dai neuroni della regione tubero-infundibulare, che emergono dal nucleo arcuato dell'ipotalamo. Sulle membrane delle cellule lattotrope sono presenti recettori D2 dopaminergici, la cui attivazione riduce sia il rilascio che la trascrizione genica della PRL. La somministrazione di antagonisti recettoriali dopaminergici D2 (es. metoclopramide, domperidone, ecc.) aumenta i livelli di PRL plasmatica; al contrario agonisti dopaminergici D2 (es. bromocriptina, cabergolina) riducono la secrezione di PRL da cellule PRL-secernenti normali e tumorali.
L'estradiolo influenza la secrezione della PRL in modo complesso, agendo sia a livello ipotalamico che ipofisario, e determina l'incremento della PRL in corso di gravidanza (momento in cui le cellule lattotrope aumentano di numero e di capacità secretoria). L'azione principale dell'estradiolo è a livello ipofisario con stimolazione diretta della sintesi della PRL; è inoltre documentato un effetto complesso ipotalamico con modulazione del rilascio di DA.
Altri fattori posseggono un'azione regolatrice della PRL di importanza minore, agendo a livello ipotalamico o con effetto paracrino diretto sulle cellule lattotrope:
- effetto inibitorio: acido γ-aminobutirrico (GABA), GnRH, GAP
- effetto stimolatorio: TRH, VIP, PrRP, ossitocina, serotonina, neurotensina, angiotensina II, vasopressina, sostanza P, EGF.
Bibliografia
- Camanni F, Ciccarelli E, Ghigo E, et al Hyperprolactinemia: neuroendocrine and diagnostic aspects. J Endocrinol Invest 1989, 12: 653-68.
- Wood DF, Johnston JM, Johnston DG. Dopamine, the dopamine D2 receptor and pituitary tumours. Clin Endocrinol 1991, 35: 455-66.
- Ben-Jonathan N, Hnasko R. Dopamine as a prolactin (PRL) inhibitor. Endocr Rev 2001, 22: 724-63.
Fisiologia somatostatina
Renato Cozzi1 & Roberto Attanasio2
Endocrinologia, 1Ospedale Niguarda & 2Istituto Galeazzi, Milano
È una molecola chiave nel controllo neuroendocrino. Nell’uomo ne esistono due forme, la SS-14 e la SS-28, rispettivamente di 14 (più frequente e predominante nel SNC) e 28 (predominante a livello gastro-intestinale) aminoacidi.
La somatostatina è regolata in modo complesso da diversi fattori:
- stimolatori: neuro-trasmettitori: dopamina, acetilcolina, noradrenalina; peptidi: glucagone, neurotensina, bombesina
- inibitori: neuro-trasmettitori: acido gamma-butirrico, serotonina; peptidi: VIP, oppioidi, secretina).
È caratterizzata da una secrezione ritmica, con una periodicità di 3-4 ore, che insieme con quella del GHRH è alla base della secrezione pulsatile del GH.
Le molteplici azioni della somatostatina sono legate alla presenza in diversi tessuti (ipofisi, tratto gastro-intestinale, pancreas, fegato, rene, ecc.) di recettori di membrana specifici (di cui al momento sono stati identificati 5 sottotipi, SSTR 1, 2, 3, 4, 5).
La somatostatina è stata identificata originariamente come inibitore del GH, ma in realtà ha azioni inibitorie a molteplici livelli centrali e periferici.
| Azioni principali della somatostatina | |
| Sede | Azione |
| Asse ipofisi-ipotalamo | Inibisce la secrezione basale e stimolata di GH Inibisce la secrezione basale e stimolata di TSH Minima azione inibitoria su PRL e ACTH |
| Tratto gastro-intestinale | Inibisce la secrezione esocrina ed endocrina di tutti gli entero-ormoni Inibisce la motilità Riduce il flusso ematico Riduce l’assorbimento Inibisce la proliferazione intestinale |
| Pancreas endocrino | Inibisce insulina e glucagone |
Bibliografia
- Lamberts SW. The role of somatostatin in the regulation of anterior pituitary hormone secretion and the use of its analogs in the treatment of human pituitary tumors. Endocr Rev 1988, 4: 417–36.
- Reisine T, Bell GI. Molecular biology of somatostatin receptors. Endocr Rev 1995, 16: 427-42.
- Hofland LJ, Lamberts SWJ.The pathophysiological consequences of somatostatin receptor internalization and resistance. Endocr Rev 2003, 24: 28-47.
- Krantic S, Goddard I, Saveanu A, et al. Novel modalities of somatostatin actions. Eur J Endocrinol 2004, 151: 643–55.
Diagnostica generale dell'ipofisi
Generalità di diagnostica biochimica e ormonale ipotalamo-ipofisaria
Imaging neuroradiologico ipotalamo-ipofisario
Campimetria ottica e potenziali evocati visivi
Generalità di diagnostica biochimica e ormonale ipotalamo-ipofisaria
Maria Rosaria Ambrosio1 & Romolo Dorizzi2
1Sezione di Endocrinologia, Dipartimento di Scienze Biomediche e Terapia Avanzate Università degli Studi di Ferrara
2Laboratorio, UO Corelab-Laboratorio Unico di Area Vasta Romagna, Pievesestina di Cesena (FC)
Le indagini di laboratorio sono rivolte a definire la presenza di eccesso o di deficit secretori, attraverso la valutazione della funzione degli assi ipotalamo-ipofisi-ghiandole bersaglio, che prevedono la misura della concentrazione degli ormoni circolanti in condizioni basali e dopo stimolo.
Negli ultimi anni, i test ormonali dinamici sono stati rivisitati nella pratica clinica e, in misura variabile, ridimensionati. Per esempio i test con stimolazioni multiple contemporanee (i cosiddetti megatest) non sono più indicati per motivi di costo (sia della sostanza stimolante, sia delle determinazioni multiple) e per la possibile induzione di apoplessia.
Molta attenzione va posta alle variabili pre-analitiche: le determinazioni ormonali possono essere alterate da numerose condizioni e dall’assunzione di numerosi farmaci. È fondamentale, peraltro, nell’interpretazioni dei risultati la conoscenza del metodo di misura, essendo disponibili sul mercato metodi con sensibilità e specificità differenti.
Asse ipotalamo-ipofisi-surrene (HPA)
Asse ipotalamo-ipofisi-tiroide (HPT)
Asse ipotalamo-ipofisi-gonadi (HPG)
Asse GH-IGF-I
Indagini genetiche
Anticorpi anti-ipofisi
Diagnostica ormonale dell'asse HPA
Maria Rosaria Ambrosio1 & Romolo Dorizzi2
1Sezione di Endocrinologia, Dipartimento di Scienze Biomediche e Terapia Avanzate Università degli Studi di Ferrara
2Laboratorio, UO Corelab-Laboratorio Unico di Area Vasta Romagna, Pievesestina di Cesena (FC)
Indagini basali
Test dinamici
- per l'ipersecrezione
- test con desametasone
- prelievi notturni (sangue e saliva)
- test con CRH
- test con CRH + desametasone
- test con desmopressina
- cateterismo dei seni petrosi
- per il deficit
- test con ACTH
- ipoglicemia insulinica
Valutazione basale del cortisolo
Maria Rosaria Ambrosio1 & Romolo Dorizzi2
1Sezione di Endocrinologia, Dipartimento di Scienze Biomediche e Terapia Avanzate Università degli Studi di Ferrara
2Laboratorio, UO Corelab-Laboratorio Unico di Area Vasta Romagna, Pievesestina di Cesena (FC)
L’ora del prelievo è determinante per l’interpretazione dei risultati.
Un valore di cortisolemia alle ore 8 all’interno dell’intervallo di riferimento non esclude uno stato di ipercortisolismo patologico, condizione clinica nella quale valori elevati di CLU e di cortisolo salivare rappresentano il gold standard diagnostico.
I valori di cortisolemia nel corso della giornata vanno valutati nell’ambito del contesto clinico e non esistono più cut-off sicuri per la diagnosi di iper o ipocortisolismo.
Il valore di cortisolemia delle ore 24 va valutato nell’ambito del contesto clinico. Nei casi sospetti per ipercortisolismo, i valori dubbi di cortisolemia alle ore 24 vanno integrati con altri metodi, mentre nei casi sospetti per ipocortisolismo non rivestono nessun valore diagnostico.
| Alterazioni delle concentrazioni di cortisolemia | ||
| Diminuite da | Aumentate da | |
| Cause fisiopatologiche | insufficienza surrenalica, primitiva e secondaria acromegalia (per ridotta attività della 11ß-idrossisteroido-DH a livello epatico) diabete mellito |
stress gravidanza (per aumento di CBG) ipercortisolismo endogeno disfunzione epatica e renale (per ritardato metabolismo di CBG) malnutrizione obesità (in realtà vi è riduzione dei livelli di cortisolemia e aumentato metabolismo con conseguente incremento di CLU) anoressia nervosa depressione (per aumento centrale con dinamiche simili al Cushing) deficit di GH |
| Modificazioni farmaco-indotte | androgeni ormoni tiroidei aminoglutetimide chetoconazolo mitotane (NB: mitotane aumenta i valori di CBG, con aumento relativo dei livelli di cortisolo) rifampicina fenobarbital GH insulina |
terapia estrogenica (per aumento di CBG) alcool |
| Interferenze nel dosaggio del cortisolo Il dosaggio di cortisolemia misura il cortisolo totale (libero + legato a CBG) |
||
| variazioni CBG | aumento della CBG (quindi valori falsamente normali/elevati di cortisolo) | estrogeni (gravidanza e pillola EP) mitotane? epatite attiva |
| riduzione della CBG (quindi valori ridotti di cortisolo | cirrosi nefrosi ipertiroidismo |
|
| stati patologici della secrezione di GH (per azione su 11-ß-HSD) | acromegalia: diminuisce cortisolemia GHD: aumenta cortisolemia |
|
Valutazione basale dell'ACTH
Maria Rosaria Ambrosio1 & Romolo Dorizzi2
1Sezione di Endocrinologia, Dipartimento di Scienze Biomediche e Terapia Avanzate Università degli Studi di Ferrara
2Laboratorio, UO Corelab-Laboratorio Unico di Area Vasta Romagna, Pievesestina di Cesena (FC)
La sua secrezione è molto sensibile allo stress (con grandi variazioni indotte anche solo dalla venopuntura, per cui un singolo valore va interpretato con grande cautela). La molecola è instabile a temperatura ambiente (emivita circolante 3-8 minuti), degradata da enzimi circolanti, aderisce a vetro e superfici plastiche
| Alterazioni delle concentrazioni di ACTH | ||
| Diminuite da | Aumentate da | |
| Cause fisiopatologiche | ipercortisolismo di origine surrenalica ipocortisolismo secondario e terziario (anche inappropriatamente normale) |
ipercortisolismo ACTH-dipendente insufficienza surrenalica primitiva sindrome di Nelson iperplasia adreno-genitale sindrome depressiva severa stress acuto (non cronico) traumi dolore malattia terminale |
| Modificazioni farmaco-indotte | steroidi anti-depressivi (citalopram) acido valproico benzodiazepine (effetto molto ridotto) |
|
Prelievi notturni per la valutazione dell'asse HPA
Maria Rosaria Ambrosio1 & Romolo Dorizzi2
1Sezione di Endocrinologia, Dipartimento di Scienze Biomediche e Terapia Avanzate Università degli Studi di Ferrara
2Laboratorio, UO Corelab-Laboratorio Unico di Area Vasta Romagna, Pievesestina di Cesena (FC)
| Prelievi notturni per la valutazione dell'asse HPA | |
| Indicazioni | Screening dell'ipercortisolismo Diagnosi differenziale tra sindrome di Cushing e Pseudo-Cushing |
| Meccanismo d’azione |
Valutazione del fisiologico nadir del cortisolo serico che è preservato nei soggetti obesi e nei pazienti depressi , ma non in quelli con sindrome di Cushing |
| Controindicazioni | Nessuna |
| Materiale necessario per l’esecuzione | Quello per un comune prelievo venoso |
| Relazione con età, sesso, peso corporeo, gravidanza |
Nei soggetti anziani il ritmo può essere anticipato di circa 3 ore per un più precoce risveglio |
| Precauzioni | Nessuna |
| Esecuzione | Prelievo venoso da eseguire alle ore 24 (preferibilmente con paziente addormentato) |
| Dosaggio | Cortisolo |
| Possibili effetti collaterali | Nessuno |
| Parametri da monitorare durante l’esecuzione | Nessuno |
| Manovre da eseguire dopo la fine del test | Nessuna |
| Valutazione risultati |
Calo del cortisolo serico che raggiunge il suo fisiologico nadir |
|
Interpretazione |
Cortisolo alle ore 24 > 7.5 µg/dL (207 nmol/L) identifica i pazienti con sindrome di Cushing |
| Attendibilità e ripetibilità dei risultati | Sensibilità 96%, specificità 100% |
| Giudizio complessivo costo beneficio e costo-efficacia |
Test da effettuarsi in regime di ricovero ospedaliero (raramente disponibile). |
|
Bibliografia |
|
Test con desametasone
Maria Rosaria Ambrosio1 & Romolo Dorizzi2
1Sezione di Endocrinologia, Dipartimento di Scienze Biomediche e Terapia Avanzate Università degli Studi di Ferrara
2Laboratorio, UO Corelab-Laboratorio Unico di Area Vasta Romagna, Pievesestina di Cesena (FC)
I test di soppressione con desametasone valutano la risposta delle cellule corticotrope al feed-back negativo dei glucocorticoidi, inibitorio sulla secrezione di ACTH, e sono usati per lo studio dell’asse HPA e per la diagnosi differenziale delle iperfunzioni surrenaliche.
Con i comuni metodi di dosaggio, la presenza di desametasone non influenza la rilevazione del cortisolo su campioni di siero, saliva o urine. Infatti, gli anticorpi usati nei comuni immuno-assay sono rivolti verso l’anello D della molecola e reagiscono molto poco con il desametasone che presenta nell’anello D un’alfa-metilazione in posizione 16.
| Test a basse dosi overnight (o test di Nugent) | |
| Indicazioni | Test di screening per ipercortisolismo |
| Meccanismo d’azione | Nei soggetti normali il DXM determina la riduzione della cortisolemia, mediante la soppressione dell’asse ipotalamo-ipofiso-surrene |
| Controindicazioni | Nessuna |
| Materiale necessario per l’esecuzione | 2 cps di Desametasone (Decadron) da 0.5 mg |
| Relazione con età, sesso, peso corporeo, gravidanza | Il trattamento estrogenico e la gravidanza, aumentando la CBG aumentano i valori di cortisolemia. I valori di cut-off solitamente impiegati non sono utilizzabili |
| Precauzioni | Nessuna |
| Procedure abbinabili | Può essere eseguito subito dopo la raccolta delle urine per CLU e, nel paziente ospedalizzato, il desametasone può essere somministrato subito dopo il prelievo per cortisolemia h 24 |
| Esecuzione | Somministrazione fra le ore 23 e 24 di 2 cps da 0.5 mg di Desametasone (NB: nei bambini può essere usata una dose di 0.3 mg/m2 di superficie corporea). Prelievo venoso: fra le ore 8 e 9 del mattino successivo. |
| Dosaggio | Cortisolemia |
| Possibili effetti collaterali | Nessuno |
| Parametri da monitorare durante l’esecuzione | Nessuno |
| Manovre da eseguire dopo la fine del test | Nessuna |
| Valutazione risultati | Cut-off (valore al di sotto del quale si sopprime la cortisolemia nel soggetto normale): variabile fra 1.2 e 5 μg/dL. La scelta del cut-off influenza il risultato. Cut-off più elevato (per esempio 5 μg/dL): alta specificità del test (i falsi positivi sono pochi, cioè il paziente che non mostra soppressione del cortisolo ha elevata probabilità di avere la malattia), ma bassa sensibilità (i falsi negativi sono tanti, cioè un congruo numero di pazienti con la malattia si sopprime sotto quel cut-off). Cut-off basso (per esempio 1.2 μg/dL): aumenta la sensibilità (fino al 100%) (con diminuzione dei falsi negativi, cioè di coloro che si sopprimono sotto quel valore avendo la malattia), ma si riduce la specificità (fino al 41%) (con aumento dei falsi positivi, cioè i normali che non si sopprimono). Le linee guida dell’Endocrine Society del 2008 hanno indicato come valore limite quello di 1.8 μg/dL (50 nmol/L), perché, essendo questo test il primo test di screening per l’ipercortisolismo, si richiede una più alta sensibilità (seppur a discapito della specificità, con un aumento dei falsi positivi). |
| Interpretazione | La positività di questo test (mancata soppressione) con un contemporaneo riscontro di valori elevati di CLU rafforza il sospetto clinico di ipercortisolismo e richiede l’esecuzione di altri test diagnostici. |
| Attendibilità e ripetibilità dei risultati | L'assorbimento del farmaco può essere variabile. Falsi positivi del test (mancata soppressione): durante il trattamento con fenobarbital, carbamazepina, fenitoina, rifampicina (per aumento della clearance del farmaco, che determina diminuzione delle concentrazioni plasmatiche di desametasone); durante trattamento estrogenico orale (e non transdermico) nel 50% dei casi (per aumento di CBG); casi di pseudo-Cushing. I farmaci implicati andrebbero sospesi per almeno 6 settimane. |
| Giudizio complessivo costo beneficio e costo-efficacia | È un test di semplice esecuzione, poco costoso, che può essere eseguito in ambulatorio. |
| Test di Liddle, 2 mg DXM x 2 gg | |
| Indicazioni | Test confermatorio di ipercortisolismo |
| Meccanismo d’azione | La somministrazione di DXM determina la riduzione della cortisolemia nei soggetti normali, mediante la soppressione dell’asse HPA |
| Controindicazioni | Nessuna |
| Materiale necessario per l’esecuzione | 8 cps di Desametasone (Decadron) da 0.5 mg. |
| Relazione con età, sesso, peso corporeo, gravidanza | Il trattamento estrogenico e la gravidanza, aumentando la CBG, aumentano i valori di cortisolemia. I valori di cut-off solitamente impiegati non sono utilizzabili. |
| Precauzioni | Controllo della glicemia nel paziente diabetico e della potassiemia nel paziente iperteso. |
| Esecuzione |
Somministrazione di 1 cp di Desametasone da 0.5 mg ogni 6 ore per 48 ore
|
| Dosaggio | Il dosaggio della cortisolemia è preferibile a quello del CLU (che mostra minore sensibilità e specificità). Nell’esecuzione dei due test (test di Nugent e test di Liddle) è utile (laddove disponibile) il dosaggio del desametasone: ciò consente di verificare se il farmaco è stato assunto e normalmente metabolizzato, e di meglio interpretare il risultato dei test (in particolare se positivi). |
| Possibili effetti collaterali | Nessuno |
| Parametri da monitorare durante l’esecuzione | Nessuno |
| Manovre da eseguire dopo la fine del test | Nessuna |
| Valutazione risultati | La scelta del cut-off influenza il risultato. Cut-off più elevato: alta specificità del test (i falsi positivi sono pochi, cioè il paziente che non mostra soppressione del cortisolo ha elevata probabilità di avere la malattia), ma bassa sensibilità (i falsi negativi sono tanti, cioè un congruo numero di pazienti con la malattia si sopprime sotto quel cut-off). Cut-off basso: aumenta la sensibilità (con diminuzione dei falsi negativi, cioè di coloro che si sopprimono sotto quel valore avendo la malattia), ma si riduce la specificità (con aumento dei falsi positivi, cioè i normali che non si sopprimono). |
| Interpretazione | Test positivo (mancata soppressione): diagnostico di ipercortisolismo. |
| Attendibilità e ripetibilità dei risultati | Cortisolemia > 1.8 μg/dL identifica correttamente il 98% dei pazienti ipercortisolemici. |
| Giudizio complessivo costo beneficio e costo-efficacia | Test confermatorio: aggiunge maggior forza, nei casi dubbi, alla risposta positiva del test di Nugent. |
| Test ad alte dosi (8 mg x 2 gg oppure 8 mg overnight) | |
| Indicazioni | Diagnosi dell’eziologia dell’ipercortisolismo ACTH-dipendente: diagnosi differenziale tra malattia di Cushing e ipercortisolismo da ACTH ectopico. |
| Meccanismo d’azione | La secrezione di ACTH nella malattia di Cushing è solo parzialmente resistente al feed-back negativo indotto dai glucocorticoidi, pertanto dosaggi più elevati di desametasone riescono a sopprimere la secrezione di ACTH nei pazienti con malattia di Cushing, sopprimendo così l’asse ipotalamo-ipofisi-surrene; ciò non accade, invece, nei tumori neuroendocrini che producono ACTH ectopico (ad esempio il carcinoma a piccole cellule del polmone). |
| Controindicazioni | Psicosi, diabete mellito non controllato, ipopotassiemia grave. |
| Materiale necessario per l’esecuzion |
|
| Relazione con età, sesso, peso corporeo, gravidanza | Il trattamento estrogenico e la gravidanza, aumentando la CBG, aumentano i valori di cortisolemia. I valori di cut-off solitamente impiegati non sono utilizzabili. |
| Precauzioni | Controllo della glicemia nel paziente diabetico e della potassiemia nel paziente iperteso. Controllo dello stato psicologico. |
| Esecuzione | Test 8 mg x 2 giorni: somministrare 4 cps di DXM da 0.5 mg ogni 6 ore per 48 ore.
Raccolta urine 24 ore il giorno prima di iniziare l'assunzione delle cps e durante il secondo giorno di somministrazione di DXM. Test 8 mg overnight: somministrare 16 cps da 0.5 mg di DXM fra le h 23 e 24 |
| Dosaggi |
Test 8 mg x 2 giorni
Test 8 mg overnight: prelievo per cortisolemia (singolo) alle h 8 della mattina prima e di quella dopo la somministrazione delle compresse. |
| Possibili effetti collaterali | Disturbi psichici, scompenso glico-metabolico. |
| Parametri da monitorare durante l’esecuzione | Glicemia, elettroliti, pressione arteriosa |
| Manovre da eseguire dopo la fine del test | Nessuna |
| Valutazione risultati |
Soggetto normale
Malattia di Cushing:
Ipercortisolismo da ACTH ectopico: la vasta maggioranza dei pazienti non mostra soppressione a questo test. |
| Interpretazione | Test positivo (mancata soppressione): ipercortisolismo da probabile secrezione ectopica di ACTH.
Considerare che:
|
| Attendibilità e ripetibilità dei risultati | Sovrapposizione di risultati fra malattia di Cushing e sindrome da ACTH ectopico. |
| Giudizio complessivo costo beneficio e costo-efficacia | Il test non va impiegato da solo nella diagnosi differenziale fra queste 2 forme. |
NB: Nonostante tutti i test di soppressione al desametasone siano utili, nessuno di essi da solo ci consente di categorizzare correttamente i pazienti con ipercortisolismo ACTH-dipendente. Le possibili fonti di errore sono:
- inappropriata raccolta delle urine
- elevati livelli di CBG (corticosteroid-binding globulin) con concomitante aumento dei livelli di cortisolo (come accade, ad esempio, nelle donne che assumono estrogeni o in gravidanza)
- variazioni ultradiane nella secrezione ormonale del cortisolo
- variazioni nell’assunzione e nel metabolismo del desametasone: ad esempio farmaci che inducono attivazione del CYP3A4 (come i barbiturici, la fenitoina, la rifampicina, la carbamazepina, il mitotane, ecc) aumentano il metabolismo del desametasone e di altri steroidi.
Bibliografia
- Esfahanian F, et al. Overnight dexamethasone suppression test in the diagnosis of Cushing's disease. Acta Med Iran 2010, 48: 222-5.
- Kungpanichkul N. Comparison of efficacy between 1 mg overnight dexamethasone suppression test and 2-day low dose dexamethasone suppression test for diagnosis of Cushing's syndrome. J Med Assoc Thai 2010, 93: 27-33.
- Nieman LK, et al. The diagnosis of Cushing's syndrome: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2008, 93: 1526-40.
- Findling JW, et al. The low-dose dexamethasone suppression test: a reevaluation in patients with Cushing's syndrome. J Clin Endocrinol Metab 2004, 89: 1222-6.
- Zarkovic M, et al. Discriminatory value of low-dose dexamethasone suppression test in establishing the diagnosis and differential diagnosis of Cushing's syndrome. J Clin Endocrinol Metab 2004, 89: 1486.
- Elamin MB, et al. Accuracy of diagnostic tests for Cushing's syndrome: a systematic review and metaanalyses. J Clin Endocrinol Metab 2008, 93: 1553-62.
Test con CRH
Maria Rosaria Ambrosio1 & Romolo Dorizzi2
1Sezione di Endocrinologia, Dipartimento di Scienze Biomediche e Terapia Avanzate Università degli Studi di Ferrara
2Laboratorio, UO Corelab-Laboratorio Unico di Area Vasta Romagna, Pievesestina di Cesena (FC)
| Test con CRH | |
| Indicazioni | Diagnosi differenziale tra le forme di ipercortisolismo ACTH-dipendente (malattia di Cushing e secrezione ectopica di ACTH). Non va utilizzato per porre diagnosi di ipercorticosurrenalismo. Potrebbe essere eseguito anche per la diagnosi differenziale tra ipocorticosurrenalismo secondario (da causa ipofisaria) e ipocorticosurrenalismo terziario (da causa ipotalamica), ma la rilevanza clinica di tale distinzione è trascurabile. |
| Meccanismo d’azione | Il test si basa sulla maggiore presenza di recettori per il CRH sulle cellule ipofisarie ACTH-secernenti rispetto a quelle tumorali neuroendocrine ectopiche ACTH-secernenti e prevede una risposta maggiore nei pazienti con adenoma ipofisario. |
| Controindicazioni | Nessuna. |
| Materiale necessario per l’esecuzione | CRH 1 μg/kg oppure 100 μg. In considerazione dell’elevata omologia tra le sequenze di CRH tra le varie specie, in particolare nella regione amino-terminale, essenziale per l’attività biologica della molecola, per l’esecuzione del test è possibile utilizzare sia la sequenza ovina che quella umana. |
| Relazione con età, sesso, peso corporeo, gravidanza | Il test può essere eseguito in qualsiasi momento della giornata. |
| Precauzioni | Nessuna. |
| Procedure abbinabili | Può essere usato in combinazione con desametasone o desmopressina. |
| Esecuzione | Dopo due prelievi basali per ACTH e cortisolo ad intervalli di 15 minuti (tempi -15’ e 0), iniezione endovenosa di CRH, seguita da prelievi ai tempi 15’, 30’, 45’, 60’, 90’, 120’. |
| Dosaggio | ACTH e cortisolo. |
| Possibili effetti collaterali | Flush transitorio al volto che non richiede l’interruzione dell’esame. |
| Parametri da monitorare durante l’esecuzione | Nessuno. |
| Manovre da eseguire dopo la fine del test | Nessuna. |
| Valutazione risultati |
Valutazione qualitativa (aumento percentuale) e non quantitativa (valori assoluti).
|
| Interpretazione |
Ipercortisolismo ectopico: aumento inferiore di cortisolo e ACTH. |
| Attendibilità e ripetibilità dei risultati |
Ampia variabilità della risposta tra i diversi soggetti e nello stesso soggetto. |
| Giudizio complessivo costo beneficio e costo-efficacia |
Il test non consente la diagnosi di ipercortisolismo.
|
| Bibliografia |
|
Test con CRH e desametasone
Maria Rosaria Ambrosio1 & Romolo Dorizzi2
1Sezione di Endocrinologia, Dipartimento di Scienze Biomediche e Terapia Avanzate Università degli Studi di Ferrara
2Laboratorio, UO Corelab-Laboratorio Unico di Area Vasta Romagna, Pievesestina di Cesena (FC)
| Test con CRH e desametasone | |
| Indicazioni | Diagnosi differenziale tra pseudoCushing e ipercortisolismo ACTH-dipendente. |
| Meccanismo d’azione | Si presuppone che i pazienti con malattia di Cushing abbiano maggiore resistenza alla soppressione e maggior risposta al CRH. |
| Controindicazioni | Nessuna |
| Materiale necessario per l’esecuzione | CRH ovino (o umano), 1 μg/kg oppure 100 μg e desametasone 0.5 mg (Decadron), 8 cps. |
| Precauzioni | Nessuna |
| Esecuzione |
|
| Dosaggio | Cortisolemia |
| Possibili effetti collaterali | Flush transitorio al volto che non richiede l’interruzione dell’esame. |
| Parametri da monitorare durante l’esecuzione | Nessuno |
| Manovre da eseguire dopo la fine del test | Nessuna |
| Valutazione risulta |
|
| Interpretazione | Una cortisolemia > 1.4 μg/dL identifica tutti i casi di ipercortisolismo ACTH-dipendente. |
| Attendibilità e ripetibilità dei risultati | L’accuratezza di questo test può essere limitata dall’uso di farmaci che sono in grado di influire sul metabolismo del desametasone; in tale caso sembrerebbero ridursi tanto la sensibilità, quanto la specificità del test. Per escludere falsi positivi troverebbe indicazione il dosaggio dei livelli di desametasone prima della somministrazione del CRH. |
| Giudizio complessivo costo beneficio e costo-efficacia | Questo test dovrebbe essere riservato a quei rari pazienti in cui i risultati degli altri test sono equivoci. |
| Bibliografia |
|
Test con desmopressina
Maria Rosaria Ambrosio1 & Romolo Dorizzi2
1Sezione di Endocrinologia, Dipartimento di Scienze Biomediche e Terapia Avanzate Università degli Studi di Ferrara
2Laboratorio, UO Corelab-Laboratorio Unico di Area Vasta Romagna, Pievesestina di Cesena (FC)
| Test con desmopressina | |
| Indicazioni | Diagnosi differenziale tra le forme di ipercortisolismo ACTH-dipendente: tra malattia di Cushing (adenoma ipofisario ACTH-secernente) e forme ectopiche (ipercortisolismo da secrezione ectopica di ACTH). |
| Meccanismo d’azione | Il test si basa sulla presenza e la up-regulation di recettori V3 per la vasopressina sulle cellule ipofisarie ACTH-secernenti e prevede una risposta maggiore nei pazienti con adenoma ipofisario (ma recettori V3 sono stati dimostrati anche sulle cellule dei carcinoidi!). |
| Controindicazioni | Nessuna |
| Materiale necessario per l’esecuzione | DDAVP (Minirin) 1 fl ev da 10 μg |
| Relazione con età, sesso, peso corporeo, gravidanza | Il test va eseguito al mattino. |
| Precauzioni | Ridurre l’apporto idrico prima dell’esecuzione del test. Anche se DDAVP manca degli effetti vasocostrittori di AVP, mantiene quelli sulle piastrine, quindi va usato con cautela nei pazienti con complicanze cardiovascolari. |
| Esecuzione | Dopo due prelievi basali, ai tempi -15’ e 0, iniezione endovenosa di DDAVP, seguita da prelievi ai tempi +15’, +30’, +45’, +60’, +90’. |
| Dosaggio | Cortisolo e ACTH |
| Possibili effetti collaterali | Flushing al volto transitorio, ritenzione urinaria (raramente). |
| Parametri da monitorare durante l’esecuzione | Nessuno |
| Manovre da eseguire dopo la fine del test | Nessuna |
| Valutazione risultati | Valutazione qualitativa (aumento percentuale) e non quantitativa (valori assoluti). |
| Interpretazione |
Malattia di Cushing:
Ipercortisolismo ectopico:
|
| Attendibilità e ripetibilità dei risultati |
Falsi negativi (mancato aumento di ACTH) nel 25% dei pazienti con malattia di Cushing. |
| Giudizio complessivo costo beneficio e costo-efficacia |
Il test è meno costoso del CRH, ma meno sensibile e specifico, anche se alcuni studi hanno evidenziato pari specificità e sensibilità rispetto al CRH+desametasone.
|
| Bibliografia |
|
Cateterismo dei seni petrosi inferiori
Maria Rosaria Ambrosio1 & Romolo Dorizzi2
1Sezione di Endocrinologia, Dipartimento di Scienze Biomediche e Terapia Avanzate Università degli Studi di Ferrara
2Laboratorio, UO Corelab-Laboratorio Unico di Area Vasta Romagna, Pievesestina di Cesena (FC)
| Cateterismo dei seni petrosi inferiori | |
| Indicazioni | Diagnosi differenziale tra le forme di ipercortisolismo ACTH-dipendente: tra malattia di Cushing (adenoma ipofisario ACTH-secernente) e forme ectopiche (ipercortisolismo da secrezione ectopica di ACTH). |
| Meccanismo d’azione | Ricerca un gradiente nelle concentrazioni di ACTH fra i seni petrosi (a livello ipofisario) e la periferia, mediante prelievi simultanei bilaterali prima e dopo somministrazione di CRH. |
| Controindicazioni | Allergia a mezzo di contrasto |
| Materiale necessario per l’esecuzione |
CRH ovino (o umano), 1 μg/kg oppure 100 μg. |
| Relazione con età, sesso, peso corporeo, gravidanza | Può essere eseguito in qualsiasi momento della giornata. |
| Precauzioni | Attenzione alla trombofilia presente nell’ipercortisolismo (premedicazione con eparina) e alla funzione renale dopo mdc nel paziente diabetico. |
| Esecuzione |
|
| Dosaggio | ACTH |
| Possibili effetti collaterali |
Gravi: incidenti cerebro-vascolari, embolia polmonare, trombosi venosa profonda. |
| Parametri da monitorare durante l’esecuzione | Nessuno |
| Manovre da eseguire dopo la fine del test | Assicurare emostasi. |
| Valutazione risultati |
Questo test non distingue gli individui normali (o con pseudo-Cushing) da quelli con malattia di Cushing; va quindi riservato solo ai pazienti con diagnosi certa di ipercortisolismo e in assenza di fase di ciclicità della malattia. |
| Interpretazione |
Gradiente centro-periferia di ACTH (la concentrazione in un campione prelevato dal seno petroso diviso per quella in un campione prelevato da vena periferica):
|
| Attendibilità e ripetibilità dei risultati |
Il test va eseguito solo in presenza di ipercortisolismo (per almeno 6-8 settimane, per garantire la soppressione delle cellule corticotrope normali). |
| Giudizio complessivo costo beneficio e costo-efficacia |
Test invasivo, costoso, con organizzazione complessa, da eseguire solo in centri di riferimento con ampia esperienza. Il test non va eseguito:
|
| Bibliografia | Shi X, et al. Assessment of Bilateral Inferior Petrosal Sinus Sampling in the diagnosis and surgical treatment of the ACTH-dependent Cushing's syndrome: A comparison with other tests. Neuro Endocrinol Lett 2011, 32: 865-73. |
Test con ACTH per cortisolemia
Maria Rosaria Ambrosio1 & Romolo Dorizzi2
1Sezione di Endocrinologia, Dipartimento di Scienze Biomediche e Terapia Avanzate Università degli Studi di Ferrara
2Laboratorio, UO Corelab-Laboratorio Unico di Area Vasta Romagna, Pievesestina di Cesena (FC)
| Test con ACTH a basse dosi (1 µg) | |
| Indicazioni | Diagnosi di iposurrenalismo: deficit di ACTH e m. di Addison. |
| Meccanismo d’azione | Valuta la riserva surrenalica di cortisolo. L’ACTH stimola il corticosurrene a secernere cortisolo. Nei casi di ipo/atrofia corticosurrenalica (deficit centrale di ACTH; m. di Addison), la risposta secretoria di cortisolo è ridotta/assente. |
| Controindicazioni | Nessuna |
| Materiale necessario per l’esecuzione | ACTH (Synachten) 1 μg (da ricavare dalla confezione commerciale da 250 μg in 1 mL) |
| Relazione con età, sesso, peso corporeo, gravidanza | Il test deve essere eseguito al mattino, per ridurre il rischio di diagnosticare iposurrenalismo nei soggetti normali. |
| Precauzioni | Attenzione a iposurrenalismo durante il temporaneo wash-out dalla eventuale terapia sostitutiva corticosteroidea. |
| Condizioni preliminari |
|
| Esecuzione | Diluire 1 fiala di Synachten da 250 μg in 250 mL di soluzione fisiologica e mescolare accuratamente: 1 mL di questa soluzione diluita contiene 1 μg di ACTH, che è la quantità da iniettare. Dopo il prelievo basale, iniezione in bolo ev della soluzione contenente ACTH, seguita da prelievi a 30 e 60 minuti. |
| Dosaggio | Cortisolemia |
| Possibili effetti collaterali | Molto raramente reazioni allergiche. |
| Parametri da monitorare durante l’esecuzione | Nessuno |
| Manovre da eseguire dopo la fine del test | Nel paziente in terapia sostitutiva steroidea, sospesa prima dell’esame, riprendere la terapia alla fine del test in attesa del risultato. |
| Valutazione risultati | Picco di cortisolemia inferiore ai valori minimi va ritenuto indicativo di iposurrenalismo (completo o parziale) e trova indicazione al trattamento sostitutivo steroideo anche in relazione al contesto clinico (presenza di altri deficit ipofisari, quadro clinico). Considerare le interferenze nel dosaggio del cortisolo. |
| Interpretazione | Iposurrenalismo: picco cortisolemia < 18-22 μg/dL. |
| Attendibilità e ripetibilità dei risultati | Test ripetibile (utile ad es. nella sorveglianza dello sviluppo di iposurrenalismo secondario dopo radioterapia). Il cut-off di normale risposta dipende dal laboratorio locale e comunque non vi è ancora uniformità in letteratura. I risultati del test vanno sempre confrontati con il quadro clinico di sospetto iposurrenalismo. In caso di risposte border-line o di dubbio diagnostico possono essere eseguiti altri test dinamici di valutazione della funzione ipofiso-surrenalica (es test ipoglicemia insulinica). |
| Giudizio complessivo costo beneficio e costo-efficacia |
È un test semplice, senza controindicazioni, ripetibile nel tempo, che usa dosi fisiologiche e permette di scoprire deficit parziali. |
| Bibliografia |
|
| Test con ACTH ad alte dosi (250 µg) | |
| Indicazioni | Diagnosi di iposurrenalismo: deficit di ACTH e m. di Addison. |
| Meccanismo d’azione | Valuta la riserva surrenalica di cortisolo. L’ACTH stimola il corticosurrene a secernere cortisolo. Nei casi di ipo/atrofia corticosurrenalica (deficit centrale di ACTH; m. di Addison), la risposta secretoria di cortisolo è ridotta/assente. |
| Controindicazioni | Nessuna |
| Materiale necessario per l’esecuzione | ACTH (Synachten) 250 μg |
| Relazione con età, sesso, peso corporeo, gravidanza | Il test deve essere eseguito al mattino, per ridurre il rischio di diagnosticare iposurrenalismo nei soggetti normali. |
| Precauzioni | Attenzione a iposurrenalismo durante il temporaneo wash-out dalla eventuale terapia sostitutiva corticosteroidea. |
| Condizioni preliminari |
|
| Esecuzione | Dopo il prelievo basale, iniezione in bolo ev di 250 mcg di cosintropina (Synacten), oppure somministrazione im, con valutazione dei livelli di cortisolo plasmatico ai tempi 0, 30 e 60. |
| Dosaggio | Cortisolemia |
| Possibili effetti collaterali | Molto raramente reazioni allergiche. |
| Parametri da monitorare durante l’esecuzione | Nessuno |
| Manovre da eseguire dopo la fine del test | Nel paziente in terapia sostitutiva steroidea, sospesa prima dell’esame, riprendere la terapia alla fine del test in attesa del risultato. |
| Valutazione risultati | Picco di cortisolemia inferiore ai valori minimi va ritenuto indicativo di iposurrenalismo (completo o parziale) e trova indicazione al trattamento sostitutivo steroideo anche in relazione al contesto clinico (presenza di altri deficit ipofisari, quadro clinico). Considerare le interferenze nel dosaggio del cortisolo. |
| Interpretazione | Iposurrenalismo: picco cortisolemia < 18-22 μg/dL (< 16 μg/dL se ACTH somministrato per via im) |
| Attendibilità e ripetibilità dei risultati | Test ripetibile con il vantaggio di poter somministrare l'ACTH anche per via intramuscolare.
|
| Giudizio complessivo costo beneficio e costo-efficacia |
Questa dose di cosintropina determina l’esposizione a livelli di ACTH sovrafisiologici, pertanto rischia di non identificare casi di deficit di ACTH parziali o moderati; quando l’insufficiena surrenalica è di recente insorgenza le ghiandole surrenali possono non essere ancora atrofiche e pertanto sono in grado di rispondere allo stimolo con ACTH in maniera normale; in questi casi è necessario eseguire un ACTH a basse dosi (1 mcg) per confermare la diagnosi. |
| Bibliografia |
|

