Scelta della terapia ipoglicemizzante in relazione agli stadi della malattia renale
Maria Paola Luconi & Elena Tortato
UOC Malattie Metaboliche e Diabetologia, INRCA IRCCS Ancona
(aggiornato al 28 giugno 2021)
Si distinguono diversi stadi di malattia renale cronica (CKD), a seconda della diminuzione del filtrato glomerulare, ed indipendentemente dalla concomitante presenza o assenza di albuminuria (tabella 1).
| Tabella 1 Stadi della Malattia Renale Cronica |
||
| Stadio | Funzione renale |
eGFR (mL/min/1.73 m²) |
| I | Normale o aumentata | ≥ 90 |
| II | Lievemente compromessa | 60-89 |
| IIIa | Compromissione moderata | 45-59 |
| IIIb | Compromissione da moderata a severa | 30-44 |
| IV | Compromissione severa | 15-29 |
| V | Insufficienza renale | < 15 |
Nella scelta della terapia ipoglicemizzante in pazienti con CKD andrebbero considerati diversi aspetti: la possibilità di limitare la progressione di malattia; il rischio CV e ipoglicemico; la necessità di adeguare il fabbisogno insulinico o i dosaggi delle altre molecole al GFR, qualora < 60 mL/min/m2, per ridotta clearance del farmaco e compromessa gluconeogenesi renale.
La metformina resta il trattamento di prima linea nei pazienti con DM2, inclusi quelli con CKD; tuttavia, non andrebbe iniziata se GFR < 45 mL/min/1.73 m2, adeguata nel dosaggio se GFR 30-45 mL/min/1.73 m2 e sospesa se GFR < 30 mL/min/1.73 m2. Inoltre, si raccomanda una temporanea sospensione, in previsione di interventi chirurgici ed esami contrastografici, o in situazioni che potrebbero favorire deplezione volemica con insufficienza renale acuta secondaria (1).
Secondo le più recenti linee guida ADA, in presenza di ND e albuminuria, andrebbe scelto un SGLT2-In in grado di ridurre la progressione di malattia renale (evidenza primaria o derivata dagli studi di esito CV), indipendentemente dal livello di HbA1c (basale e target) e dall’uso di metformina. Se controindicato o mal tollerato, in alternativa a questo, potrebbe essere considerato un GLP1-RA con comprovato beneficio CV. Molecole di entrambe le classi potrebbero essere utilizzate, anche in associazione, nelle persone con CKD di qualsiasi eziologia e alto rischio CV. Anche se l’efficacia ipoglicemizzante delle gliflozine si riduce con la progressiva decurtazione del filtrato renale, che richiede pertanto aggiustamenti posologici, altri effetti benefici (oltre la glicosuria) appaiono conservati. I diversi GLP1-RA richiedono aggiustamenti variabili della dose in base al GFR, di cui deve essere tenuto conto nell’uso delle associazioni pre-costituite con insulina basale, degludec-liraglutide e glargine-lixisenatide (1).
Gli inibitori della dipeptidil-peptidasi-4 (DPP4-In o gliptine) mostrano percentuali variabili di escrezione renale: sitagliptin ~87%, vildagliptin ~85%, saxagliptin ~75%, linagliptin ~5%, alogliptin 60-71%; possono pertanto essere utilizzati anche in diabetici tipo 2 con insufficienza renale severa previo adeguamento della dose.
Le sulfaniluree sono simili per meccanismo di azione, ma differiscono per cinetica; gliclazide e glibenclamide hanno escrezione prevalentemente renale, mentre la glimepiride bilio-fecale. La gliclazide viene trasformata a livello epatico in metaboliti inattivi, escreti poi dal rene; questo comporta minor rischio di ipoglicemia anche in persone con CKD moderato-severa.
La repaglinide (classe glinidi) ha eliminazione prevalentemente epatica, potrebbe essere potenzialmente utilizzata fino a valori di eGFR molto ridotti, ma per carenza di dati scientifici, non si dispone di una indicazione chiara in scheda tecnica.
Il pioglitazone (classe tiazolidinedioni) ha metabolismo quasi esclusivamente epatico e può essere utilizzato senza aggiustamento di dose fino a valori di eGFR di 5 mL/min/1.73 m2. Va tuttavia tenuto conto dell’aumentato rischio di edema e scompenso cardiaco nelle persone con CKD avanzata.
L’acarbosio (classe inibitori dell’α-glucosidasi), agendo sull’enzima gastro-intestinale che scinde i carboidrati complessi e i disaccaridi in monosaccaridi, è utilizzabile sia in caso di insufficienza epatica che renale, fino a valori di GFR di 25 mL/min/1.73 m2 (per valori inferiori tende poi ad accumularsi).
La terapia insulinica è di scelta in caso di CKD moderato-severa, ma richiede riduzioni di dosaggio per minore escrezione renale e aumentata emivita. Il fabbisogno insulinico giornaliero si riduce in relazione all’eGFR:
- 30-60 mL/min/1.73 m2 di circa il 25%;
- < 30 mL/min/1.73 m2 fino al 50%;
- in caso di emodialisi (ESRD) scende ulteriormente, perché quest’ultima impatta sull’insulino-resistenza e sui livelli di uremia. È invece più variabile la risposta clinica alla dialisi peritoneale, che utilizza un liquido di scambio composto prevalentemente da D-glucosio monoidrato (o destrosio) ed elettroliti (2).
Nella tabella 2 seguente sono illustrate le diverse classi di ipoglicemizzanti e le modifiche di dosaggio suggerite in funzione del filtrato glomerulare, fatta eccezione per l’insulina.
| Tabella 2 Ipoglicemizzanti disponibili ed aggiustamento posologico secondo filtrato glomerulare |
||||||||
| Controindicato | Cautela/modifica dosi | Utilizzabile | ||||||
| eGFR (mL/min/1.73 m2) | >90 | 90-60 | 59-50 | 49-45 | 44-30 | 29-15 | < 15 | dialisi |
| Biguanidi | ||||||||
| Metformina | Inizia terapia | Dose ridotta | No | |||||
| SGLT2-Inibitori (Gliflozine) | ||||||||
| Canagliflozin | 100 mg/die (inizio), aumentabile a 300 mg/die | 100 mg/die (inizio o prosecuzione) | 100 mg/die (solo prosecuzione) | |||||
| Dapagliflozin(#) | 10 mg/die (inizio) | 10 mg/die (prosecuzione) | No | |||||
| Empagliflozin | 10 mg/die (inizio), aumentabile a 25 mg/die | 10 mg/die (prosecuzione) | No | |||||
| Ertugliflozin | 5 mg/die (inizio), aumentabile a 15 mg/die | 5-15 mg/die (prosecuzione) | No | |||||
| Agonisti recettoriali del GLP-1 | ||||||||
| Dulaglutide (§) | 0.75 mg/settimana o 1.5 mg/settimana | No | ||||||
| Exenatide | 5 µg x 2/die per almeno 30 giorni (inizio), aumentabile a 10 µg x 2/die | 5 µg x 2/die (o con cautela 10 µg x 2/die) | No | |||||
| Exenatide LAR | 2 mg/settimana | No | ||||||
| Liraglutide | 1.2 mg/die o 1.8 mg/die (dose di partenza 0.6 mg/di | No | ||||||
| Lixisenatide | 10 µg/die per 14 giorni -> 20 µg/die | No | ||||||
| Semaglutide | 0.25 mg/settimana per 4 settimane (dose di partenza) -> 0.5 mg/settimana, aumentabile dopo 4 settimane a 1 mg/settimana | No | ||||||
| Inibitori DPP-4 (gliptine) | ||||||||
| Alogliptin | 25 mg/die | 12.5 mg/die | 6.25 mg/die | |||||
| Linagliptin | 5 mg/die | |||||||
| Saxagliptin | 5 mg/die | 2.5 mg/die | No | |||||
| Sitagliptin | 100 mg/die | 50 mg/die | 25 mg/die | |||||
| Vildagliptin | 50 mg x 2/die | 50 mg/die in mono-somministrazione | ||||||
| Sulfaniluree e glinidi | ||||||||
| Glibenclamide | Dose secondo necessità clinica | Cautela d’uso e aggiustamento posologico | No | |||||
| Gliclazide | da 30 a 120 mg/die (formulazione RM), da 80 a 240 mg/die (formulazione immediata) | Cautela d’uso e aggiustamento posologico | No | |||||
| Glimepiride | Da 1 a 6 mg/die | Cautela d’uso e aggiustamento posologico | No | |||||
| Repaglinide | Da 0.5 mg/die (da titolare secondo necessità) | Cautela d’uso e aggiustamento posologico | No | |||||
| Glitazoni | ||||||||
| Pioglitazone | 15 o 30 mg/die (inizio terapia), aumentabile a 45 mg/die | No (eGFR < 5) | ||||||
| Inibitori dell’α-glucosidasi |
||||||||
| Acarbosio | Da 50 mg x 1-3/die, a 100 mg x 1-3/die | No (eGFR < 25) | ||||||
(#) Il dapaglifozin è utilizzabile alla dose di 10 mg/die fino a eGFR 30 mL/min, se coesistenza di scompenso cardiaco a ridotta frazione di eiezione
(§) In attesa di commercializzazione/approvazione le dosi da 3.0 mg/settimana o 4.5 mg/settimana
Bibliografia
- American Diabetes Association. 9. Pharmacologic approaches to glycemic treatment: standards of medical care in diabetes – 2021. Diabetes Care 2021, 44: S111-24.
- AMD-SID. Standard italiani per la cura del diabete mellito. 2018.
Diabete post-trapianto
Egle Ansaldi
SSD Endocrinologia e Malattie Metaboliche, ASO SS. Antonio e Biagio e C. Arrigo, Alessandria
Il diabete mellito post-trapianto (NODAT, new onset diabetes after transplant) può realizzarsi dopo il trapianto di numerosi organi solidi e nell'80% dei casi si sviluppa entro tre mesi dall'intervento. Presenta un'incidenza diversa in base all'organo trapiantato e alla patologia di base: si stima il 20-50% per il trapianto di rene, 9-21% per quello di fegato, 20% per quello di polmone.
Il NODAT è gravato da un aumentato rischio di insufficienza dell'organo trapiantato, eventi cardiovascolari e mortalità.
I criteri diagnostici sono quelli del diabete mellito tipo 2 definiti dall'ADA.
Fattori di rischio
Oltre a quelli tradizionali del DMT2 (età, familiarità, etnia, obesità), peculiari per il NODAT sono l'insufficienza renale nel periodo pre-trapianto, l’infezione da HCV o CMV e determinati aplotipi. C’è da considerare poi l’effetto dei farmaci immuno-soppressori utilizzati nel periodo post-trapianto: glucocorticoidi, inibitori delle calcineurine, quali tacrolimus e ciclosporina, determinano un deficit secretorio, mentre inibitori di mTOR, come sirolimus, determinano sia un deficit secretorio sia insulino-resistenza. L'effetto diabetogeno è dose-dipendente.
Prevenzione
In fase pre-trapianto ricercare i fattori di rischio per diabete, pregresso GDM, IGT o IFG. In presenza di fattori di rischio, agire sullo stile di vita: alimentazione, attività fisica, riduzione del peso corporeo. Sarebbe utile anche uno screening pre-trapianto con l'esecuzione di OGTT in pazienti con IFG per meglio dosare la terapia immuno-soppressiva in modo da prevenire il NODAT.
Dopo il trapianto i soggetti a rischio devono eseguire una glicemia a digiuno settimanale per un mese, una volta al mese per 6 mesi, ogni 2 mesi fino all'anno; OGTT 3-6 mesi dopo il trapianto.
Trattamento nel peri-operatorio
Subito dopo il trapianto occorre terapia insulinica nel 40% dei pazienti. Si attua uno schema basal-bolus, che cerca di controllare soprattutto le iperglicemie post-prandiali dovute alla terapia steroidea. Indispensabile adeguato autocontrollo per l'instabilità metabolica e il rischio di ipoglicemie legate alle variazioni posologiche di steroidi e immuno-soppressori. L'iperglicemia è dovuta allo stress chirurgico e alle dosi elevate di steroidi. Spesso la terapia insulinica potrà essere sospesa in un secondo tempo. Non essendoci studi ad hoc, i target sono quelli del DMT2 proposti dall'ADA.
Per quanto riguarda gli ipoglicemizzanti orali, la metformina non è farmaco di prima scelta in questi pazienti, che sono sottoposti a terapie complesse con più farmaci. Controindicazione all’uso della metformina è l'IRC. Pertanto, se si decide di utilizzarla, occorre un rigoroso e continuo controllo della funzionalità renale. La terapia steroidea determina soprattutto iperglicemie post-prandiali, pertanto può essere razionale l'uso della repaglinide, secretagogo a breve durata d'azione, che potrebbe essere utilizzata in pazienti con trapianto di rene mentre non esistono dati sui trapiantati di fegato. Occorre cautela nell'associazione con ciclosporina per il rischio di ipoglicemie. Anche l'acarbose, inibitore dell'alfa-glucosidasi, agisce prevalentemente sulle glicemie post-prandiali, è meno potente di altri ipoglicemizzanti orali, ma ha il vantaggio di non determinare ipoglicemie nè incremento di peso, ma spesso determina disturbi gastro-enterici. Le sulfoniluree possono causare episodi ipoglicemici anche gravi in pazienti fragili con IRC o con ridotta funzionalità epatica. Senz'altro non dovrebbero essere utilizzate sulfoniluree a lunga emivita, ma in uno studio retrospettivo non sono stati riportati eventi avversi con l'uso del gliquidone. Il pioglitazone può peggiorare la perdita di massa ossea legata alla terapia immuno-soppressiva e può determinare edemi e scompenso cardiaco in soggetti a rischio. Per quanto riguarda gli inibitori del DPP-4, il sitagliptin si è dimostrato sicuro ed efficace in uno studio di 15 pazienti con NODAT dopo trapianto di rene, perchè non determina ipoglicemie; occorre però adeguare la posologia in caso di IRC, inoltre può determinare un allungamento del QT se usato con la ciclosporina. Il saxagliptin, invece, non determina allungamento del QT, e si è dimostrato efficace in uno studio in trapiantati di rene, come pure il vildagliptin. Sitagliptin e saxagliptin ma non vildagliptin potrebbero interferire sul metabolismo degli immuno-soppressori, aumentandone la concentrazione ematica. Il linagliptin può essere utilizzato anche nell'IRC senza riduzione del dosaggio, perché ha un'eliminazione epatica. Gli analoghi del GLP-1, che possono determinare nausea, vomito e rallentamento della motilità gastroenterica, potrebbero interferire con l'assorbimento dei farmaci immuno-soppressori. Occorrono studi più ampi e di maggior durata con questi farmaci, per valutarne non solo l'efficacia ma la reale sicurezza.
Considerato che nei trapiantati di rene il rischio di eventi cardiovascolari aumenta di 2-3 volte in presenza di NODAT, accanto a un adeguato compenso glicemico è indispensabile uno stretto controllo dei fattori di rischio: pressione arteriosa (< 130/80 mmHg), assetto lipidico (colesterolo LDL < 100 mg/dL), fumo e prescrizione di terapia anti-aggregante.
Bibliografia
- Hornum M, Lindahl J, Zur-Muhlen B, et al. Diagnosis, management and treatment of glucometabolic disorders emerging after kidney transplantation. A position statement from the Nordic Transplantation Societies. Transpl Int 2013, 26: 1049-60.
- Lane JT, Dagogo-Jack S. Approach to the patient with new onset diabetes after transplant (NODAT). J Clin Endocrinol Metab 2011, 96: 3289-97.
- Ghisdal L, Van Laecke S, Abramowicz MJ, et al. New-onset diabetes after renal transplantation. Diabetes Care 2012, 35: 181-8.
Diabete & sport
Giampaolo Magro
SC Endocrinologia e Malattie del Ricambio, AO S. Croce e Carle, Cuneo
INTRODUZIONE
L'esercizio fisico anche moderato è da considerarsi una terapia patogenetica del diabete mellito tipo 2. Un regolare esercizio fisico è, infatti, in grado di interrompere il circolo vizioso: insulino-resistenza → obesità addominale → insulino-resistenza → iperglicemia.
A sostegno di ciò, alcune metanalisi hanno evidenziato l'importante ruolo dell'esercizio fisico aerobico e di resistenza sul compenso glicemico, indipendentemente dalle variazioni del peso corporeo (1). Numerosi studi di intervento su soggetti con intolleranza al glucosio e DM2, come l'Oslo Diet and Exercise Study, hanno dimostrato che un esercizio fisico regolare migliora la tolleranza al glucosio in più del 50% dei soggetti, mentre una ricerca multicentrica condotta in Campania ha evidenziato che si otteneva il miglioramento dell'HbA1c pur con una riduzione del fabbisogno di ipoglicemizzanti orali di circa 1/3. Il Nurses Health Study ha dimostrato che la sola attività di camminare a passo svelto per 60/120 minuti alla settimana è in grado di ridurre del 20-30% il rischio di diabete. Studi di coorte inoltre hanno evidenziato che l'attività fisica continuativa e di grado elevato è associata con una riduzione significativa della mortalità cardiovascolare e generale (2-6).
Gli orientamenti attuali consentono di ritenere che, più che dall’intensità e durata, gli effetti metabolici sono ottenuti dalla ripetitività (almeno 5 volte alla settimana) di un esercizio aerobico leggero (50-60% della V02max) che duri circa 30 minuti. Tradotto in termini pratici ciò significa che una passeggiata di una mezz'oretta a passo svelto (circa 4 km/h) da fare quotidianamente ha una valenza metabolica e terapeutica di grande rilievo.
L’effetto di una sessione di esercizio aerobico sulla sensibilità all’insulina dura da 24 a 72 ore, a seconda della durata e dell’intensità dell’attività. Questo tipo di impegno fisico è realizzabile dalla maggior parte delle persone affette da DM2.
Una recente indagine conoscitiva con questionario a risposta multipla del GAF (Gruppo di Studio Diabete Attività Fisica) ha evidenziato come la pressochè totalità dei pazienti con DM2 (89.8%) ritenga possibile migliorare la propria salute con l'attività fisica, soprattutto se di giovane età, sesso maschile ed elevato grado di scolarità. L'attività fisica è praticata per più di 3 volte/settimana dai pazienti che la ritengono utile per la propria salute (53% vs. 25%).
Le barriere percepite alla pratica dell'attività fisica sono il senso di inadeguatezza fisica, la pigrizia, la mancanza di tempo e la presenza di problemi respiratori. La maggior parte dei pazienti ritiene utile la figura dell'operatore di fitness metabolica nell'ambito dei servizi di Diabetologia, mentre il 94% userebbe strumenti per praticare l'attività fisica se il servizio ne fosse provvisto.
L'esercizio fisico, oltre ad abbassare l'iperglicemia attraverso una miglior azione dell'insulina e a garantire un miglior trasporto di glucosio nella cellula muscolare, apporta anche altri benefici, tra i quali la riduzione degli altri fattori di rischio associati al DM2.
Ipertensione: fattore di rischio cardiovascolare presente in oltre il 60% delle persone con diabete tipo 2. L'OMS ha definito di recente come normali valori di pressione arteriosa < 140/90 mm Hg e borderline tra 140/90 e 160/95 mm Hg, mentre valori pressori maggiori portano alla diagnosi di ipertensione. Recenti studi hanno osservato che un'attività fisica regolare abbassa i livelli di pressione arteriosa nelle persone con diabete di tipo 2. Nei soggetti allenati un'attività fisica regolare comporta una miglior risposta pressoria dei vasi sanguigni, conseguente a migliore elasticità. Gli esercizi, però, devono essere di tipo dinamico e non isometrico. Quest'ultimo, infatti, potrebbe determinare l'aumento delle resistenze periferiche ed essere dannoso per il soggetto iperteso.
Dislipidemie: l'esercizio fisico, soprattutto se di tipo aerobico, è legato a un miglioramento del profilo lipidico ematico, che può diminuire il rischio di aterosclerosi (molto più frequente nel diabetico) e il tasso di mortalità correlata.
Sovrappeso e obesità : l'attività fisica regolare svolge un importante ruolo nel mantenimento e nella perdita di peso, prevenendo e contrastando un altro fattore di rischio molto importante per il DM2, l'obesità. I dati per valutare la quantità di attività fisica in grado di prevenire sovrappeso e obesità sono scarsi e sembrano variare nelle diverse popolazioni e nelle diverse fasce di età. L'American College of Sports Medicine(ACSM) ha recentemente aggiornato le sue linee guida sulle strategie di intervento mediante attività fisica per la perdita di peso. L'aggiornamento mira a suggerire livelli di attività fisica maggiori di quelli raccomandati precedentemente, che suggerivano 150-200 min/settimana di attività fisica moderata. Tale quantità di attività fisica è risultata efficace per prevenire l'incremento ponderale, ma ottiene solo un modesto calo ponderale. Per ottenere un maggior calo ponderale, le nuove linee guida, infatti, raccomandano una quantità di attività fisica aerobica moderata > 250 min/settimana (7).
QUALI SPORT SONO ADATTI PER IL PAZIENTE DIABETICO TIPO 2?
Le attività consigliate sono tutte quelle aerobiche pure o prevalentemente aerobiche, in particolare quelle che coinvolgono la muscolatura delle cosce e delle gambe, in cui sono localizzate le maggiori masse muscolari dell'organismo; obiettivo primario del paziente diabetico, per lo più sovrappeso e sedentario, è infatti la riduzione della massa grassa, il mantenimento o l’aumento della massa magra e l’incremento della sensibilità insulinica. L’intensità dell’esercizio, dato che si vogliono bruciare grassi, deve essere contenuta tra il 40 e il 60% della V02max.
Gli sport sconsigliati sono quelli anaerobici o prevalentemente anaerobici, caratterizzati da esercizi di tipo isometrico (di forza), gli sport da combattimento con contatto fisico e nei pazienti affetti da retinopatia diabetica le attività che comportano frequenti scuotimenti del capo, come la corsa in discesa e la mountain bike. Non consigliati sono anche gli sport che richiedono una particolare vigilanza e/o prontezza di riflessi. In questi casi, una possibile ipoglicemia potrebbe mettere a rischio la vita del paziente o di altre persone. In particolare, viene fortemente sconsigliata l'immersione subacquea, perché richiede tempi obbligati per l’emersione non compatibili con la gestione della crisi ipoglicemica (tabella 1).
| Tabella 1 Programma di attività fisica per diabetici di tipo 2 Modif da 8 |
|
| Attività consigliate | Sport di tipo aerobico: podismo, ciclismo, marcia, ginnastica, nuoto, sci di fondo, canoa, danza |
| Attività sconsigliate | Sport di combattimento, sollevamento pesi, sport anaerobici puri e sport a livello agonistico; per i pazienti in terapia con farmaci ipoglicemizzanti, in particolare secretagoghi e insulina: immersioni, vela in solitario e sport in cui l’ipoglicemia mette a rischio la vita propria ed altrui |
| Intensità | 40-60% della V02max; la frequenza cardiaca da raggiungere durante l'attività fisica può essere calcolata con la formula: [(FC massima – FC basale) x 40-60%] + FC basale ove la FC massima viene misurata durante test da sforzo o calcolata con la formula: FC massima = 220 – età (anni) |
| Durata | 30-60 minuti, escluso riscaldamento e defaticamento |
| Frequenza | Almeno 3-4 volte/settimana, preferibilmente tutti i giorni |
| Precauzioni | Scarpe adeguate, monitoraggio glicemico prima, durante e dopo l’esercizio fisico (soprattutto per i pazienti in terapia con farmaci ipoglicemizzanti), ECG a riposo ed eventualmente sotto sforzo |
| Consigli per perdere peso | Associare una dieta con calorie derivanti per il 50-60% da carboidrati, 10-15% da proteine e 25-30% da grassi ed un deficit calorico di circa 300 kcal/die, ricca in fibre e con adeguata integrazione idrico-salina |
| Adesione a lungo termine | Valutare con il paziente i benefici conseguenti all’esercizio fisico, gratificarlo, favorire il supporto di persone che praticano la stessa attività e offrire sport alternativi |
La durata dell’esercizio, fatto salvo il riscaldamento e il defaticamento, viene proposta dai 30 ai 60 minuti. È possibile anche una durata maggiore, ma il paziente deve controllare la glicemia dopo un’ora dall’inizio dell’esercizio fisico, per decidere sull’opportunità o meno di assumere carboidrati. A tal proposito gli Standard di Cura (9) recitano: “È opportuno intensificare l'auto-monitoraggio glicemico prima, eventualmente durante (esercizio di durata > 1 ora) e dopo l'esercizio fisico. Devono essere fornite indicazioni relative alla necessità di integrazione con carboidrati e alla gestione della terapia ipoglicemizzante. La presenza di chetosi sconsiglia l'attività fisica. Devono inoltre essere fornite indicazioni relative al rischio di ipoglicemia in corso di attività e in riferimento al rischio di ipoglicemia tardiva post-esercizio fisico. Per favorire la corretta attuazione di attività fisica e migliorare l’adesione a lungo termine, il servizio di diabetologia dovrebbe disporre di un laureato in scienze motorie competente in ambito metabolico.”
I riferimenti scientifici indicano che la miglior risposta al trattamento del DM2 si ottiene con programmi di attività fisica adattata, che integrino esercizi aerobici, esercizi contro resistenza ed esercizi di flessibilità. L'allenamento aerobico integrato all'allenamento contro resistenza conferisce un effetto sinergico positivo ai benefici metabolici (10). L'allenamento della flessibilità è raccomandato invece come mezzo per aumentare l’ampiezza dei movimenti e ridurre il rischio di lesioni.
La scelta delle attività fisiche dovrà in ogni caso essere adattata al singolo paziente, in relazione a eventuali rischi di peggioramento delle complicanze e/o altre conseguenze negative.
ATTIVITÀ FISICA E COMPLICANZE
Una consapevole pratica sportiva si può effettuare anche in presenza di eventuali iniziali complicanze, con l'obiettivo di contribuire al mantenimento di un’accettabile qualità di vita, evitando, però, di sovraccaricare o addirittura danneggiare l’organo sede delle complicanze.
Prima di cominciare un programma di attività fisica più intenso di una camminata veloce, tuttavia, va valutato lo stato generale di salute, alla ricerca di quelle condizioni che potrebbero aumentare la probabilità di problemi cardiovascolari o che potrebbero essere controindicate per certi tipi di esercizi o predisporre a lesioni, come neuropatia autonomica o periferica severa, e retinopatia proliferativa. Si deve prendere in considerazione anche l’età del paziente e il livello di attività fisica precedente.
In generale un'attenta valutazione medica dovrebbe focalizzarsi su tutti i sintomi e segni che colpiscono cuore, vasi, occhi, reni, e sistema nervoso. In generale, per un corretto approccio all'attività fisica nel DM2 sarebbe opportuno fare:
- valutazione delle presenza di complicanze (diabetologo);
- valutazione della presenza di malattia ischemica silente (cardiologo);
- ECG da sforzo nei pazienti di età > 35 anni;
- valutazione della terapia con ipoglicemizzanti orali e/o insulina;
- valutazione della terapia con farmaci anti-ipertensivi.
Non si conoscono effetti negativi dell’attività fisica sulla vista o sull’evoluzione della retinopatia diabetica non proliferativa o sull’edema maculare. Questo si applica sia al training aerobico sia a quello di resistenza. Tuttavia, in presenza di retinopatia diabetica proliferativa o non proliferativa grave, possono essere controindicati esercizi aerobici o di resistenza intensi, per il rischio potenziale di scatenare un’emorragia nel vitreo o un distacco della retina.
Per quanto riguarda la neuropatia sensoriale periferica, pur non essendoci controindicazioni allo svolgimento di attività fisica, una diminuita sensibilità al dolore potrebbe avere come risultato un maggior rischio di rottura della pelle e di infezione. In presenza di una neuropatia periferica grave, quindi, sarebbe bene consigliare attività non comportanti carico, come nuoto, bicicletta o esercizi delle braccia.
La neuropatia autonomica può invece aumentare il rischio di lesioni, diminuendo la risposta cardiaca all’esercizio, per ipotensione posturale e per cattiva termo-regolazione dovuta al deterioramento della circolazione e all’eccesso di sudore, oltre che a un meno avvertito senso di sete, che aumenta il rischio di disidratazione e la gastroparesi. I pazienti che soffrono di questa complicanza dovrebbero dunque sottoporsi a un’indagine cardiaca prima di iniziare un’attività fisica.
Per i pazienti con nefropatia diabetica non vi sono prove sperimentali che l'esercizio intenso possa aumentare l'indice di progressione della malattia, tuttavia, essendo la microalbuminuria e la proteinuria associate con un maggior rischio di problemi cardiovascolari, è importante eseguire un ECG sotto sforzo nei soggetti sedentari affetti da queste complicanze, prima di cominciare esercizi notevolmente più intensi di quanto sia richiesto nella vita quotidiana.
La persona affetta da DM2 potrebbe inoltre trovarsi a che fare, nello svolgimento di una pratica sportiva, con episodi di ipoglicemia o iperglicemia. In particolare le persone affette da DM2 in terapia con insulina o ipoglicemizzanti orali della classe dei secretagoghi possono incorrere in episodi ipoglicemici durante lo svolgimento dell'attività fisica. Questi pazienti dovrebbero controllare la glicemia prima, subito dopo e alcune ore dopo aver completato la sessione di attività fisica, almeno fino a quando imparano a conoscere la propria risposta glicemica a tale attività. Coloro che mostrano una tendenza all’ipoglicemia, durante o dopo l’esercizio, possono adottare varie strategie: ridurre le dosi di insulina o ipoglicemizzante orale prima dell’esercizio fisico, assumere un supplemento di carboidrati o ambedue le cose. In caso però di valori glicemici < 80 mg/dL, occorre astenersi dall'iniziare l'attività fisica, specie se stressante e intensa.
Per quanto riguarda l'iperglicemia, il consiglio di astenersi dall’esercizio fisico con glicemie di 300 mg/dL senza chetosi è eccessivamente prudente per una persona con DM2, specialmente dopo un pasto. In assenza di un grave deficit insulinico, esercizi di intensità leggera o moderata aiutano a diminuire la glicemia. Se il paziente si sente bene, è adeguatamente idratato e non ha chetoni nei test delle urine o del sangue, non è quindi necessario rimandare l’attività fisica, solo a causa di un’iperglicemia (tabella 2,3).
| Tabella 2 Complicanze acute e sport Modif da 8 |
|
| Complicanza | Comportamento |
| Ipoglicemia (< 80 mg/dL) | Non iniziate alcun tipo di attività fisica, specie se intensa e stressante |
| Iperglicemia (> 250-300 mg/dL) con chetonuria | |
| Tabella 3 Complicanze croniche e sport (modificato da 8) |
||
| Complicanze croniche | Sport consentito | Sport sconsigliato |
| Nefropatia diabetica | Marcia Nuoto Sport poco impegnativi |
Altri sport |
| Ischemia cardiaca | Marcia Cyclette Sport leggeri |
Qualunque impegno fisico che produca dolore precordiale o aumento della frequenza cardiaca > 100-110 battiti/minuto |
| Retinopatia non proliferante | Footing Jogging Nuoto Cyclette |
Sollevamento pesi Culturismo fisico Body building Canottaggio Windsurf |
| Neuropatia sensitiva ai piedi | Ciclismo Ping-pong Nuoto Footing Tiro con l’arco Golf |
Calcio Basket Corse di fondo Danza aerobica Pallavolo Giochi da spiaggia |
| Neuropatia autonomica del cuore e dei vasi | Esercizi fisici leggeri in idonee condizioni di temperatura ed evitando scatti brevi e ripetuti | Calcio Tennis Basket Esercizi prolungati in climi caldi |
CONSIDERAZIONI PREVENTIVE ALL'ATTIVITÀ FISICA
Le persone affette da diabete mellito che si accingono a iniziare un programma di attività fisica, devono avere chiaro alcuni concetti riguardo l'importanza della cura del piede, di un abbigliamento idoneo e del monitoraggio glicemico.
Le scarpe devono essere di buona qualità, comode, senza cuciture interne, ben ammortizzate e dovranno avere un plantare amovibile, sostituibile con uno specifico in caso di cavismo o eccesso di carico a livello delle teste metatarsali. Anche i calzini sono importanti: devono essere di materiale spugnoso, in modo da evitare gli sfregamenti e la relativa formazione di bolle. Dovrà essere prestata una particolare attenzione da tutti quei pazienti con iniziali problemi di neuropatia periferica, ad alto rischio di evoluzione verso il piede diabetico.
Il vestiario deve essere leggero e consentire una normale traspirazione della pelle, per evitare il rischio di colpi di calore. Non devono mai mancare un cappellino e una borraccia di acqua. Possono essere utili bevande blandamente zuccherate contenenti sali minerali, reperibili facilmente in commercio; la quantità di acqua necessaria varia a seconda della temperatura esterna, ma non deve mai essere < 200 mL/h di attività sportiva.
Occorre avere dietro il glucometro per poter effettuare dei controlli:
- prima dell’inizio, per iniziare l'attività in condizioni di sicurezza;
- durante l’attività è indicata per attività protratte oltre i 60 minuti;
- dopo la fine per valutare gli effetti dell'attività svolta e poter “toccare con mano” la riduzione della glicemia, formidabile elemento motivante per il DM2 nel proseguire questo tipo di attività.
Sarebbe inoltre opportuno disporre di alimenti contenenti carboidrati, per evitare o correggere eventuali ipoglicemie.
La persona affetta da diabete mellito non può non considerare prima dell'attività fisica l'esecuzione di esercizi di stretching, per aumentare le capacità di movimento e soprattutto ridurre il rischio di lesioni.
BIBLIOGRAFIA
- Boulè NG, Haddad E, Kenny GP, et al. Effects of exercise on glycemic control and body mass in type 2 diabetes mellitus: a metanalysis of controlled clinical trial. JAMA 2001, 286: 1218-27.
- Church TS, Cheng YJ, Earnest CP, et al. Exercise capacity and body composition as predictors of mortality among men with diabetes. Diabetes Care 2004, 27: 83-8.
- De Feo P, Di Loreto C, Lucidi P, et al. Metabolic response to exercise. J Endocrinol Invest 2003, 26: 851-4.
- De Feo P, Di Loreto C, Ranchelli A, et al. Exercise and diabetes. Acta Biomed 2006, 77 suppl 1: 14-7.
- Eriksson JG. Exercise and the treatment of type 2 diabetes mellitus. An update. Sports Med 1999, 27: 381-91.
- Hu FB, Stampfer MJ, Solomon C, et al. Physical activity and risk for cardiovascular events in diabetic women. Ann Intern Med 2001, 134: 96-105.
- ACSM's Guidelines for Exercise Testing and Prescription. Ninth Edition. Wolters-Kluwer 2003.
- Diabete in forma - l’attività fisica è una buona cura. Corigliano G, Miselli V, Ed. UTET Periodici Scientifici.
- SID-AMD. Standard Italiani per la cura del diabete mellito. Edizione 2014.
- Balducci S. Guida alla prescrizione dell'esercizio fisico nella malattia diabetica. Associazione Fitness Metabolica - Roma 2003.
Siti attinenti
Diabete & scuola
Valeria De Donno
SC Pediatria, Azienda Ospedaliera S. Croce e Carle, Cuneo
La scuola è l’ambito principale di inserimento sociale del bambino, che vi trascorre almeno 30-35 ore della settimana. È evidente l’importanza di estendere l’intervento di educazione terapeutica anche al personale docente e ausiliario, cui il bambino è affidato. Sia le linee guida internazionali (ADA, ISPAD, CDA) che il “consensus” del gruppo di studio Diabete della SIEDP sottolineano l’importanza di intervenire in questo ambito, per favorire un coinvolgimento gratificante del bambino nel percorso educativo e per contenere l’ansia dei genitori e di tutti gli adulti coinvolti nel percorso di crescita del bambino. Viene sottolineata soprattutto l’importanza di un’adeguata formazione e la diffusione della cultura del diabete, in maniera che anche durante l’orario scolastico il bambino sia posto in condizione di curarsi adeguatamente (1-4).
Dal punto di vista legislativo, in Italia c’è stata una progressiva evoluzione a favore dei bambini affetti da malattia cronica, che possano richiedere interventi, anche di tipo sanitario, nell’ambito scolastico; proprio con l’obiettivo di ridurre al minimo il rischio di isolamento ed emarginazione del bambino malato. Elenco una serie di decreti e leggi cui si può attingere:
- disposizioni per la prevenzione e la cura del diabete mellito, del 16 marzo 1987, n. 115;
- legge del 27 maggio 1991, n. 176 (Convenzione sui diritti del fanciullo);
- legge del 28 agosto 1997, n. 285 “Disposizioni per la promozione di diritti e di opportunità per l’infanzia e l’adolescenza”;
- legge dell’8 novembre 2000, n. 328 “Legge quadro per la realizzazione del sistema integrato di interventi e servizi sociali”;
- legge del 28 marzo 2003, n. 53 “Delega al Governo per la definizione delle norme generali sull’istruzione e dei livelli essenziali delle prestazioni in materia di istruzione e formazione professionale”.
Si è finalmente giunti, con plauso delle associazioni, di noi medici e dei dirigenti scolastici più illuminati, alle Raccomandazioni del 25 novembre 2005 dei Ministeri della Salute e dell’Istruzione “Linee guida per la definizione degli interventi finalizzati all’assistenza di studenti che necessitano di somministrazione di farmaci in orario scolastico”.
Il Piano Sanitario Nazionale Diabete (PN) redatto dalla Commissione Nazionale Diabete: sottoscritto in occasione della Conferenza Stato-Regioni, 6 Dicembre 2012, definisce all’obiettivo 6 (per l’età evolutiva): “Migliorare la qualità di vita e della cura e la piena integrazione sociale per le persone con diabete in età evolutiva, anche attraverso strategie di coinvolgimento familiare”. Vengono proposte, tra le altre, le seguenti strategie: … favorire “l’azione di rete” sul territorio tra centri di diabetologia pediatrica di riferimento regionale, centri periferici e pediatri di libera scelta; aumentare la consapevolezza sociale nel mondo della scuola, nei luoghi in cui si pratica attività sportiva per evitare discriminazioni e preclusioni personali…".
Il Piano Sanitario Nazionale Diabete al riquadro 12 definisce tra le funzioni del medico di medicina generale/pediatra di libera scelta nella gestione integrata della persona con diabete: …contribuire all’educazione del paziente e dei suoi familiari, in particolare in ambito nutrizionale, e all’inserimento del bambino con diabete nella scuola e negli altri ambiti relazionali propri dell’età…
E al riquadro 13, tra i compiti delle funzioni specialistiche del centro di diabetologia: … formare operatori impegnati nell’assistenza al bambino con diabete, in particolare in ambito scolastico e sportivo…
Il 7 novembre 2013 l'Associazione di genitori di bambini con DM (AGD), in collaborazione con il Ministero della Salute e il Ministero dell'Istruzione, ha presentato al Senato una proposta di intervento integrato nella scuola partendo da un quadro nazionale ancora molto carente (5):
- oltre il 78% delle Istituzioni (Regioni, Provincie, Comuni) non ha predisposto interventi in campo scolastico;
- solo il 14.2% delle strutture diabetologiche pediatriche svolge attività di formazione sanitaria nelle scuole;
- l’85.7% delle scuole denuncia disagi inerenti il controllo glicemico e l’insulinizzazione;
- nel 59.1% dei casi vi sono problemi nell’usufruire della mensa;
- il 50% dei bambini con DM ha problemi nella pratica dell’attività fisica in ambito scolastico;
- il 64% dei bambini con DM risulta avere problemi di integrazione coi compagni.
A questo punto conviene che il medico che ha in cura un bambino con diabete verifichi se nella propria regione è già stato recepito il PN e se esiste un Piano Regionale per l’inserimento del bambino affetto da DM nella scuola. In mancanza di questo, può fare riferimento alle leggi nazionali e alle indicazioni della SIEDP, che ha creato un sito dedicato, di facile accesso anche per i docenti e i genitori; deve poi redigere con i genitori e con il curante un Piano Individuale di Trattamento Diabetologico (PITD), da sottoporre all’attenzione del dirigente scolastico e del corpo insegnante, personale ausiliario e personale della mensa. Il PITD deve contenere in maniera chiara:
- il nominativo dell’alunno affetto da DM;
- le eventuali patologie associate;
- i riferimenti e recapiti dei genitori, del curante e dello specialista che ha in cura il bambino/a;
- la terapia in atto;
- che grado di autonomia abbia raggiunto il bambino nell’eseguire l’autocontrollo e nella terapia:
- spesso il bambino anche della scuola dell’infanzia è in grado di eseguire autonomamente un controllo glicemico, ma non sa leggere e interpretare il numero che compare sul display;
- nelle elementari i bambini iniziano ad imparare a somministrarsi autonomamente l’insulina, ma non sono in grado di decidere il dosaggio se non, talvolta, negli ultimi anni;
- devono essere chiaramente definiti gli obiettivi terapeutici individuali:
- come riconoscere e gestire un’ipoglicemia;
- come riconoscere e gestire un’iperglicemia;
- infine come comportarsi in caso di grave ipoglicemia con perdita di coscienza (conviene consegnare alla scuola un piccolo poster riassuntivo, dopo avere adeguatamente istruito il personale scolastico sulle modalità di utilizzo del glucagone, che la famiglia avrà cura di lasciare a scuola).
Al PITD vanno allegati il modulo per la privacy e l'elenco del materiale che il bambino dovrà avere a scuola, nonchè le modalità di conservazione. Il documento andrà sottoscritto da tutte le parti coinvolte.
Nella nostra esperienza la disponibilità del personale scolastico, dovutamente sensibilizzato al problema, dopo una prima comprensibile reazione di paura, è sempre stata positiva e il PITD è stato recepito attivamente, con evidente beneficio per il bambino e la famiglia. Rarissima è invece stata ad oggi la disponibilità a praticare la terapia, su apposita delega dei genitori, per i bambini della scuola dell’infanzia e dei primi anni di scuola primaria. Nei casi nei quali i genitori abbiano richiesto il servizio, tramite domanda redatta all’ASL da parte del curante, è stato attivato il servizio infermieristico domiciliare: al momento del pasto a scuola un’infermiera, adeguatamente istruita, assiste il bambino per il controllo e la pratica della terapia, la scuola fornisce il luogo idoneo, il centro fornisce il piano terapeutico personalizzato e i genitori effettuano una delega all’esecuzione della terapia. In altre realtà sono partiti progetti nei quali gli insegnanti si sono resi disponibili ad imparare loro stessi come assistere il bambino durante queste pratiche, completando il loro ruolo di educatori in maniera lodevole.
Molto positivo e fondamentale per la riuscita del progetto è il coinvolgimento del curante che, col supporto del centro di riferimento, contribuisce a diffondere la cultura del diabete e i principi della corretta alimentazione con interventi di educazione terapeutica e rende possibile un intervento capillare e radicalmente migliorativo sulla qualità di vita del bambino.
Bibliografia
- American Diabetes Association. Diabetes care in the school and day care setting. Diabetes Care 2010, 33 suppl 1: S70-74.
- ISPAD/IDF. Global IDF/ISPAD guideline for diabetes in childhood and adolescence 2011.
- Canadian Diabetes Association. Standards of care for students with type 1 diabetes in school. 2008.
- Tumini S, et al. Assistenza diabetologica in età pediatrica in Italia. Manuale operativo per l’applicazione del “Piano sulla malattia diabetica” in età pediatrica. Mediserve Editoria e Formazione 2014.
- AGD. Documento strategico di intervento integrato per l'inserimento del bambino, adolescente e giovane con diabete in contesti scolastici, educativi, formativi, al fine di tutelarne il diritto alla cura, alla salute, all'istruzione e alla migliore qualità di vita. Senato della Repubblica 7 novembre 2013.
Diabete & lavoro
Alessandra Ardizzone
Medicina Interna, ASL CN 1, Fossano
Il diabete mellito è riconosciuto come malattia sociale, oltre che per la sua ampia diffusione, perchè può colpire soggetti in età produttiva e le sue complicanze croniche possono comportare un notevole impatto socio-sanitario, con conseguenze ai fini lavorativi. Nel "Manifesto dei diritti della persona con diabete" viene sottolineato come l'obiettivo primario delle azioni di governo debba essere considerato il diritto a vivere una vita sociale, educativa e lavorativa alla pari delle persone senza diabete (1).
Principali riferimenti normativi
Il lavoratore diabetico è tutelato dalla legge n. 115/87 (2), che all'articolo 8 impone di escludere qualsiasi forma di discriminazione, riconoscendo ai soggetti affetti da diabete il diritto di accedere, ove le loro condizioni fisiche lo consentano, a posti di lavoro sia pubblici che privati, salvo i casi per i quali si richiedano particolari requisiti attitudinali; tale legge è integrata dalla legge 104 del 1992, che concede al diabetico, quando sia riconosciuta una situazione di gravità, tre permessi mensili retribuiti per effettuare controlli medici. Nonostante ciò, un'indagine INAIL sui lavoratori con diabete ha rilevato che il 30% preferisce non rivelare la diagnosi di diabete, anche in caso di assenza di complicanze (56% dei casi) e anche se nel 96% dei casi i diabetici con complicanze avevano potuto continuare a svolgere la mansione per la quale erano stati assunti. Una mancata dichiarazione o perfino una dichiarazione mendace non hanno risvolti penali e non possono essere causa di risoluzione del rapporto di lavoro, tranne nei casi in cui il diabete determini esplicitamente l'esclusione da un determinato lavoro, come accade per i piloti di linea e i controllori di volo in trattamento insulinico. Se ne deduce che, nonostante i principi enunciati a livello legislativo e le indicazioni delle Società Scientifiche, sopravvivono tuttora pregiudizi e casi di discriminazione. D'altro canto, è innegabile che il diabete può causare perdita di giornate di lavoro, ridotta produttività, non occupazione per disabilità con aumento dei costi indiretti della malattia (rappresentanti il 28% dei costi totali), come evidenziato dai dati forniti dall'American Diabetes Association (ADA) nel 2012 (3), anche se ad un'analisi attenta emerge che la maggior parte dei costi è dovuta, non tanto alle necessità di maggiori controlli e cure, quanto alle conseguenze di un compenso metabolico inadeguato (che incide 4 volte tanto). Solamente le manifestazioni acute di scompenso, in particolare le ipoglicemie, e le complicanze croniche tardive possono compromettere le prestazioni psico-fisiche dei lavoratori e condizionarne l'idoneità.
Position Statement ADA 2014 "Diabetes and Employement"
L'ADA ha recentemente (4) dedicato uno specifico documento a questo tema, nella cui introduzione viene raccomandato di evitare generalizzazioni e stereotipi e viene invece sottolineata la necessità di una valutazione del singolo caso attenta e, quando necessario, multi-specialistica, che metta in relazione la storia individuale della persona con diabete con la sua specifica mansione lavorativa.
Per quanto riguarda l'ipoglicemia, in tale documento si afferma che un episodio singolo di ipoglicemia severa non è di per sè squalificante, mentre un soggetto con episodi ricorrenti di ipoglicemia, specie se non giustificabili con un'attenta analisi delle circostanze in cui si verificano, può essere considerato non idoneo a svolgere con sicurezza deteminati lavori.
Per quanto concerne invece le complicanze, queste devono essere valutate caso per caso dallo specialista competente in relazione alla mansione svolta; viene sottolineato come in caso di assenza di complicanze, il loro possibile futuro sviluppo non deve essere considerato rilevante e come il compenso metabolico, espresso dalla determinazione dell'emoglobina glicata o dalla glicemia media, o l'instabilità del compenso ("brittle diabetes") non siano rilevanti ai fini del giudizio di idoneità.
Dal punto di vista giuridico, il concetto di inidoneità alle mansioni è complesso: alcune sentenze della Corte Suprema riconoscono che una sopravvenuta inidoneità rappresenti un giustificato motivo di recesso del datore di lavoro; in altre sentenze la Cassazione ha stabilito la possibilità oggettiva di adibire il lavoratore ad altre attività all'interno della stessa azienda; se l'inidoneità è solo parziale, il datore di lavoro ha l'obbligo di apportare quei piccoli aggiustamenti all'organizzazione del lavoro che consentono di rispettare la prescrizione medica (es. possibilità di consumare cibo o bevande alla postazione di lavoro, brevi intervalli per consentire i controlli glicemici e/o l'iniezione di insulina). Il diabetologo può certificare, soprattutto nel caso di trattamento insulinico, la necessità di non modificare i ritmi sonno-veglia per garantire l'equilibrio glicemico, ai fini di ottenere l'esonero dal lavoro notturno (come previsto dall'art. 2 del D.Lgs 532/1999).
Gestione della terapia e obiettivi in relazione al contesto lavorativo
Le tre condizioni prevalenti di ridotta attitudine al lavoro che differenziano i soggetti diabetici dalla restante popolazione riguardano la rotazione su turni, la guida professionale e i lavori ad altezza dal suolo. Per quanto riguarda invece i fattori mediante i quali l'ambiente lavorativo può incidere negativamente sull'equilibrio metabolico, sono identificabili essenzialmente nel costo energetico del lavoro (sforzo fisico, sedentarietà) e nell'organizzazione del lavoro (turnazione, lavoro notturno). Ne deriva che tali fattori debbano essere attentamente considerati nel singolo caso e richiedano pertanto un'attenta personalizzazione della terapia, in linea con quanto indicato in tutte le recenti linee guida delle Società Scientifiche (5,6).
Nel caso del paziente affetto da diabete di tipo 1, gli attuali schemi di terapia multi-iniettiva basal-bolus e un accurato auto-monitoraggio glicemico consentono nella maggior parte dei casi di adattare in modo flessibile la terapia alle esigenze lavorative; in casi particolari può essere giustificato prendere in considerazione il ricorso alla terapia con micro-infusore (CSII), eventualmente associata a monitoraggio glicemico continuo (SAP: sensor augmented Insulin Pump Therapy). La recente disponibilità del sistema di sospensione automatica (LGS: low glucose suspend) può essere utile in pazienti con frequenti episodi ipoglicemici e/o con ipoglicemie inavvertite, anche se al momento non esistono linee guida internazionali che forniscano una raccomandazione con livello di evidenza per la terapia con CSII, così come non ne esistono per identificare la popolazione da trattare con SAP piuttosto che con CSII tradizionale (5).
L'ipoglicemia rappresenta, ancor più in relazione ai particolari contesti lavorativi cui si è fatto riferimento all'inizio del paragrafo, il principale fattore limitante della terapia, sia insulinica sia con ipoglicemizzanti orali, tanto da condizionare, in casi selezionati, il perseguimento di obiettivi di compenso, in termini di emoglobina glicata, meno stringenti, come sottolineato in tutte le principali linee guida (5-7). Le linee guida statunitensi, stilate dal Department of Veteran Affairs e dal Department of Defense (7), cui fanno riferimento anche i recenti Standard di cura italiani (6), raccomandano nella valutazione degli obiettivi glicemici un approccio individualizzato che consideri, tra gli altri fattori, anche il rischio e la capacità di percepire l'ipoglicemia.
Per quanto riguarda la terapia del diabete di tipo 2 e la terapia ipoglicemizzante orale, numerosi studi clinici randomizzati dimostrano che l’aggiunta a metformina di pioglitazone, sulfoniluree, repaglinide, inibitori del DPP-4, agonisti del recettore del GLP-1 e gliflozine ha efficacia simile nel ridurre l'emoglobina glicata. Il farmaco da aggiungere a metformina deve pertanto essere selezionato in accordo con i possibili rischi e benefici che lo stesso può indurre, tra cui l'ipoglicemia, che riguarda sulfaniluree e repaglinide. Sulla scorta di analisi costo/beneficio, il NICE ha emanato linee guida che contemplano l'utilizzo di gliptine e agonisti del recettore del GLP-1 nei pazienti con occupazioni professionali a rischio o a rischio di discriminazioni lavorative in caso di terapia insulinica. A seguito delle forti limitazioni dell'utilizzo della terapia incretinica da parte degli enti regolatori italiani, le Società Scientifiche Italiane dell’area diabetologica (AMD e SID) in un documento congiunto ne hanno ribadito il profilo favorevole in termini di sicurezza ed efficacia ed il buon rapporto costo/efficacia quando impiegata in categorie specifiche di pazienti (8).
Infine, nell'attuale modello di cura centrato sul paziente, in cui gioca un ruolo chiave l'alleanza terapeutica, va sottolineato come la scelta della terapia debba tener conto anche delle specifiche preferenze del paziente e che il raggiungimento degli obiettivi terapeutici non può prescindere da un costante supporto educativo, di cui sono stati ampiamente dimostrati gli effetti favorevoli su esiti, costi e qualità di vita.
Bibliografia
- Associazione parlamentare per la tutela e la promozione del diritto alla prevenzione. Manifesto dei diritti della persona con diabete. Roma 9 luglio 2009.
- Legge n. 115 del 16 marzo 1987 "Disposizioni per la prevenzione e la cura del diabete mellito". Gazzetta Ufficiale della Repubblica Italiana. Serie generale n. 177.
- American Diabetes Association. Economic costs of diabetes in the U.S. in 2012. Diabetes Care 2013, 36: 1033-46.
- American Diabetes Association. Diabetes and employement. Diabetes Care 2014, 37 suppl 1: 112-7.
- American Diabetes Association. Standard of medical care in diabetes-2014. Diabetes Care 2014, 37 suppl 1: S14-80.
- AMD-SID. Standard Italiani per la cura del diabete mellito 2014.
- Department of Veteran Affairs, Department of Defense. VA/DoD clinical practice guideline for the management of diabetes mellitus. Washigton (DC): Department of Veteran Affairs, Department of Defense; 2010.
- Position Statement AMD-SID sulla terapia incretinica.
Gestione del diabete in altre etnie e culture
Vito A. Giagulli
Dipartimento di Medicina Interna, U.O. di Malattie Metaboliche ed Endocrinologia, P.O. Monopoli-Conversano, Presidio di Conversano AUL/BA
Da anni in letteratura si discute se l’appartenenza a un dato gruppo etnico possa condizionare in modo variabile la prevalenza, le complicanze, gli esiti clinici e la mortalità del diabete mellito (DM). Nel termine “etnia” sono da considerare non solo i fattori genetici ma anche quelli socio-economici e culturali. Per verificare ciò, sono stati condotti molti studi epidemiologici, soprattutto in paesi che storicamente hanno presentato e presentano elevato flusso migratorio, in particolare USA e Regno Unito.
Uno dei primi studi (1) ha verificato la diversa prevalenza del DM tra un campione di popolazione d’origine messicana residente in USA (San Antonio) e un altro residente a Città del Messico. Il primo gruppo ha mostrato prevalenza di DM superiore al secondo, i cui componenti assumevano una dieta a minor contenuto di grassi, risultando, quindi, più magri e più attivi fisicamente. Questo dato evidenzia che esiste una complessa interazione, che include sia gli aspetti di disagio legati all’immigrazione in sé, che i fattori etnico–specifici (es. costumi, credo religioso, struttura familiare e altri), che possono interagire con il nuovo contesto ambientale.
Tuttavia, questi studi presentano una sostanziale difficoltà nell’analizzare i dati riferiti a etnie specifiche, dovuta alla progressiva perdita di “purezza” di un dato genetico, a causa proprio degli elevati flussi migratori presenti nei nostri tempi, la qual cosa genera una serie di fattori che influenzano stile di vita, capacità di accesso alle cure e qualità stessa della cura (ad es. lo stato socio-economico acquisito nel paese ospite, il livello culturale inteso come integrazione sociale, la conoscenza della lingua, la preservazione del patrimonio culturale d’origine).
Il San Antonio Heart Study (2) ha evidenziato come, nell’ambito degli immigrati messicani, il livello culturale (inteso come integrazione sociale abbinata alla capacità di preservare valori familiari e identitari del proprio gruppo etnico) si associasse a una riduzione di obesità e diabete. Al contrario, un altro studio (3), condotto in una popolazione di asiatici immigrati negli USA, ha evidenziato una maggiore prevalenza di DM nella popolazione asiatica più integrata in un modello di vita di tipo occidentale. Ciò viene in parte spiegato da un grado maggiore di “suscettibilità” (genetica?) esistente nei gruppi etnici asiatici, rispetto per esempio agli ispanici, ad acquisire quelle modificazioni che intervengono con il nuovo stile di vita occidentale (obesità). Si è visto, infatti, come lo sviluppo dell’alterata tolleranza al glucosio o del DM avvenga nei gruppi asiatici per un grado minore di BMI rispetto ad altri gruppi etnici.
Studi più recenti hanno preso in considerazioni le possibili differenze etniche nei marcatori glicemici e nelle relazioni tra glicemia e HbA1c per la diagnosi di DM2, come pure nella mortalità e nelle complicanze a lungo termine della malattia. In particolare, Wolffenbuttel et al (4), analizzando i dati dei partecipanti allo studio DURABLE (5), inerenti le differenze etniche nei marcatori glicemici (HbA1c, profili glicemici con glucometro e media glicemica ricavata dalla glicata), hanno evidenziato una chiara differenza nella relazione tra HbA1c e medie dei profili glicemici auto-monitorati in differenti gruppi etnici, con glicate più alte negli ispanici e più basse nei caucasici. I ricercatori concludono che le differenze di glicata possono essere dipendenti da differenti stili di vita (e altri fattori sopra riportati) ma anche da possibili differenze biologiche, come la glicazione dell’emoglobina o la sopravvivenza eritrocitaria. Tuttavia, le differenze tra le glicate di ispanici e caucasici possono essere in parte spiegate da determinanti genetici. Nel NHANES-3 si è dimostrato che in molti loci genetici per la glicata c’è sostanziale eterogeneità razziale-etnica nel rischio della distribuzione delle frequenze alleliche (6). Clinicamente questo dato potrebbe ripercuotersi sia nella diagnosi che nella gestione terapeutica del DM2. Nel primo caso, infatti, all’analisi di 2 studi, l’SGT (Screening for Impaired Glucose Tolerance Study) e il NHANES III (7), si osservava che i soggetti di etnia nera avevano livelli consistentemente più alti di glicata rispetto a quelli dei soggetti di etnia bianca; nel secondo caso, lo studio ACCORD (8) evidenziava che l’utilizzo della stesso livello di glicata come obiettivo di trattamento in popolazioni provenienti da diverso background etnico, potrebbe aver creato un più alto rischio di ipoglicemia nei soggetti di origine asiatica, africana e ispanica. Quest’ultimo dato è stato confermato in un’analisi post-hoc del DURABLE (5,9), che evidenziava la presenza di differenze significative di efficacia e sicurezza tra gruppi etnici. Queste differenze potrebbero essere importanti nel pianificare regimi diversi di terapia insulinica.
Una revisione di Lanting et al (10) ha valutato se ci fossero differenze etniche di mortalità, complicanze terminali e qualità di cura nei pazienti diabetici. La conclusione è stata che, in particolare per i soggetti di etnia nera e ispanica, negli USA, le differenze negli esiti di malattia si riducono con il miglioramento della qualità di cura. Nel Regno Unito solo gli asiatici hanno un alto rischio di nefropatia terminale. Tuttavia, non c’è un quadro generale nei rischi di complicanze o di mortalità per le minoranze etniche rispetto all’intera popolazione. La diversità nel rischio delle numerose complicanze del DM nei gruppi etnici combinata con i differenti risultati negli USA e nel Regno Unito, non consente di estendere i risultati ad altre regioni o altri gruppi etnici. In ogni caso, il risultato indica che la qualità della cura è un importante fattore tra i gruppi etnici di minoranza (11,12).
Bibliografia
- Stern MP, Gonzales C, Mitchell BD, et al. Genetic and enviromental determinants of type II diabetes in Mexico City and San Antonio. Diabetes 1992, 41: 484-92.
- Hazuda MP, Hafner SM, Stern HP, Eifler CW. Effects of acculturation and socioeconomic status on obesity and diabetes in Mexican Americans. The San Antonio Heart study. Am J Epidemiol 1988, 28: 1289-301.
- Kandula NR, Diez-Roux AV, Chan C, et al. Association of acculturation levels and prevalence of diabetes in multiethnic study of atherosclerosis (MESA). Diabetes Care 2008, 31: 1621-8.
- Wolffenbuttel BHR, Herman WH, Gross JL, et al. Ethnic differences in glycemic markers in patients with type 2 diabetes. Diabetes Care 2013, 36: 1-6.
- Fahrbach J, Jacober S, Jiang H, Martin S. The DURABLE trial study design: comparing the safety, efficacy and durability of insulin glargine to lispro mix 75/25 added to oral anthyperglicemic agents in patients with type 2 diabetes. J Diabetes Sci Technol 2008, 2: 831-8.
- Grimsby JL, Porneala BC, Vassy JL, et al; MAGIC investigators. Race-ethnic differences in the association of genetic loci with HbA1c levels and mortality in US adults. The Third National Health and Nutrition Examination Survey (NHANES III). BMC Med Genet 2012, 13: 30.
- Ziemer DC, Kolm P, Weintraub WS, et al. 2010 Glucose independent, black-white differences in haemoglobin A1c levels: a cross-sectional analysis of 2 studies. Ann Intern Med 2010, 152: 770-7.
- Ismail-Beigi F, Craven T, Banerji MA, et al; ACCORD trial group. Effect of intensive treatment of hyperglycaemia on microvascular outcomes in type 2 diabetes: an analysis of the ACCORD randomised trial. Lancet 2010, 376: 419-30.
- Davidson JA, Wolffenbuttel BH, Arakaki RF, et al. Impact of race/ethnicity on efficacy and safety of two starter insulin regimens in patients with type 2 diabetes: a posthoc analysis of the DURABLE trial. Ethn Dis 2013, 23: 393-400.
- Lanting LC, Joung IMA, Mackenbach JP, et al. Ethnic differences in mortality, end-stage complications and quality of care among diabetic patients. Diabetes Care 2005, 28: 2280-8.
- Walker RJ, Smalls BL, Campbell JA, et al. Impact of social determinants of health on outcomes for type 2 diabetes: a systematic review. Endocrine 2014, 47: 29-48.
- Nandi A, Glymour MM, Subramanian SV. Association among socioeconomic status, health behaviors, and all-cause mortality in the US. Epidemiology 2014, 25: 170-7.
Diabete e Ramadan
Emanuele Spreafico
SSD Endocrinologia e Diabetologia, ASST di Monza, PO di Desio e Poliambulatorio di Muggiò
(aggiornato al 25 settembre 2020)
La gestione del diabete durante il mese di Ramadan è una sfida che nella società moderna multi-etnica anche il diabetologo italiano sta iniziando ad affrontare con maggiore frequenza.
Il Ramadan è il nono mese del calendario islamico, durante il quale si celebra il digiuno per commemorare la prima rivelazione del Corano a Maometto, avvenuta proprio in quel mese. Il digiuno è descritto nel Corano nella Sura II dal versetto 183 ed è un precetto religioso molto forte, in quanto rientra nei cinque precetti fondamentali della fede islamica. Chi ne negasse l’obbligatorietà sarebbe kafir, colpevole di empietà massima. Il precetto prevede che dal sorgere al calar del sole il fedele non possa assumere alimenti, bere acqua e nemmeno assumere medicine o somministrarsi farmaci iniettivi. Sono esentati dal digiuno bambini, anziani, persone affette da malattie croniche, donne mestruate, in gravidanza o in allattamento e chi si trova in pellegrinaggio; tuttavia anche la maggior parte dei musulmani che rientra in queste categorie ha un intenso desiderio di praticarlo.
Dato che il calendario islamico, basato sulle fasi lunari, è composto da 354 o 355 giorni (10 o 11 giorni in meno dell'anno solare), il mese di Ramadan ogni anno cade in un momento differente dell'anno solare e quindi man mano retrocede, fino a cadere in una stagione diversa. Per tale motivo, in modo dipendente dalla stagione e dalla localizzazione geografica, il digiuno può durare dalle 12 alle 20 ore. Il digiuno viene preceduto da un pasto all’alba (suhoor) e interrotto dopo il calare del sole da un pasto serale (iftar).
Dal punto di vista fisiologico un digiuno così costituito comporta una rapida modifica del ritmo sonno/veglia, dell’orario e della composizione dei pasti, del senso della fame, del ritmo del cortisolo e conseguentemente anche dell’insulino-resistenza. Ciò determina una modificazione rilevante dell’andamento glicemico nei soggetti diabetici, con un progressivo calo durante la giornata fino al limite dell’ipoglicemia verso sera e un rapido aumento dopo l’iftar, tradizionalmente ricco di alimenti zuccherini (1).
Diverse quindi sono le criticità che si possono presentare nel paziente diabetico che pratica il digiuno. Lo studio EPIDIAR, il principale studio epidemiologico relativo a diabete e Ramadan, riporta un rischio di ipoglicemia aumentato durante questo periodo: di 4.7 volte nelle persone con diabete mellito tipo 1 e di 7.5 volte in quelle con diabete mellito tipo 2. Il divieto di assumere le terapie comporta inoltre un aumentato rischio di iperglicemia, stimato in 3 volte nel DMT1 e 5 volte nel DMT2. Il digiuno prolungato, se associato a concomitante carenza insulinica, può comportare lo sviluppo di cheto-acidosi diabetica (DKA) nel DMT1 ma anche nel DMT2 di lunga data insulino-trattato. Infine, l’impossibilità di assumere bevande aumenta notevolmente il rischio di disidratazione, specialmente nella popolazione anziana.
Sono del 2016 le ultime linee guida (LG), stilate dall’International Diabetes Federation e dalla Diabetes and Ramadan International Alliance, che forniscono importanti informazioni per aiutare il team diabetologico e il paziente alla corretta gestione del diabete in corso di digiuno (2). Fulcro di queste LG è la stratificazione del rischio a seconda del paziente basata su diversi punti: tipo di diabete, terapia assunta, rischio ipoglicemico individuale, presenza di complicanze e/o comorbilità, condizione sociale e lavorativa, eventuali pregresse esperienze di Ramadan (tabella). Le autorità religiose islamiche hanno approvato tale proposta, autorizzando i comportamenti indicati per i soggetti musulmani con DM.
Le stesse LG sottolineano come la decisione del paziente di praticare o meno il digiuno, anche se appartiene alle categorie di rischio più alto, deve essere sempre rispettata, considerato l’alto valore di tale precetto religioso.
Risulta quindi fondamentale che il paziente (indipendentemente dalla categoria di rischio) effettui un’educazione attenta e strutturata, che deve iniziare già nel periodo precedente al Ramadan. La terapia educazionale deve comprendere diversi punti:
- corretto monitoraggio glicemico;
- quantificazione del rischio;
- consigli alimentari specifici;
- consigli relativi all’attività fisica;
- eventuali modifiche della terapia;
- riconoscere le condizioni per cui è necessario interrompere il digiuno.
Una terapia educazionale così strutturata ha dimostrato infatti di ridurre il rischio di complicanze (3).
| Stratificazione del rischio per il paziente diabetico durante il Ramadan | ||
| Categoria di rischio | Caratteristiche del paziente | Consiglio (approvato dalle Autorità Religiose) |
| 1: molto elevato | Una o più delle seguenti:
|
Non si deve digiunare |
| 2: elevato |
Una o più delle seguenti:
|
Non si dovrebbe digiunare |
| 3: moderato/ basso |
DMT2 ben compensato in terapia con uno o più dei seguenti trattamenti:
|
La decisione di non digiunare è a discrezione del giudizio medico e alla capacità dell’individuo di tollerare il digiuno |
In merito all’auto-controllo glicemico, va ricordato che questa pratica non comporta la rottura del digiuno e deve quindi essere incoraggiata, al fine di evitare o correggere rapidamente eventuali importanti variazioni glicemiche. Inoltre, viene raccomandato di interrompere immediatamente il digiuno se:
- valori glicemici ≤ 70 mg/dL durante le prime ore di digiuno, all’alba, soprattutto se in terapia insulinica o farmacologica (eventualmente ricontrollando la glicemia entro un’ora);
- valori glicemici ≥ 300 mg/dL;
- in caso di sintomi di ipoglicemia, iperglicemia, disidratazione o comparsa di malattia acuta.
È indicato un controllo almeno prima del suhoor, in mattinata, a mezzogiorno, nel pomeriggio, prima di iftar, 2 ore dopo iftar e sempre in caso di sintomi di ipo/iperglicemia o malessere.
Le LG raccomandano una valutazione nutrizionale ed educazionale del paziente, circa 6-8 settimane prima di intraprendere il digiuno, per stabilirne i bisogni formativi e metabolici, per metterlo nelle condizioni di vivere questo periodo in modo consapevole e assumere comportamenti atti a minimizzare i rischi. La visita pre-Ramadan deve fornire al paziente un piano nutrizionale idoneo a migliorare il controllo glicemico anche nel periodo che precede il digiuno. È stato inoltre ideato un programma per smartphone e web, il “Ramadan Nutrition Plan” (RNP), al momento attivo nei Paesi a prevalente popolazione musulmana, per permettere agli operatori sanitari di fare interventi educazionali e fornire consigli nutrizionali ai pazienti, che possono accedervi mediante una piattaforma dedicata.
Altro punto fondamentale indicato dalle LG è la corretta gestione della terapia ipoglicemizzante:
- sono considerati sicuri e non richiedono particolari adeguamenti di dose metformina, acarbosio, pioglitazone, inibitori DPP-4, agonisti GLP-1;
- gli inibitori di SGLT-2, agendo indipendentemente dall’attività insulinica, sono considerati sicuri relativamente al basso rischio ipoglicemico, tuttavia si consiglia prudenza per il rischio di disidratazione (soprattutto se il Ramadan cade nel periodo estivo) e DKA e per le possibili infezioni genitali;
- le sulfaniluree (SU), molto diffuse nel mondo Musulmano per il basso costo e l’elevata efficacia a breve termine, presentano un elevato rischio di ipoglicemia, pertanto è utile considerare, durante la visita pre-Ramadan, l’eventuale loro sostituzione con altri farmaci ipoglicemizzanti o con SU di nuova generazione o eventuali modifiche degli orari di somministrazione:
- farmaci con unica somministrazione giornaliera: assumere a iftar;
- farmaci con due somministrazioni giornaliere: ridurre dose a suhoor;
- per quanto riguarda l’insulina, è consigliabile ridurre la dose della basale di circa 15-30%, da far assumere preferibilmente a iftar, mentre per l’insulina rapida può essere necessario incrementarne la dose a iftar e ridurla a suhoor.
Infine, non va dimenticato di programmare una rivalutazione al termine del periodo di Ramadan, in modo da verificare l’andamento del DM durante il periodo appena trascorso, ripristinare il normale trattamento farmacologico e consolidare le competenze acquisite dal paziente.
Secondo i dati ISTAT e della fondazione ISMU (Iniziative e Studi sulla Multi-etnicità), si stima che nel 2018 in Italia ci fossero quasi 2.6 milioni di persone di religione musulmana, da cui si può stimare che le persone diabetiche e musulmane siano circa 130.000. Per comprendere meglio tali stime, va considerato che lo studio EPIDIAR afferma che quasi l’80% dei diabetici musulmani digiuna più di 15 giorni durante il mese di Ramadan (42.8% dei DMT1 e 78.7% dei DMT2). Lo studio CREED più recente stima nel 94.2% i soggetti diabetici che digiunano durante il Ramadan e di questi il 67.6% lo fa per tutto il periodo.
In conclusione, vista la progressiva multi-culturalità della società italiana e le grandi sfide che tale periodo richiede di affrontare, è fondamentale che il team diabetologico sia adeguatamente formato per poter affrontare con le dovute competenze e il necessario rispetto questo precetto religioso così importante per il mondo musulmano.
Bibliografia
- Lessan N, et al. Glucose excursions and glycaemic control during Ramadan fasting in diabetic patients: insights from continuous glucose monitoring (CGM). Diabetes Metab 2015, 41: 28-36.
- Hassanein M, et al. Diabetes and Ramadan: practical guidelines. Diabetes Res Clin Pract 2017, 126: 303-16.
- Bravis V, et al. Ramadan Education and Awareness in Diabetes (READ) programme for Muslims with type 2 diabetes who fast during Ramadan. Diabet Med 2010, 27: 327-31.
Gestione del diabete durante il ricovero ospedaliero
Il diabete colpisce il 5% circa della popolazione italiana, ma la prevalenza di diabete aumenta al 15-20% nella popolazione ricoverata in ospedale (1); il diabete assorbe il 10% circa delle risorse economiche del SSN e quella per ricovero ospedaliero è al primo posto tra le voci di spesa.
I diabetici ricoverati in ospedale sono più anziani, soffrono maggiormente di comorbilità e hanno una durata di degenza maggiore (1-3).
Bibliografia
- AMD-SID. Standard italiani per la cura del diabete mellito 2014.
- AMD-SID-FADOI. Trialogue. La gestione dell’iperglicemia in area medica: istruzioni per l’uso. 2012.
- Umpierrez GE, et al. Management of hyperglycemia in hospitalized patients in non critical care setting: an Endocrine Society practice guideline. J Clin Endocrinol Metab 2012, 97: 16-38.
Gestione del diabete durante il ricovero in area medica
Maurizio Nizzoli
UOC Endocrinologia e Malattie Metaboliche, Dipartimento Internistico Forlì - Cesena, Ospedale G. B. Morgagni, Forlì
Ospedale M. Bufalini, Cesena
(aggiornamento al 20 aprile 2021)
L’iperglicemia è presente nel 31-38% dei pazienti ricoverati in area internistica, in circa il 44% dei pazienti con sindrome coronarica acuta, in oltre il 40% dei pazienti con scompenso cardiaco e in un terzo dei ricoverati in area intensiva; si accompagna a degenza più prolungata e maggiore morbilità e mortalità, in particolare in coloro nei quali non era già nota. Anche l’ipoglicemia può determinare esiti sfavorevoli e riflettere una maggiore severità di malattia. Pertanto, sia l’iperglicemia, sia l’ipoglicemia dovrebbero essere evitate in ospedale.
In tutti i pazienti ricoverati deve essere determinata la glicemia al momento dell’ingresso e il giorno seguente a digiuno. In tutti coloro in cui si rileva iperglicemia deve essere eseguita la determinazione della HbA1c, che consentirà di discriminare tra diabete e iperglicemia da stress e il grado di compenso metabolico in quelli con diabete noto.
Nell’ultimo decennio l’insulina è stata considerata la principale terapia in ospedale, in quanto i vecchi farmaci ipoglicemizzanti presentavano profili di sicurezza sfavorevoli che ne sconsigliavano l’utilizzo. In base ad alcuni recenti studi controllati, i nuovi farmaci sembrano offrire nuove opportunità di utilizzo in ambito ospedaliero. Nonostante questi presupposti, è ancora consuetudine in alcuni contesti mantenere la terapia ipoglicemizzante domiciliare nei pazienti con diabete di tipo 2 durante il ricovero. È bene pertanto conoscere i rischi delle diverse classi di farmaci.
I FARMACI: LIMITAZIONI E RISCHI
Metformina
La massima efficacia è possibile con una posologia di 2 g/die.
Filtrato glomerulare: ridurre la posologia se compreso fra 30 e 45 mL/min, sospendere se < 30 mL/min.
Controindicazioni:
- pazienti che non si alimentano;
- ricoverati per un evento acuto per il rischio di acidosi lattica (insufficienza renale, insufficienza respiratoria, sepsi, shock).
Attenzione:
- può essere utile dosare il lattato al momento del ricovero nei pazienti in trattamento domiciliare con metformina;
- sospendere il farmaco 48 ore prima di una procedura diagnostica che prevede l’utilizzo del mezzo di contrasto e riprenderla non prima di 48-72 ore.
Sulfaniluree e glinidi
Sebbene rappresentino una terza o quarta scelta per l’alto rischio di ipoglicemia e il basso profilo di sicurezza cardio-vascolare, sono ancora utilizzate nella pratica della medicina di base, per cui è ancora frequente che vengano ricoverati pazienti in terapia con questi farmaci, in particolare gliclazide e glimepiride. Sebbene non abbia studi significativi, la repaglinide trova ancora un discreto impiego in pazienti con insufficienza renale, sebbene il rischio di ipoglicemia sia il medesimo delle sulfoniluree.
Questi farmaci vanno sempre sospesi in ambito ospedaliero, anche se in UK suggeriscono un loro spazio nell’iperglicemia da steroidi.
Tiazolidinedioni
Il pioglitazone va sospeso per il rischio di ritenzione idrica e scompenso cardiaco.
DPP-IV inibitori
Studi randomizzati e osservazionali in pazienti con iperglicemia da lieve a moderata in ambito ospedaliero non intensivo hanno dimostrato efficacia, tollerabilità e sicurezza (assenza di rischio di ipoglicemia) di questi farmaci (sitagliptin, linagliptin, saxagliptin), sia da soli sia in combinazione con insulina basale. Anche se sono necessari ulteriori studi, è pertanto possibile ipotizzare non solo il mantenimento nei pazienti già in terapia, ma anche un loro utilizzo in casi selezionati, in monoterapia o in combinazione con insulina basale.
SGLT-2 inibitori
Sono farmaci di prima linea in pazienti con diabete di tipo 2 con scompenso cardiaco o malattia renale. Si consiglia di non utilizzarli durante il ricovero per il rischio di chetoacidosi diabetica euglicemica, in particolare nei pazienti che si alimentano poco, e di infezioni genito-urinarie.
Agonisti GLP-1
Sono raccomandati come farmaci di prima o seconda linea nei pazienti diabetici ad alto rischio cardio-vascolare. Per alcune molecole esistono studi randomizzati con risultati favorevoli nel trattamento pre-operatorio (liraglutide) o in area medica non intensiva (exenatide). Sebbene sia possibile ipotizzare di continuare questa terapia in pazienti già in trattamento, sono sconsigliati per i noti effetti collaterali gastro-intestinali.
OBIETTIVI GLICEMICI
Una glicemia > 140 mg/dL (7.8 mmol/L) è considerata la soglia per la diagnosi di iperglicemia in ospedale.
Non vi sono dati sufficienti che abbiano dimostrato la superiorità di un target rispetto a un altro e studi con target particolarmente ambiziosi (< 140 mg/dL) hanno evidenziato un alto rischio di ipoglicemia. Le principali società scientifiche raccomandano obiettivi glicemici compresi tra 140 e 180 mg/dL. Obiettivi meno stringenti vanno riservati a pazienti particolarmente fragili, pluri-patologici, con ridotta aspettativa di vita o in setting ospedalieri nei quali non possa essere garantita una sufficiente assistenza con controlli glicemici frequenti.
COME GESTIRE LA TERAPIA INSULINICA
Tutte le linee guida concordano nel considerare inadeguata una terapia insulinica “al bisogno” o “sliding scale” con insulina regolare o analogo rapido, perché non previene l’iperglicemia, ma la corregge a posteriori, con maggior rischio di ipoglicemia. Non va considerata come tale una condotta che preveda controlli glicemici prima dei pasti oppure ogni 6-8 ore, con somministrazione di insulina rapida secondo un algoritmo in base al valore riscontrato.
Il trattamento insulinico va impostato in base alla clinica, in particolare al grado di iperglicemia e al compenso metabolico, al tipo di terapia se il diabete era già noto, e da ultimo, ma non meno importante, al contesto organizzativo nel quale si opera (tabella 1).
| Tabella 1 | |
| Caratteristiche del paziente | Schema insulinico consigliato |
| Iperglicemia lieve (< 200–250 mg/dL) HbA1c < 8–8.5% Paziente non insulino-trattato |
Insulina basale ± DPP-IV inibitore o insulina rapida |
| Iperglicemia moderata (< 250–300 mg/dL) HbA1c < 8.5–9.5% |
Insulina basale ± insulina rapida |
| Iperglicemia grave (> 300–350 mg/dL) HbA1c > 9.5% |
Basal-bolus |
Il trattamento insulinico basal-bolus è costituito da:
- insulina basale, con la quale si assicura la normoglicemia durante il periodo inter-prandiale e il digiuno notturno, attraverso l’inibizione della lipolisi e la modulazione della produzione epatica di glucosio;
- insulina prandiale “bolus”, con la quale si garantisce l’utilizzazione periferica del glucosio per prevenire l’iperglicemia post-prandiale.
Sono oggi disponibili diversi tipi di insulina prandiale e basale (tabelle 2 e 3), di cui è bene conoscere inizio e durata di azione. L’utilizzo degli analoghi per via sottocutanea presenta numerosi vantaggi rispetto all’insulina umana, il cui utilizzo va riservato alla via endovenosa.
| Tabella 2 Insuline ad azione rapida |
||||
| Tipo | Nome | Inizio azione (min) | Picco (h) | Durata (h) |
| Regolare umana | Humulin R Actrapid |
30 | 2-3 | 5-8 |
| Analogo rapido | Lispro Aspart Glulisina |
15-30 | 1-3 | 3-5 |
| Analogo ultra-rapido | Fiasp | 7-20 | 1-2.5 | 3-5 |
| Tabella 3 Insuline basali |
||
| Tipo | Emivita (h) | Durata d’azione (h) |
| Glargine U 100 | 10-12 | 21-27 |
| Glargine U 300 | 12-14 | 26-32 |
| Detemir | 8-12 | 16-23 |
| Degludec | 24-36 | > 42 |
Come impostare una terapia insulinica secondo schema basal-bolus:
- stabilire il fabbisogno insulinico giornaliero, secondo le caratteristiche cliniche del paziente (tabella 4);
| Tabella 4 Stima della dose totale giornaliera di insulina |
|
| Situazione clinica | U/kg |
| Paziente neo-diagnosticato Paziente non insulino-trattato al domicilio Età > 70 anni Paziente fragile Paziente terminale Alto rischio di ipoglicemia |
0.1-0.2 |
| Età > 70 anni Insufficienza renale cronica (GFR < 60 mL/min) Insufficienza epatica Glicemia 200-300 mg/dL |
0.2-0.3 |
| Normopeso HbA1c compatibile con buon controllo metabolico Età < 70 anni GFR > 60 mL/min Glicemia > 300 mg/dL |
0.4 |
| Normopeso Età < 70 anni Glicemia > 300 mg/dL HbA1c compatibile con scadente compenso metabolico GFR > 60 mL/min |
0.5 |
| Condizioni associate a insulino-resistenza BMI > 30 Terapia steroidea |
0.6 |
- stabilire gli analoghi dell’insulina da utilizzare:
- insulina basale: 50% del fabbisogno giornaliero;
- analogo ad azione rapida ai pasti: 50% del fabbisogno giornaliero, da suddividere 20-30% a colazione, 30-40% a pranzo, 30-40% a cena;
- aggiustamenti in base ai controlli glicemici (prima dei tre pasti principali e alle ore 22, in particolare se è prevista la somministrazione bedtime dell’insulina basale):
- in base ai valori della glicemia a digiuno si procede alle variazioni dell’insulina basale (tabella 5);
- l’aggiustamento dell’insulina prandiale una volta impostato lo schema basal-bolus va effettuato in base all’algoritmo a gestione infermieristica (tabella 6).
| Tabella 5 Modificazioni insuliniche secondo glicemia (mg/dL) |
|||
| A digiuno | Titolazione insulina basale | ||
| > 140 | Aumentare di 2 U ogni 2 giorni, sino a stabilizzare glicemia a digiuno ~ 140 mg/dL | ||
| < 70 | Ridurre del 20% | ||
| 70–120 | Ridurre del 10% | ||
| 121–180 | Nessun cambiamento | ||
| 181–300 | Aumentare del 10% | ||
| > 300 | Aumentare del 20% | ||
| Se la glicemia si mantiene nella giornata > 180–200 mg/dL aggiungere insulina ad azione rapida ai pasti | |||
| Tabella 6 Modificazioni analogo rapido o insulina prandiale nello schema basal-bolus secondo glicemia pre-prandiale (mg/dL) |
|||
| Pre-prandiale | Resistenza all’insulina e azione da intraprendere | ||
| Bassa | Media | Alta | |
| < 150 | 0 | 0 | 0 |
| 151-200 | 0 | + 1 U | + 2 U |
| 201–250 | + 1 U | + 2 U | + 5 U |
| 251–300 | + 2 U | + 4 U | + 8 U |
| 301–350 | + 3 U | + 6 U | + 11 U |
| 351–400 | + 5 U | + 8U | + 13 U |
| 401–450 | + 6 U | + 10 U | + 15 U |
Nei pazienti trattati con sola insulina basale nei quali la glicemia si mantenga > 180–200 mg/dL nelle 24 ore, nonostante un’efficace titolazione, si può aggiungere un DPP-IV inibitore nei casi di iperglicemia lieve, oppure un analogo rapido ai pasti secondo le seguenti istruzioni:
- nei pazienti non insulino-trattati al domicilio:
- < 70 kg: iniziare con 3-4 U sc ai pasti;
- > 70 kg: iniziare con 4-5 U sc ai pasti;
- in base ai valori della glicemia ogni 6-8 ore se il paziente non si alimenta o a quella prima dei pasti, si procede rispettivamente o alla somministrazione o alla variazione delle U di analogo ad azione rapida in base ad algoritmo la cui gestione è infermieristica (tabella 7).
| Tabella 7 Somministrazione di analogo ad azione rapida secondo glicemia (mg/dL) misurata ogni 6-8 ore (qualora il paziente non si alimenti e sia in trattamento con sola basale) |
|||
| Glicemia | Resistenza all’insulina | ||
| Bassa | Media | Alta | |
| 200–250 | 2 U | 3 U | 4 U |
| 251–300 | 3 U | 4 U | 5 U |
| 301–350 | 4 U | 5 U | 7 U |
| 351–400 | 4 U | 5 U | 7 U |
| 401–450 | 5 U | 7 U | 8 U |
| Per valori di glicemia > 300 mg/dL, controllare la glicemia dopo 2 ore per valutare la risposta: se ancora superiore, valutare un’ulteriore dose di correzione e passare alla colonna successiva da sinistra a destra. | |||
Consigli utili
- Nei pazienti già in trattamento insulinico secondo schema basal-bolus, continuare secondo lo schema abituale, eventualmente riducendo la basale del 20% nei pazienti di tipo 2 insulino-trattati, e fare riferimento all’algoritmo di correzione (tabella 6) se la glicemia pre-prandiale non fosse a target.
- Nel paziente in trattamento insulinico con schema basal-bolus che in ospedale dovesse saltare il pasto, non somministrare l’analogo rapido se la glicemia fosse < 200 mg/dL.
- Non sospendere la terapia insulinica basale serale a fronte di valori glicemici normali o bassi, in particolare in un paziente già insulino-trattato al domicilio.
- In uno schema basal-bolus prevedere la somministrazione dell’analogo basale al mattino invece della sera in caso di rischio di ipoglicemia notturna oppure nell’eventualità di difficoltà gestionale nei controlli glicemici (vedi controllo glicemico notturno prima di coricarsi).
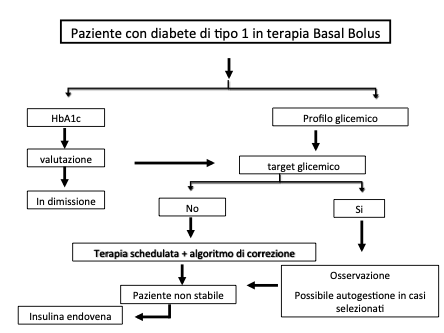
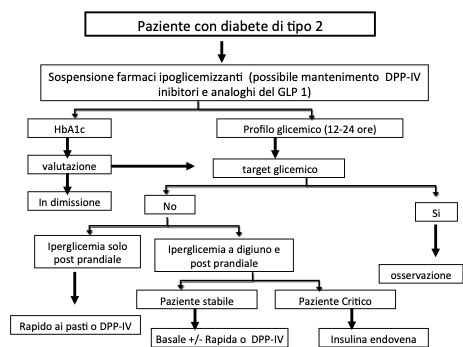
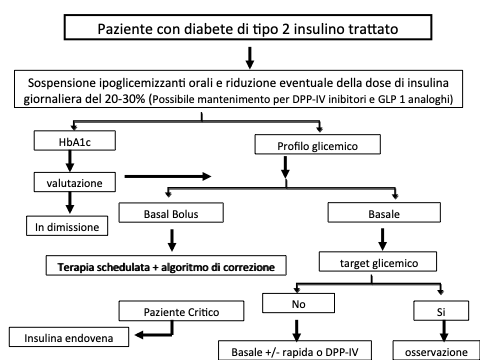
GESTIONE DI ALCUNE SITUAZIONI PARTICOLARI
Terapia insulinica infusionale nel paziente critico
Sono numerosi in letteratura gli schemi proposti ed è opportuno che ogni realtà ne faccia proprio uno, condiviso con tutto il personale, con il quale fare esperienza e prendere confidenza gestionale. Uno schema di facile utilizzo e ampiamente collaudato è quello proposto da AMD-SID–OSDI della regione Emilia Romagna (tabella 8).
| Tabella 8 Terapia insulinica infusionale nel paziente critico |
|
| Obiettivo glicemico | Personalizzato |
| Preparazione infusione di insulina | 1° via: 49.5 mL di soluzione fisiologica + 50 U *insulina rapida (1 mL di soluzione corrisponde a 1 U di insulina). 2° via: glucosata al 5% + KCl 20 mEq/L a 30–60 mL/h (da attivare solo per glicemie comprese tra 200–250 mg/dL). |
| *Utilizzare preferibilmente insulina umana (Humulin R, Actrapid, Insuman R); è possibile utilizzare anche analogo rapido: Humalog 100 (non usare Humalog 200), lispro, Novorapid, glulisina (Apidra mai in soluzione glucosata o Ringer). Controllare la glicemia capillare dopo 1 ora, per verificare dose secondo lo schema sottostante, poi ogni 2 ore per le prime 12 ore, poi ogni 4 ore se la glicemia è stabile. Quando abbiamo 3 glicemie successive entro l’obiettivo glicemico stabilito e il paziente è stabile o può riprendere l’alimentazione per os, possiamo embricare la terapia insulinica sottocute. L’analogo basale va somministrato 1-2 ore prima della sospensione della terapia endovenosa, per evitare il rimbalzo iperglicemico a seguito della brusca cessazione della somministrazione dell’insulina endovena. |
|
| Glicemia (mg/dL) | Velocità di infusione + bolo |
| > 500 | 5 mL/h + bolo iniziale 10 U |
| 400–500 | 4 mL/h + bolo di 8 U |
| 300–400 | 3 mL/h + bolo 3 U |
| 250–300 | 2.5 mL/h |
| 200-250 | 2.5 mL/h + glucosata 5% + KCl (apertura 2° via) |
| 150–200 | 1.5 mL/h (di notte 1 mL/h h) |
| 110–150 | 1 mL/h (di notte 0.5 mL/h) |
| < 110 | Stop infusione insulina, mantenere attiva la 2° via |
| ≤ 70 | Infondere glucosata al 10% per almeno 2-4 ore e fare controllo glicemico ogni ora e conseguente adeguamento infusione di insulina |
Il paziente con problematiche nutrizionali
| Tabella 9 | |
| Nutrizione enterale | |
| Premesse | La somministrazione continua è più vantaggiosa di quella intermittente. Utilizzare le diete formulate specificamente per il diabete. |
| Come calcolare il fabbisogno insulinico (N.B. fare un bolo di insulina con analogo rapido se all’inizio della nutrizione enterale la glicemia è > 200 mg/dL) |
Basale: 0.15–0.25 U/kg Nutrizionale: 1 U/10 g di glucosio introdotto (da 0.6 a 1.7 in relazione al fenotipo) |
| Che tipo di insulina utilizzare | Analogo lento: glargine o degludec |
| Quando controllare la glicemia | Ogni 6–8 ore (o più frequentemente in caso di necessità) e fare boli di analogo rapido in base all’algoritmo (tabella 7) se i valori glicemici non sono a target |
| Nutrizione parenterale | |
| Premesse | La somministrazione continua è più vantaggiosa di quella intermittente. |
| Calcoli | Consigliabile un apporto di glucosio non < 100–150 g/die, utilizzando 1 U di insulina per 10 g di glucosio (1.5–2 U ogni 10 g se glicemia elevata o negli obesi) |
| Opzioni |
|
Gestione delle ipoglicemie
In ogni reparto in cui vi sia una adeguata “cultura” dell’iperglicemia deve esserci anche un protocollo condiviso per la gestione dell’ipoglicemia (intesa come valore di glicemia < 70 mg/dL) (tabella 8). Anche una rapida discesa della glicemia (cataglicemia) può dare gli stessi sintomi dell’ipoglicemia, pur con valori ancora normali.
| Tabella 10 Gestione dell’ipoglicemia |
|
| Severa (paziente non vigile) | Glucosata al 33%, seguita da infusione di glucosata al 10% o glucagone. Qualora non sia possibile la somministrazione di glucosio per via infusionale e il paziente sia in coma, si può ricorrere a glucagone per via intramuscolare (Glucagen – Novo) o per via spray nasale (Baqsimi – Lilly). Alimentazione con bevande zuccherate non appena possibile. |
| Moderata–lieve | Somministrare 15 g di zucchero (tre zollette o tre bustine di zucchero o ½ lattina di bevanda zuccherata o un cucchiaio di miele o un brik di succo di frutta). Controllare la glicemia dopo 15 minuti e somministrare altri 15 g di zucchero se glicemia < 100 mg/dL. Ripetere la somministrazione fino a quando si ottiene glicemia > 100 mg/dL. |
La terapia steroidea
Nel paziente ospedalizzato è frequente l’impiego di terapia steroidea e quando vengono somministrate dosi di steroidi alte e ripetute è comune riscontrare valori molto elevati di glicemia nella fascia oraria pomeridiana e prima di cena. In questi casi è necessario ricorrere a terapia insulinica, iniziando con 0.5–1.2 U/kg, distribuita per il 25% come basale (somministrata al mattino) e 75% come prandiale (in particolare al pranzo).
Nel caso di diabete meta-steroideo o di pazienti diabetici che erano ben compensati con terapia ipoglicemizzante orale, si può ricorrere a insulina basale (0.1–0.3 U/kg) somministrata al mattino + analogo rapido ai pasti, se necessario, in base all’algoritmo (tabella 7).
Fare attenzione al rischio di ipoglicemia nel caso di rapida riduzione o sospensione della terapia steroidea.
Chetoacidosi diabetica (DKA) e iperglicemia con iperosmolarità (HSS)
Nei pazienti ospedalizzati in cui si rileva glicemia > 250–300 mg/dL, bisogna escludere DKA e HSS; nel 30% dei casi è possibile riscontrare una coesistenza di DKA e HSS. È bene conoscere anche la chetoacidosi euglicemica, entità nosografica ben delineatasi dopo l’introduzione dei SGLT-2 inibitori, ma che poteva verificarsi, seppur molto raramente, in gravidanza, in corso di insufficienza epatica o abuso di alcol. I pazienti più esposti sono quelli normopeso o che fanno diete con ridotto apporto di carboidrati, fanno eccessivo sforzo fisico o riducono la terapia insulinica in un contesto di insufficiente apporto nutrizionale e/o di malattia intercorrente (tabella 11).
| Tabella 11 Diagnosi differenziale biochimica |
|||
| DKA euglicemica | DKA | HSS | |
| Glicemia (mg/dL) | < 180-200 | > 250 | > 350 |
| pH | << 7.30 | < 7.30 | > 7.30 |
| Chetonemia (mmol/L) | > 3 | > 3 | < 3 |
| Chetonuria | > 2+ | > 2+ | Assente |
| Kaliemia | = o ↑ | ↑↑ | = o ↓ |
| Osmolarità (mOsm/kg) | variabile | variabile | > 320 |
| Bicarbonati (mmol/L) | << 15 | < 15 | > 15 |
| Gap anionico (mmol/L) | > 12 | > 12 | < 12 |
| Tabella 12 Formule di calcolo |
|
| Osmolarità plasmatica | Formula: (2 x Na (mEq/L)) + (glicemia (mg/dL)/18) + (azotemia (mg/dL)/2.8). Il valore del Na è quello misurato e non corretto. Se non disponiamo del valore dell’azotemia, possiamo ometterlo e otteniamo un’osmolarità di poco inferiore e quindi accettabile. |
| Na corretto | Na + ((2 x (glicemia (mg/dL) – 100))/100) |
| K corretto | K – (7.4 – (7.4 – pH) x 0.6) |
| Il pH può essere calcolato anche su prelievo venoso: il pH è di 0.02–0.15 unità inferiore rispetto a quello arterioso, mentre i bicarbonati sono di 1.88 mmol/L superiori. Queste differenze sono poco significative e non inficiano la diagnosi e la gestione della DKA | |
| Tabella 13 Terapia della chetoacidosi (DKA) e dell’iperglicemia con iperosmolarità (HHS) |
|
| Reidratazione | Soluzione fisiologica |
| Correzione iperglicemia | Idratazione e insulina |
| Correzione elettroliti | Potassio |
| Correzione acidosi | Blocco chetogenesi Smaltimento corpi chetonici Bicarbonato (solo per pH < 7) |
| Complicanze | Edema cerebrale Infezioni Trombosi Acidosi ipercloremica Sindrome da distress respiratorio |
| Tabella 14 Parametri di laboratorio e strumentali da monitorare |
| Glicemia Chetonemia: ß-OH-butirrato Creatinina Emogasanalisi venosa o arteriosa (equilibrio acido-base) Na e K Saturazione Ossigeno Pressione arteriosa ECG |
| Tabella 15 Come correggere |
|
| Disidratazione |
|
| Iperglicemia |
Somministrare insulina solo per glicemie > 300 mg/dL e iperchetonemia e K > 3 mEq/L o nell’eventualità che una corretta idratazione non consenta un calo della glicemia di 50–100 mg/dL/h.
Mantenere glicemia tra 150–250 mg/dL. |
| Iperkaliemia |
|
| Acidosi |
La produzione di idrogenioni si interrompe con il blocco della chetogenesi e lo smaltimento dei corpi chetonici per via renale.
Controllare il pH dopo un’ora e ripetere l’infusione se pH < 7. |
IL PROCESSO EDUCAZIONALE
Il momento del ricovero deve rappresentare l’opportunità di effettuare, in caso di diabete neo-diagnosticato, oppure rinforzare, in caso di diabete già noto, il messaggio educazionale sulla malattia, sull’auto-gestione della stessa e sul rischio di ipoglicemia nell’eventualità che il paziente venga dimesso con terapia insulinica. L’educazione può essere proposta dal team diabetologico, se presente nel presidio ospedaliero, oppure dal personale infermieristico di reparto. Nell’eventualità di un paziente non auto-sufficiente e fragile, è bene coinvolgere i familiari. Deve essere rivalutata complessivamente la terapia (non solo quella specifica per il diabete) e devono essere assegnati gli obiettivi terapeutici personalizzati.
LA DIMISSIONE
La dimissione deve essere programmata, possibilmente tre giorni prima nel caso di un paziente per la prima volta in terapia insulinica, per consentire l’intervento educazionale adeguato.
Nella lettera di dimissione di tutti i pazienti deve essere indicata la data della visita di controllo presso il servizio di diabetologia, se presente, oppure presso l’ambulatorio specialistico di riferimento.
| Tabella 16 | |
| HbA1c all’entrata in reparto | Terapia |
| < 7% (53 mmol/mol) | Si conferma la terapia precedente se conforme alla condizione clinica del paziente e alle linee guida. |
| 7–9% (53–75 mmol/mol) | Intensificare la terapia ipoglicemizzante secondo linea guida ± insulina basale. |
| > 9% (75 mmol/ml) | Insulina basale ± rapida o terapia di combinazione secondo linea guida. |
BIBLIOGRAFIA ESSENZIALE
- Pasquel FJ, Lasang MC, Dhatariya K, Umpierrez GE. Management of diabetes and hyperglycaemia in the hospital. Lancet Diabetes Endocrinol 2021, 9: 174–88.
- ADA. Diabetes Care in the Hospital: Standard of medical care in diabetes -2021. Diabetes Care 2021, 44 suppl 1: S211-20.
- Umpierrez G, et al. Hospital Diabetes Meeting 2020. J Diabetes Sci Technol 2020, 14: 928-44.
- AMD-SID. Standard italiani per la cura del diabete mellito. 2018.
- Umpierrez GE, Krytkowski M. Diabetic emergencies – ketoacidosis, hyperglycaemic hyperosmolar state and hypoglycaemia. Nature Rev Endocrinol 2016, 12: 222-32.
- Beltramello G, Manicardi V, Trevisan R. AMD-FADOI-SID. Trialogue: gestione dell’iperglicemia in area medica. Istruzioni per l’uso: Documento condiviso di Associazione Medici Diabetologi (AMD), Federazione delle Associazioni dei Dirigenti Ospedalieri Internisti (FADOI) e Società Italiana di Diabetologia (SID). Ital J Med 2012, 6: 123-32.
- Umpierrez G, et al. Management of hyperglycaemia in hospitalized patients in non-critical care setting: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2012, 97: 16-38.
Gestione del diabete durante il ricovero in area chirurgica
Giorgio Borretta
Endocrinologia, AO S Croce e Carle, Cuneo
(aggiornato al 7 gennaio 2020)
Introduzione
Oltre il 10% dei pazienti sottoposti a chirurgia è affetto da diabete (1-4); anche nei pazienti chirurgici il diabete comporta un aumento della morbilità, della durata del ricovero e dei costi della degenza. Nei pazienti chirurgici affetti da diabete è riportato un numero di giorni di degenza in eccesso del 45% rispetto ai non diabetici. Il tasso di mortalità peri-operatorio è del 50% più alto di quello della popolazione non diabetica (4). Le ragioni di questi risultati negativi sono molteplici:
- ipo e iperglicemia;
- co-morbilità multiple, tra cui le complicanze micro- e macro-vascolari;
- complessità della terapia multi-farmacologica;
- uso inappropriato di insulina in infusione endovenosa;
- errori durante la conversione dall’insulina in infusione endovenosa ai farmaci abituali;
- infezione peri-operatoria;
- limitata consapevolezza dell’aumentato bisogno di cure dei pazienti diabetici;
- carenza di linee guida aziendali per la gestione del diabete.
Impatto della chirurgia sul diabete
In generale la chirurgia comporta un periodo di digiuno, che a sua volta induce uno stato catabolico. Inoltre, la chirurgia maggiore è associata a stress metabolico, con aumento della secrezione di ormoni contro-regolatori e inibizione della secrezione insulinica. A una fase iniziale di ridotta secrezione insulinica, segue una fase di insulino-resistenza. Nei pazienti non diabetici ciò comporta un rialzo transitorio della glicemia. I pazienti diabetici hanno una capacità ridotta o assente di compensare l’aumentato fabbisogno di insulina e sono quindi a rischio di scompenso glicemico, risultando così maggiormente esposti al rischio di infezioni post-operatorie (4).
La gestione del diabete in area chirurgica
In ospedale, la presa in carico del paziente diabetico da parte di team specialistici si è rivelata efficace nel ridurre del 30% circa la durata dei ricoveri, anche nei reparti chirurgici. Studi anglo-sassoni (4) hanno inoltre dimostrato che l’implementazione di un servizio infermieristico diabetologico a supporto dei reparti chirurgici ha significativamente ridotto la durata del ricovero e aumentato sensibilmente la percentuale della chirurgia one-day.
Le principali linee-guida diabetologiche nazionali e internazionali (1,3,5-7) trattano estensivamente la gestione del paziente diabetico in regime di ricovero ospedaliero, in area critica e non intensiva; viceversa, le indicazioni specifiche relative al paziente chirurgico affetto da diabete sono limitate e poggiano su una base di evidenze poco consistenti o derivate dalla esperienza di singoli centri (8). Il servizio sanitario britannico ha emanato linee-guida (4) per il management peri-operatorio dei pazienti diabetici in età adulta; il documento fornisce indicazioni dettagliate sulla corretta gestione e sulla presa in carico del paziente diabetico, dal momento della valutazione pre-operatoria, lungo le varie fasi della degenza, sino alla dimissione.
I principali obiettivi da perseguire, secondo le linee guida britanniche, nella gestione peri-operatoria del paziente diabetico possono essere così riassunti:
- favorire, ove possibile, il trattamento dell’iperglicemia mediante modificazioni della terapia abituale, riducendo il ricorso alla terapia insulinica ev, che comporta elevato rischio di eventi avversi;
- definizione di protocolli condivisi con i reparti chirurgici per terapia insulinica ev, infusione di liquidi, monitoraggio glicemico ed elettrolitico, attivazione di consulenze diabetologica e dietologica;
- ridurre l’impatto dello scompenso glicemico sugli esiti post-chirurgici (in particolare infezioni e lesioni da pressione);
- implementare programmi che accelerano la ripresa post-intervento, con precoce ripristino di dieta e terapia abituali;
- dimissione sicura e concordata con MMG e servizi territoriali, per la presa in carico delle competenze diabetologiche.
Per il raggiungimento di tali obiettivi, vanno intraprese iniziative di carattere clinico e organizzativo, che riguardano l’intero percorso del paziente, dal momento della valutazione pre-ricovero sino alla dimissione dall’ospedale.
- Acquisizione di informazioni clinico-anamnestiche esaurienti da parte del MMG, in particolare riguardo a: compenso metabolico (HbA1c, eventuale instabilità glicemica e suscettibilità all’ipoglicemia), comorbilità, complicanze diabetiche note, terapie farmacologiche in atto.
- Consulenza diabetologica per idoneità all’intervento chirurgico e prescrizione terapia ipoglicemizzante peri-operatoria sulla base di informazioni relative a tipo di intervento, durata del digiuno peri-operatorio, rischio di infezioni e di lesioni da pressione, impiego di mdc iodati, presunta durata della degenza. Nei pazienti giudicati non idonei per scompenso glicemico, prevedere la rivalutazione diabetologica a breve termine, previo adeguamento della terapia ipoglicemizzante.
- Favorire il ricovero il giorno dell’intervento, evitando nella maggioranza dei casi l’ingresso il giorno precedente.
- Prevedere la priorità di lista operatoria mattutina o pomeridiana per i diabetici, anche per ridurre la durata del digiuno.
- Predisposizione della terapia ipoglicemizzante peri-operatoria, modificando quella domiciliare (insulina sc e/o altri ipoglicemizzanti) in caso di digiuno breve (non superiore a un pasto principale), limitatamente ai pazienti in buon compenso glicemico; nei restanti casi è indicata la terapia insulinica ev, secondo protocolli condivisi, corredati di algoritmo di correzione dell’ipo-iperglicemia.
- La metformina va sospesa il giorno dell’intervento.
- È consigliabile una sospensione anticipata (4-7 giorni) di SGLT-2 inibitori (l’utilizzo di SGLT-2 inibitori è comunque sconsigliato durante la degenza in area chirurgica).
- La dose di insulina serale nel giorno precedente quello dell’intervento chirurgico va diminuita di circa il 25%.
- Predisposizione di piano di monitoraggio glicemico capillare post-operatorio: controllo orario nell’immediato post-operatorio, poi ogni 4-6 ore se glicemia stabile in caso di terapia insulinica ev; prima dei pasti e della eventuale somministrazione bed-time di insulina nei restanti casi.
- Predisposizione target glicemici: tra 80 e 180 mg/dL durante infusione di insulina ev; < 140 e < 180 mg/dL nei restanti casi, rispettivamente a digiuno e dopo il pasto; target più stringenti, < 110-140 mg/dl, solo in pazienti selezionati con rischio ipoglicemico basso o assente.
- Predisposizione di protocolli condivisi per l’infusione di liquidi ev, correzione delle ipoglicemie, impiego di mdc iodati.
- Verifica di eventuale contro-indicazione all’uso di calze elastiche per la profilassi dei trombo-embolismi (in caso di neuropatia diabetica e di vasculopatia ischemica arti inferiori di grado severo).
- Favorire implementazione di procedure chirurgiche (ad esempio la chirurgia fast track, evitando però la somministrazione pre-operatoria di malto-destrine o similari nel diabetici insulino-trattati) e anestesiologiche (approccio multi-modale per il controllo del dolore e del vomito nel post-operatorio) favorenti il ripristino precoce della dieta orale e della terapia ipoglicemizzante abituale.
- Controllo meticoloso delle infezioni e ispezione dei piedi e di altre aree soggette a pressione.
- Alla dimissione (puntuale, anche nel week end):
- provvedere all’educazione del paziente, soprattutto se dimesso con terapia differente da quella abituale;
- presa in carico ambulatoriale del paziente in compenso non ottimale;
- predisposizione di misure idonee per pazienti che necessitano di supporto domiciliare o di trasferimento presso lungo-degenza.
Bibliografia
- AMD-SID. Standard italiani per la cura del diabete mellito. 2018.
- AMD-SID-FADOI. Trialogue. La gestione dell’iperglicemia in area medica: istruzioni per l’uso. 2012.
- Umpierrez GE, et al. Management of hyperglycemia in hospitalized patients in non critical care setting: an Endocrine Society practice guideline. J Clin Endocrinol Metab 2012, 97: 16-38.
- Dhatariya K, et al. NHS diabetes guideline for the perioperative management of the adult patient with diabetes. Diabet Med 2012, 29: 420-33.
- Handelsman Y, et al. American Association of Clinical Endocrinologists medical guidelines for clinical practice for developing a diabetes mellitus comprehensive care plan. Endocr Pract 2011, 17 suppl 2: 1-53.
- The Canadian Diabetes Association. 2013 clinical practice guidelines for the prevention and management of diabetes in Canada. Can J Diabetes 2013, 37: S1-212.
- Diabetes Care in the Hospital. Standard of Medical Care in Diabetes - 2020. Diabetes Care 2020, 43 suppl 1: S193-202.
- Simha V, Shah P. Perioperative glucose control in patients with diabetes undergoing elective surgery. JAMA 2019, 321: 399-400.
Gestione del diabete durante il ricovero in terapia intensiva
Marco Gallo
SC Endocrinologia Oncologica DU, AOU Città della Salute e della Scienza – Molinette, Torino
L’iperglicemia acuta è comune nei soggetti ricoverati in unità di terapia intensiva (UTI), potendo derivare da numerosi fattori: secrezione di ormoni della contro-regolazione per effetto dello stress, effetti dei farmaci somministrati, ecc.
Gli obiettivi glicemici e le strategie terapeutiche ideali, in tale contesto, sono da anni oggetto di acceso dibattito. L’iperglicemia, indipendentemente dalla presenza o meno di diabete noto, si associa a maggiore morbilità e mortalità nei pazienti ricoverati in condizioni critiche, sia nella popolazione adulta sia in quella pediatrica. Esistono numerose evidenze che dimostrano peggiori esiti clinici in presenza di cattivo compenso glicemico in soggetti ricoverati in UTI mediche o chirurgiche per traumi, infezioni o eventi cardiovascolari. Per contro, solamente alcuni studi (e in determinati contesti) hanno dimostrato che un controllo glicemico intensivo si associa a riduzione della mortalità (in acuto e nei mesi successivi alla dimissione) e a miglioramento degli esiti sanitari (per es., la durata della degenza o di permanenza in UTI, i tassi d’infezione e la necessità di terapie di supporto). Va poi ricordato che la dimostrazione di un’associazione tra ipoglicemie/iperglicemie ed esiti peggiori non è prova definitiva di un rapporto di causalità, potendo esse costituire dei semplici marcatori di situazioni cliniche più gravi. Resta comunque il fatto che, ancora oggi, la gestione della glicemia nelle UTI non viene sempre considerata con la dovuta attenzione.
Attualmente, le principali società scientifiche internazionali concordano nel raccomandare come ragionevole, perseguibile e sicuro un target glicemico compreso tra 140 e 180 mg/dL (7.7-10 mmol/L) nei pazienti ricoverati presso ICU, mentre obiettivi glicemici più ambiziosi (per es. 80-110 mg/dL [4.4-6.1 mmol/L]) o più liberali (per es., 180-200 mg/dL [10-11.1 mmol/L]) hanno talvolta dimostrato di correlare con esiti più sfavorevoli (1-5). Il vasto studio multicentrico internazionale NICE-SUGAR (Normoglycemia in Intensive Care Evaluation-Survival Using Glucose Algorithm Regulation), per esempio, ha evidenziato aumentata incidenza di ipoglicemie severe e ripetute, nonché maggiore mortalità a 90 giorni, nei soggetti randomizzati a un controllo troppo ambizioso (target 81-108 mg/dL [4.5-6.0 mmol/L]), rispetto a quelli gestiti puntando a un target di maggiore sicurezza (144-180 mg/dl [8.0-10.0 mmol/L]) (6). Obiettivi glicemici più stretti possono essere appropriati in casi selezionati (se ottenibili senza rischi significativi di ipoglicemia, e comunque mai < 108 mg/dL [6.0 mmol/L]), specie in assenza di diabete noto prima del ricovero, ma non esistono evidenze conclusive a favore di questa affermazione.
Nella maggior parte dei pazienti critici ricoverati presso UTI, la terapia insulinica considerata più appropriata è quella mediante infusione venosa continua, anche se sono disponibili scarse evidenze della superiorità di questa rispetto alla somministrazione sottocutanea. La terapia insulinica ev è praticata generalmente con insulina umana regolare. Tra gli analoghi dell’insulina, solamente quelli rapidi possono essere utilizzati nella terapia infusionale, con alcuni limiti (tabella 1) (7). Parallelamente, deve essere garantito al paziente l’apporto di glucosio (con soluzioni glucosate ev o attraverso la nutrizione artificiale).
| Modalità consentite per l’utilizzo degli analoghi insulinici rapidi nella terapia infusionale | |||||
| Analogo rapido | Sol Fisiologica (NaCl 0.9%) | Glucosata 5% | Glucosata 10% (KCl 40 mEq) | Ringer | Stabilità a temperatura ambiente |
| Aspart | sì | sì | sì | n.s. | 24 h a concentrazioni comprese fra 0.05-1 U/mL |
| Glulisina | sì | no | no | no | 48 h a concentrazioni di 1 U/mL |
| Lispro | sì | sì | n.s. | n.s. | 48 h a concentrazioni comprese fra 0.1-1 U/mL |
| n.s.: non specificato nel Riassunto delle Caratteristiche del Prodotto (RCP) tratto dal Position Paper AMD-SID-SIEDP sugli analoghi rapidi del’insulina (7) e dalle RCP dei 3 analoghi (depositate in EMA, ultimo accesso 20/3/14) |
|||||
Nel tempo, sono stati proposti diversi schemi per l’infusione insulinica ev in terapia intensiva (8-11), gestibili prevalentemente dallo staff infermieristico; tra questi, celebre è quello proposto dalla Yale University (11), che peraltro raccomanda un obiettivo glicemico più stretto rispetto a quello attualmente consigliato.
Protocollo “di Yale” (modificato da 1,11,12)
- Preparare soluzione per infusione: 49.5 mL soluzione fisiologica + 50 U di insulina umana regolare (= 1 U/mL)
- Calcolare bolo insulina e velocità infusionale iniziale: dividere glicemia iniziale per 100, poi arrotondare alla ½ U più vicina
- Target: 100-139 mg/dL
- Controllo glicemia ogni ora fino a stabilizzazione (3 glicemie in range)
- Controlli successivi: ogni 2 h fino a stabilizzazione per 12-24h, poi eventualmente ogni 4h
- Algoritmo per modificazioni della velocità di infusione dell’insulina
- Se glicemia < 50 mg/dL: STOP infusione di insulina
- iniettare ev 50 mL di glucosata 50%
- controllo glicemia ogni 15’: quando ≥ 100 mg/dL, attendere 1 ora, poi riprendere infusione al 50% dell’ultima velocità
- Se glicemia 50-74 mg/dl: STOP infusione di insulina
- se paziente sintomatico (o incapace di valutare i sintomi): iniettare ev 50 mL di glucosata 50%, controllo glicemia ogni 15’
- se paziente asintomatico: valutare l’iniezione ev di 25 mL di glucosata 50%, o la somministrazione di 250 mL di succo di frutta po, controllo glicemia ogni 15-30’
- quando glicemia ≥ 100 mg/dL, attendere 1 h poi riprendere infusione al 75% dell’ultima velocità
- Se glicemia ≥ 75 mg/dL:
- scegliere una delle 4 COLONNE della tabella sottostante in relazione alla glicemia attuale
- determinare la velocità di variazione oraria della glicemia, che identifica una CELLA nella tabella sottostante
| Glicemia (mg/dL) | Modifica della velocità infusionale* | ||||
| 75-99 | 100-139 | 140-199 | ≥ 200 | ||
| Velocità di variazione oraria della glicemia | aumento > 50 mg/dL/h | aumento | aumentare di “2Δ” | ||
| aumento HGT > 25 mg/dL/h | aumento 1-50 mg/dL/h o invariata | invariata o riduzione 1-25 mg/dL/h | aumentare di “Δ” | ||
| aumento | aumento 1-25 mg/dL/h, invariata o riduzione 1-25 mg/dL/h |
riduzione 1-50 mg/dL/h |
riduzione 26-75 mg/dL/h | invariata | |
| invariata o riduzione 1-25 mg/dL/h | riduzione 26-50 mg/dL/h | riduzione 51-75 mg/dL/h | riduzione 76-100 mg/dL/h | ridurre di “Δ” | |
| riduzione > 25 mg/dL/h # | riduzione > 50 mg/dL/h | riduzione > 75 mg/dL/h | riduzione > 100 mg/dL/h | ridurre di “2Δ” | |
#: STOP infusione di insulina, controllo glicemia ogni 30’: quando ≥ 100 mg/dL, riprendere infusione al 75% dell’ultima velocità
* Le variazioni nella velocità infusionale (“Δ”) sono determinate in base alla velocità in corso
| Variazioni nella velocità infusionale | ||
| velocità in corso (U/h) | Δ = variazione velocità (U/h) | 2Δ = 2 x variazione velocità (U/h) |
| < 3 | 0.5 | 1 |
| 3-6 | 1 | 2 |
| 6.6-9.5 | 1.5 | 3 |
| 10-14.5 | 2 | 4 |
| 15-19.5 | 3 | 6 |
| 20-24.5 | 4 | 8 |
| ≥ 25 | 5 | 10 |
I protocolli più completi prendono in considerazione non solamente la glicemia del momento o le condizioni del paziente (obesità, infezioni, terapia steroidea e altre condizioni predisponenti all’insulino-resistenza), ma anche la dinamica di variazione della glicemia nelle ore precedenti e la velocità d’infusione dell’insulina. Numerosi schemi si sono dimostrati efficaci e sicuri, ma non esistono studi che li abbiano posti direttamente a confronto per verificare la superiorità di alcuni rispetto ad altri: non è quindi possibile raccomandare l’adozione generale di un protocollo specifico. Pazienti diversi possono necessitare di strategie differenti, e alcuni protocolli complessi potrebbero essere più facilmente implementabili in determinati contesti (per es., disponibilità di personale sufficiente e addestrato), dove andranno adeguatamente condivisi e validati. In tal senso, è ritenuto fondamentale motivare e coinvolgere gli infermieri di reparto in programmi formativi che consentano una gestione autonoma e responsabile dei protocolli.
La criticità maggiore nell’utilizzo degli schemi per la terapia insulinica ev è rappresentata dal rischio di ipoglicemie, per la cui riduzione è indispensabile un frequente monitoraggio glicemico (ogni 1-2 ore): prassi che è difficile da adottare al di fuori delle UTI. In futuro, potrebbero trovare maggiore diffusione algoritmi infusionali guidati da sistemi di monitoraggio sottocutaneo in continuo della glicemia.
Bibliografia
- AMD/SID. Standard italiani per la cura del diabete mellito. 2014.
- Moghissi ES, Korytkowski MT, DiNardo M, et al. American Association of Clinical Endocrinologists; American Diabetes Association. American Association of Clinical Endocrinologists and American Diabetes Association consensus statement on inpatient glycemic control. Endocr Pract 2009, 15: 353-69.
- American Diabetes Association. Standards of medical care in diabetes--2014. Diabetes Care 2014, 37: S14-80.
- Canadian Diabetes Association Clinical Practice Guidelines Expert Committee. Canadian Diabetes Association 2013 Clinical Practice Guidelines for the Prevention and Management of Diabetes in Canada. Can J Diabetes 2013, 37: S1-212.
- Beltramello G, Manicardi V, Trevisan R. Trialogue: managing hyperglycaemia in internal medicine: instructions for use. Acta Diabetol 2013, 50: 465-73.
- The NICE-SUGAR Study Investigators. Intensive versus conventional glucose control in critically ill patients. N Engl J Med 2009, 360: 1283-97.
- AMD-SID-SIEDP. Position Paper sugli analoghi rapidi dell'insulina. 2012.
- Malmberg K, Norhammar A, Wedel H, et al. Glycometabolic state at admission: important risk marker of mortality in conventionally treated patients with diabetes mellitus and acute myocardial infarction. Long term results from the diabetes and insulin-glucose infusion in acute myocardial infarction (DIGAMI) study. Circulation 1999, 99: 2626-32.
- Van den Berghe G, Wilmer A, Hermans G, et al. Intensive insulin therapy in the medical ICU. N Engl J Med 2006, 354: 449-61.
- Furnary AP, Gao G, Grunkemeier GL, et al. Continuous insulin infusion reduces mortality in patients with diabetes undergoing coronary artery bypass grafting. J Thorac Cardiovasc Surg 2003, 125: 1007-21.
- Goldberg PA, Roussel MG, Inzucchi SE. Clinical results of an updated insulin infusion protocol in critically ill patients. Diabetes Spectrum 2005, 18: 188-91.
- Beltramello G, Manicardi V, Trevisan R. Trialogue: La gestione dell’iperglicemia in area medica. Istruzioni per l’uso. Il Giornale di AMD 2012, 15: 93-100.
Gestione del diabete durante il ricovero in oncologia
Marco Gallo
SC Endocrinologia Oncologica DU, AOU Città della Salute e della Scienza – Molinette, Torino
(aggiornato al 4 giugno 2019)
INTRODUZIONE
La presenza di diabete, soprattutto di tipo 2, conferisce un significativo incremento del rischio tumorale. Dati relativi alla situazione italiana hanno confermato un’incidenza complessiva di tumori maggiore tra i soggetti con diabete tipo 2, in particolare per il carcinoma del fegato, del pancreas, del colon-retto e della vescica in entrambi i sessi, e dell’endometrio per le donne (1).
Circa il 38% dei pazienti ricoverati in oncologia presenta iperglicemia: di questi il 26% ha una storia nota di diabete, per gli altri si tratta di una condizione evidenziata o sviluppata con il ricovero (2). Nei pazienti con nuova diagnosi di neoplasia si stima che sia presente diabete nell’8-18% dei casi (3).
Anche nei pazienti oncologici, l’iperglicemia durante il ricovero può associarsi a un aumento di morbilità e mortalità (2), così come la presenza di diabete si associa a una prognosi oncologica peggiore rispetto alla popolazione generale (3). La patologia diabetica si associa nel paziente con neoplasia a una maggior prevalenza di infezioni, a periodi di remissione più brevi, a una riduzione dei tempi di sopravvivenza e a tassi di mortalità più elevati in seguito a intervento chirurgico (3,4). I meccanismi possono essere molteplici, legati agli effetti dell’iperglicemia sui processi immunitari e infiammatori, ad alterazioni trombotiche e allo stress ossidativo, alla disidratazione, all’instaurarsi di chetoacidosi o di iperosmolarità e alla presenza di complicanze, soprattutto cardio-vascolari (3).
Possibili cause di iperglicemia nei pazienti oncologici sono quelle direttamente legate alla patologia, allo stress o all’intervento chirurgico conseguenti, a processi infettivi concomitanti, alla nutrizione artificiale, ai trattamenti anti-tumorali o alle terapie di supporto, specialmente quella steroidea (5). L’iperglicemia si sviluppa attraverso i meccanismi di resistenza insulinica, glicogenolisi e gluconeogenesi, anche in soggetti che non hanno storia di diabete, frequentemente in presenza di fattori di rischio (familiarità per diabete, eccesso di peso, sindrome metabolica, pregresso diabete gestazionale) che vanno conseguentemente ricercati e segnalati nell’indagine anamnestica (3).
È quindi essenziale che anche nel paziente oncologico l’iperglicemia sia “ricercata”, monitorata e trattata, con obiettivi glicemici ben definiti e personalizzati (6,7). Anche nei pazienti non diabetici deve essere controllata la glicemia, sia a digiuno sia post-prandiale (soprattutto in caso di terapia steroidea). La determinazione dell’HbA1c può fornire un’indicazione della presenza di un diabete pre-esistente e del grado di compenso metabolico degli ultimi mesi, ma ha un valore limitato nei pazienti con anemia e/o elevato fabbisogno trasfusionale (neoplasie ematologiche) e in caso di diabete di recente insorgenza per effetto dei trattamenti (HbA1c > 6.5%)(6,7).
OBIETTIVI GLICEMICI
Le linee guida e le indicazioni della letteratura per la gestione del diabete nel paziente oncologico sono relativamente poche. Negli Standard Italiani per la Cura del Diabete Mellito è dedicato uno specifico capitolo nella sezione sulla “Cura del diabete in popolazioni specifiche”, differenziando l’approccio in funzione del trattamento del diabete in terapia oncologica attiva o in palliazione (8). Risulta pertanto fondamentale, sia per l’impostazione del target glicemico (tabella 1) sia per la scelta della terapia più appropriata, valutare lo stadio della malattia tumorale e la prognosi. Questa valutazione, talvolta difficile per l’endocrinologo, può essere effettuata più agevolmente con una collaborazione stretta e continuativa con gli oncologi e/o gli ematologi curanti (9).
| Tabella 1 Obiettivi glicemici nel paziente oncologico in relazione all’aspettativa di vita |
||
| Prognosi | Range glicemico (mg/dL) | Note |
| Mesi | 120-270 | |
| Settimane | 180-360 | Ridurre la frequenza dei controlli della glicemia al minimo accettabile. |
| Giorni | (180-360) | Valutare l’interruzione dei controlli della glicemia e semplificare la terapia anti-diabetica. Somministrare insulina rapida se glicemia > 360 mg/dL, tenendo conto del grado di coscienza del paziente. |
| Paziente terminale | (180-360) | Valutare l’interruzione della terapia anti-diabetica. |
Pazienti con breve aspettativa di vita
Nel paziente con prognosi stimabile in settimane o pochi mesi “i valori glicemici possono essere mantenuti in un range compreso fra 180 e 360 mg/dL”, ridiscutendo gli obiettivi di compenso con il paziente e i caregiver e limitando le rilevazioni glicemiche allo stretto indispensabile per evitare sintomi da ipo- o iperglicemia (tabella 1). Inoltre, “andrebbe favorita, per quanto consentito dalle condizioni cliniche, un’alimentazione naturale, rispettosa delle abitudini e dei gusti del soggetto, evitando indicazioni dietetiche restrittive e privilegiando la qualità rispetto alla quantità”. Con la riduzione dell’appetito, nel diabete tipo 2, la dose di anti-diabetici deve essere ridotta, privilegiando farmaci a basso rischio di ipoglicemia e di eventi avversi. Nel paziente tipo 1, la dose di insulina può essere ridotta a causa dell’anoressia o del vomito; anche in assenza di alimentazione, è in ogni caso necessaria una dose minima di insulina basale per evitare la chetoacidosi” (8).
Nel paziente con prognosi di giorni, “se il paziente è cosciente e presenta sintomi di iperglicemia, si può somministrare insulina rapida quando la glicemia è > 360 mg/dL. Se il paziente non è cosciente, valutare l’interruzione dei controlli glicemici e la sospensione della terapia anti-diabetica, condividendo con i familiari questa scelta”. Vanno comunque considerati gli aspetti etici nel paziente con diabete tipo 1 o pancreasectomizzato (8).
Pazienti con lunga aspettativa di vita
Nelle altre situazioni, quando la malattia è ancora in fase iniziale e/o la prognosi non è infausta, durante il ricovero ospedaliero valgono gli obiettivi glicemici del paziente non affetto da malattia neoplastica, differenziati in base alle condizioni cliniche (8).
Paziente in situazione critica: nei pazienti ricoverati in terapia intensiva, medica o chirurgica, sono indicati valori glicemici tra 140 e 180 mg/dL, in funzione del rischio stimato di ipoglicemia. Tale indicazione deriva dai risultati dello studio NICE-SUGAR, che, grazie all’importante casistica e al follow-up, chiarisce i dati a volte controversi degli studi dell’ultimo decennio (10).
Pazienti in situazione non critica: secondo gli Standard Italiani per la Cura del Diabete Mellito, nei pazienti in situazione non critica sono generalmente auspicabili valori glicemici pre-prandiali < 140 mg/dL (90-140 mg/dL secondo le Linee Guida Canadesi) e post-prandiali < 180 mg/dL, se conseguibili senza rischi elevati di ipoglicemia. In alcune situazioni cliniche a elevato rischio di ipoglicemia, è opportuno un innalzamento degli obiettivi glicemici (8,11). Per i pazienti oncologici in terapia anti-tumorale attiva, “i valori glicemici possono essere mantenuti in un range compreso fra 120 e 270 mg/dL, al fine di ridurre al minimo il rischio di ipoglicemie; l’approccio va personalizzato in relazione ai percorsi di cura prospettati e alle modificazioni nutrizionali prevedibili: vanno presi in considerazione il livello di autonomia gestionale, la presenza di caregiver affidabili e l’anamnesi diabetologica personale. Gli obiettivi primari del controllo glicometabolico vanno ridiscussi con paziente e caregiver” (8).
Pazienti chirurgici: studi osservazionali hanno dimostrato che l’iperglicemia aumenta il rischio di infezioni post-operatorie ed è associata a un aumento dell’utilizzo di risorse per il ricovero. In pazienti sottoposti a interventi chirurgici maggiori, come quelli cardio-chirurgici, la diagnosi di diabete pre-esistente è un fattore di rischio per complicanze infettive, insufficienza respiratoria o renale, mentre l’iperglicemia è associata ad aumento di morbilità e mortalità, indipendentemente dalla storia di diabete (11).
Per quanto riguarda la chirurgia minore, alcuni piccoli studi hanno evidenziato l’assenza di complicazioni se i valori glicemici nella fase peri-operatoria sono mantenuti tra 90 e 200 mg/dL. Le linee guida canadesi sulla gestione del diabete in ospedale, in concordanza con le indicazioni per la chirurgia maggiore, suggeriscono di mantenere livelli di glicemia tra 90 e 180 mg/dL anche per i casi di chirurgia minore, tenendo in considerazione il rischio di ipoglicemia del paziente. Poiché in fase post-operatoria si può riscontrare nel paziente una percezione alterata dell’ipoglicemia per l’effetto dei farmaci somministrati durante l’anestesia e per la somministrazione di anti-dolorifici, il rischio di ipoglicemia può essere ridotto con un adeguato monitoraggio della glicemia, secondo protocolli ben definiti (11,12). Anche nel paziente sottoposto a trapianto di midollo per neoplasie ematologiche è indicato mantenere un compenso glicemico il più vicino possibile a quello normale, per massimizzare le possibilità di successo e ridurre il rischio di infezioni.
IL TRATTAMENTO
Anti-diabetici non insulinici
Come per i pazienti non oncologici, la terapia anti-diabetica più appropriata nel soggetto ricoverato è quella con insulina, sospendendo gli altri anti-diabetici eventualmente in terapia. Gli studi sull’utilizzo di anti-diabetici non insulinici nel paziente in ospedale sono infatti carenti e ci sono anche contro-indicazioni al loro utilizzo, come l’irregolarità dei pasti, la concomitanza di insufficienza d’organo (renale, epatica, cardiaca o respiratoria) o l’utilizzo di mezzi di contrasto per alcuni esami strumentali. In particolare, nel paziente oncologico questo tipo di trattamento è reso meno praticabile da inappetenza e nausea indotte da alcune terapie o dalla malattia stessa, difficoltà a nutrirsi regolarmente, uso più frequente di steroidi o ricorso alla nutrizione artificiale (11).
Nei 2-3 giorni precedenti la dimissione va valutata la possibilità di passare a terapia non insulinica, specie nel paziente con problemi di auto-gestione/assistenza, verificando l’adeguatezza del compenso attraverso i dati del monitoraggio glicemico. In questi casi, privilegiare gli anti-diabetici a basso rischio di effetti collaterali (metformina se ben tollerata, inibitori DPP-4, inibitori SGLT-2, sulfoniluree a breve durata d’azione [es. gliclazide, glipizide, gliquidone], glinidi) (tabella 2 e tabella 3).
| Tabella 2 Terapia anti-diabetica nel paziente oncologico |
||
| Contesto | Terapia da preferirsi | Anti-diabetici non raccomandati |
| Gestione cronica del diabete tipo 2 | Metformina Acarbose Sulfoniluree Glinidi Agonisti recettoriali GLP-1 Pioglitazone DPP-4 inibitori SGLT-2 inibitori Insuline |
|
| Gestione del diabete durante terapia steroidea | Iperglicemia lieve: farmaci con particolare efficacia sull’iperglicemia post-prandiale (glinidi, agonisti recettoriali del GLP-1 [exenatide, lixisenatide], DPP-4 inibitori, SGLT-2 inibitori [canagliflozin]). Iperglicemia severa: insulina. |
|
| Gestione del diabete durante nutrizione artificiale | Insulina sc (boli insulina rapida e/o insulina basale) o ev | |
| Tabella 3 Principali vantaggi e svantaggi dei farmaci anti-diabetici nel paziente oncologico |
||||
| Classe | Farmaco | Vantaggi | Svantaggi | Controindicazioni |
| Biguanidi | Metformina | Basso costo, effetto vantaggioso sul peso (#). | Nausea, anoressia, vomito, dolori addominali. | Insufficienza renale ed epatica; insufficienza respiratoria ipossica, sepsi. Prudenza se previste indagini radiologiche con mdc. |
| Sulfoniluree | Glibenclamide, gliclazide, glimepiride, glipizide, gliquidone | Basso costo, efficacia. | Ipoglicemie, aumento ponderale (#). | Insufficienza renale ed epatica. |
| Glinidi | Repaglinide | Azione sull’iperglicemia post-prandiale da steroidi. | Ipoglicemie, limitata efficacia, frequenza di somministrazione | Insufficienza renale ed epatica. |
| Glitazoni | Pioglitazone | Basso costo, azione sull’insulino-resistenza da steroidi, prevenzione della progressione dell’aterosclerosi. | Anemia, edemi, fratture; lenta insorgenza di azione, limitata efficacia. | Insufficienza cardiaca ed epatica. |
| Inibitori alfa-glicosidasi | Acarbose | Azione sull’iperglicemia post-prandiale da steroidi. | Dolori addominali, flatulenza, diarrea; bassa efficacia. | Subocclusione intestinale; prudenza se prevista RT addominale. |
| DPP-4 inibitori | Alogliptin, linagliptin, saxagliptin, sitagliptin, vildagliptin | Ben tollerati, effetto neutro sul peso. | Infezioni del tratto respiratorio superiore? Pancreatiti? Scompenso cardiaco? Limitata efficacia, costi elevati. |
Grave insufficienza epatica. |
| Agonisti recettoriali del GLP-1 | Dulaglutide, exenatide, exenatide LAR, liraglutide, lixisenatide | Pratici (somministrazione settimanale per exenatide LAR e dulaglutide), benefici cardio-vascolari e renali (liraglutide), calo ponderale (#). | Nausea, anoressia, vomito, dolori addominali; pancreatiti? necessità di addestramento, costi elevati. | Gravi patologie gastro-intestinali, grave insufficienza renale, pregresse pancreatiti. |
| SGLT-2 inibitori | Canagliflozin, dapagliflozin, empagliflozin | Benefici cardio-vascolari e renali (canagliflozin ed empagliflozin), calo ponderale (#). | Deplezione di volume, disidratazione, cheto-acidosi, micosi genitali; costi elevati. | Pazienti a rischio aumentato di deplezione di volume; insufficienza renale grave. |
| Analoghi rapidi dell’insulina | Aspart, glulisina, lispro | Efficacia universale; effetti anabolici; efficacia nel contrastare l’iperglicemia post-prandiale da steroidi, flessibilità di dose e di timing di somministrazione. | Ipoglicemie, necessità di addestramento, riluttanza del paziente/dei familiari, aumento ponderale (#). | Nessuno. |
| Analoghi lenti dell’insulina (basale) | Detemir, glargine | Efficacia universale; effetti anabolici; pratici. | Ipoglicemie, necessità di addestramento, aumento ponderale (#). | Nessuno. |
| Analoghi ultra-lenti dell’insulina | Degludec, glargine U300 | Efficacia universale; effetti anabolici; pratici; intervalli flessibili di somministrazione | Ipoglicemie, necessità di addestramento, costi elevati, aumento ponderale (#). | Nessuno. |
| # L’aumento ponderale può essere vantaggioso nei pazienti oncologici con diabete e importante riduzione del peso. Analogamente, in questi pazienti il calo ponderale può rappresentare uno svantaggio. | ||||
Terapia insulinica
È il trattamento preferibile nei pazienti ricoverati. La somministrazione della terapia insulinica “al bisogno” (sliding scale), cioè somministrare una dose prestabilita di insulina rapida in risposta all’iperglicemia, oltre un target stabilito, non è efficace nel mantenere un buon compenso metabolico ed è più rischiosa per le ipoglicemie, per cui non è raccomandata (6,11). Nei pazienti oncologici è preferibile utilizzare analoghi insulinici ad azione rapida e lenta per la loro maneggevolezza, duttilità e prevedibilità di effetto, in particolare in caso di alimentazione erratica legata all’esecuzione di esami diagnostici, alla presenza di nausea/vomito, problemi di deglutizione e/o di digestione (3). I pazienti con diabete tipo 1 che si alimentano possono continuare con il loro schema abituale, preferibilmente con analoghi insulinici ad azione rapida e lenta, adattando i dosaggi in base ai dati del monitoraggio glicemico. Il bolo ai pasti può non essere somministrato nel caso il paziente non sia in grado di nutrirsi regolarmente per problemi legati alla malattia e/o alle terapie, oppure può essere somministrato subito dopo il pasto, ma non deve essere mai omessa la somministrazione di analogo ad azione lenta (6,11).
Nei pazienti con diabete tipo 2 o non diabetici, durante il ricovero può essere necessario instaurare un trattamento insulinico, magari temporaneo. Anche in questo caso, le evidenze scientifiche confermano la superiorità della terapia insulinica pre-impostata rispetto a quella “al bisogno”. È opportuno quindi impostare la terapia insulinica ritenuta più appropriata sulla base dell’andamento glicemico e delle terapie concomitanti in atto. La scelta della dose insulinica iniziale dipende dalle caratteristiche del paziente: BMI e condizioni cliniche associate, grado di scompenso glicemico e fattori che aumentano il fabbisogno di insulina, quali iperpiressia, infezioni, nutrizione artificiale, terapia steroidea, ecc.) (7).
Il calcolo della dose di insulina da somministrare si basa generalmente su un fabbisogno di 0.3-0.4 U/kg di peso per pazienti normopeso. La dose calcolata può essere suddivisa in un 50% come insulina basale (detemir, glargine, glargine U300 o degludec) e un 50% come insulina rapida da somministrare ai pasti (circa 30% per singolo pasto). Possono essere somministrate dosi di correzione quando i valori glicemici riscontrati superino il target previsto. Il monitoraggio glicemico giornaliero consentirà di eseguire modifiche alla dose di insulina basale o dei boli secondo la tendenza dei valori registrati (6,8,13).
Insulina per infusione endovenosa
La terapia infusionale ev è indicata nei pazienti in fase critica, nel periodo peri-operatorio, nel paziente che non si alimenta ed è in nutrizione artificiale, in quello in terapia con alte dosi di steroidi e ogni volta non sia possibile ottenere un adeguato controllo delle glicemie con la terapia insulinica sottocutanea (6,12). L’insulina impiegata per infusione ev è solitamente la regolare umana; possono essere utilizzati anche gli analoghi rapidi, seguendo le precise indicazioni riportate nel Position Statement AMD-SID-SIEDP (14).
Negli ultimi anni sono stati proposti diversi algoritmi di infusione ev, gestibili routinariamente dallo staff infermieristico, che prevedono l’adeguamento delle dosi di insulina infusa sulla base dei valori glicemici misurati ogni 1-2 ore. In considerazione della molteplicità di opzioni valide disponibili, più che il modello è quindi importante la metodologia di applicazione, che deve essere contestualizzata in ogni realtà ospedaliera secondo un protocollo locale condiviso e validato (12,13).
Dopo la fase critica, può essere programmato il passaggio dalla terapia insulinica ev a quella sottocutanea. Tale passaggio prevede il calcolo delle unità di insulina che il paziente ha ricevuto nelle ultime 24 ore per ottenere il fabbisogno insulinico giornaliero. Tale quantità di insulina, diminuita di un 20%, viene somministrata per un 50% come insulina basale e 50% come insulina prandiale. L’analogo lento deve essere somministrato 2-3 ore prima di sospendere la terapia per via infusionale (11,12).
Pazienti in trattamento nutrizionale artificiale
La nutrizione artificiale va iniziata, di norma, quando la glicemia è < 200 mg/dL in assenza di chetonuria o complicanze come disidratazione o iperosmolarità (15).
In caso di nutrizionale enterale (NE), il trattamento insulinico deve essere scelto in relazione alle modalità di somministrazione della NE.
- In caso di NE ciclica, che preveda un tempo di 10-12 ore, come quella notturna, è utilizzabile insulina ad azione intermedia, che abbia una durata di circa 10-12 ore, che sia regolare o preferibilmente analogo (basale), eventualmente associata a una piccola dose di insulina rapida aggiuntiva.
- Se la nutrizione è intermittente e prevede la suddivisione della quantità totale di miscela in porzioni uguali somministrate più volte al giorno, può essere utilizzato uno schema insulinico basal-bolus, utilizzando il 50% della dose totale giornaliera come basale e l’altro 50% suddiviso in boli da somministrare prima dell’alimentazione (15). Le dosi andrebbero verificate controllando la glicemia prima dell’inizio della NE e due ore dopo il termine.
- La somministrazione a basso flusso continuo nelle 24 ore delle miscele della NE è preferibile anche nei pazienti con iperglicemia, e in questo caso può essere utilizzato un analogo lento sottocute (detemir, glargine, glargine U300 o degludec).
Se si utilizzano insuline a lunga durata d’azione, attenzione alle possibili ipoglicemie se la NE viene interrotta per motivi intercorrenti o legati alla patologia di base. In tal caso, per evitare eventuali complicanze, sono indispensabili un attento monitoraggio delle glicemie e l’utilizzo di infusione ev di soluzioni glucosate.
La nutrizionale parenterale (NP) va iniziata con un quantitativo di glucosio tra 150 e 200 g/die, utilizzando 0.1 U di insulina per grammo di glucosio infuso o 0.15 U se le glicemie sono > 150 mg/dL. Nei soggetti obesi affetti da diabete tipo 2 possono essere necessarie 0.2 U di insulina/grammo di glucosio, mentre per i diabetici di tipo 1, magri, anche 0.5 U/grammo di glucosio. È consigliabile infondere l’insulina separatamente dalla sacca nutrizionale, diluendo per esempio, attraverso una pompa-siringa, 50 U di insulina regolare in 49.5 mL di soluzione salina. Nel paziente in NP totale stabilizzato che utilizza una pompa peristaltica per 24 h, può essere utilizzato un analogo insulinico a curva piatta (glargine, glargine U300 o degludec) sottocute. L’iperglicemia occasionale può essere corretta con analoghi ad azione rapida (lispro, aspart, glulisina) sottocute (15).
Pazienti in terapia steroidea
L’iperglicemia indotta da terapia steroidea è usuale sia nei pazienti diabetici sia in quelli senza diabete noto in precedenza, correlata al tipo di steroide, alla dose totale e alla durata della specifica terapia. Spesso non viene evidenziata la presenza di iperglicemia nel corso della giornata poiché la glicemia abitualmente ricercata è solo quella a digiuno (8).
Per la diagnosi di diabete indotto da steroidi è consigliata la misurazione della glicemia due ore dopo il pranzo. L’effetto degli steroidi sulla glicemia si evidenzia infatti prevalentemente in fase post-prandiale e dipende dalla farmaco-cinetica dello steroide utilizzato. Alcuni studi in pazienti trattati con prednisone hanno evidenziato glicemie più elevate dopo pranzo, con un minor incremento dopo cena e a digiuno. Nei pazienti già diabetici e in quelli trattati con alte dosi di steroidi, l’incremento delle glicemie è significativo anche a digiuno, con l’aumento evidente del fabbisogno insulinico (8).
Il fabbisogno insulinico totale giornaliero di partenza è stimato in 0.5-0.6 U/kg di peso. La dose calcolata viene divisa in 30% come dose basale (detemir, glargine, glargine U300 o degludec) e 70% come analogo rapido dell’insulina pre-prandiale (circa il 30% per singolo pasto) (6).
L’insulina resta la terapia di scelta anche nei pazienti non diabetici o in quelli con diabete tipo 2 precedentemente in sola dieta. Nei soggetti in trattamento con prednisone può risultare efficace l’utilizzo di sola insulina ai pasti, o l’impiego di insulina ad azione intermedia (NPH, detemir) al mattino, per evitare le ipoglicemie notturne, modulando la dose tra 0.1 e 0.4 U/kg, in base al dosaggio del prednisone (8,11). Nei pazienti con controllo metabolico complesso in terapia insulinica sc, è consigliato il passaggio a infusione continua di insulina per via endovenosa (8,11).
Farmaci anti-tumorali con effetto sfavorevole sul compenso diabetico
Oltre agli steroidi, diverse terapie anti-tumorali (es, analoghi della somatostatina o del GnRH, anti-androgeni, inibitori di mTOR, di tirosin-kinasi e dell’angiogenesi) possono esercitare un effetto sfavorevole sul metabolismo glicidico, lipidico e/o sull’equilibrio pressorio, slatentizzando un diabete secondario in soggetti predisposti, peggiorando il compenso delle persone con diabete noto o aumentandone ulteriormente il rischio cardio-vascolare (7,8).
Sporadicamente, l’immuno-terapia con inibitori dei checkpoint immunitario è inoltre in grado di provocare una distruzione autoimmune delle ß-cellule pancreatiche con insorgenza di diabete tipo 1.
BIBLIOGRAFIA
- Ballotari P, Vicentini M, Manicardi V, et al. Diabetes and risk of cancer incidence: results from a population-based cohort study in northern Italy. BMC Cancer 2017, 17: 703.
- Umpierrez GE. Hyperglycemia: an independent marker of in-hospital mortality in patients with undiagnosed diabetes. J Clin Endocrinol Metab 2002, 87: 978-82.
- Psarakis HM. Clinical challenges in caring for patients with diabetes and cancer. Diabetes Spectrum 2006, 19: 157-62.
- Barone BB. Postoperative mortality in cancer patients with preexisting diabetes. Systematic review and meta-analysis. Diabetes Care 2010, 33: 931-9.
- Cignarelli A, Genchi VA, Caruso I, et al. Diabetes and cancer: pathophysiological fundamentals of a 'dangerous affair'. Diabetes Res Clin Pract 2018, 143: 378-88.
- Inzucchi SE. Management of hyperglycemia in the hospital setting. N Engl J Med 2006, 355: 1903-11.
- Gallo M, Muscogiuri G, Felicetti F, et al. Adverse glycaemic effects of cancer therapy: indications for a rational approach to cancer patients with diabetes. Metabolism 2018, 78: 141-54.
- AMD-SID. Standard Italiani per la cura del diabete mellito. 2018.
- Gallo M, Clemente G, Corsi D, et al, on behalf of AMD (the Italian Association of Medical Diabetologists) and AIOM (the Italian Association of Medical Oncology). An integrated care pathway for cancer patients with diabetes: a proposal from the Italian experience. Diabetes Res Clin Pract 2019, DOI: 10.1016/j.diabres.2019.04.036.
- Griesdale DEG, et al. Intensive insulin therapy and mortality among critically ill patients: a meta-analysis including NICE-SUGAR study data. CMAJ 2009, 180: 821-7.
- Houlden R, et al. Canadian Diabetes Association Clinical Practice Guidelines Expert Committee. In-hospital management of diabetes. Can J Diabetes 2013, 37: S77-81.
- Trence DL. The rationale and management of hyperglycemia for in-patients with cardiovascular disease: time for change. J Clin Endocrinol Metab 2003, 88: 2430-7.
- Standards of Medical Care in Diabetes-2019. Diabetes Care 2019, 42 suppl 1: S4-S6.
- AMD-SID-SIEDP. Analoghi rapidi dell’insulina – nota tecnica. 2017.
- Gruppo Diabete e Nutrizione ADI-AMD-SID. Il trattamento insulinico in nutrizione artificiale. 2018.
Coma ipoglicemico
Daniele Barbaro
Sezione Endocrinologia, ASL 6, Livorno
Fisiopatologia ed epidemiologia
La glicemia nell’individuo normale oscilla fra 60 e 140 mg/dL nelle 24 ore e rappresenta il bilancio fra glucosio assorbito dalla dieta, produzione endogena (epatica e renale) e utilizzazione periferica. L’utilizzazione periferica e la produzione endogena sono finemente regolate, in base ai valori di glicemia, dalla secrezione insulinica e dagli ormoni contro-insulari.
Nel paziente diabetico, in trattamento con insulina o ipoglicemizzanti orali secretagoghi, questo meccanismo omeostatico viene ovviamente alterato e un eccesso di trattamento produce ipoglicemia. Classicamente si definisce ipoglicemia una condizione in cui la glicemia è < 50 mg/dL nell’adulto e 40 mg/dL nel bambino. In realtà, sintomi di ipoglicemia compaiono con valori variabili in base a sesso e patologie concomitanti: solitamente le donne giovani possono avere valori normali più bassi e tollerare meglio l’ipoglicemia, mentre i pazienti anziani con vasculopatia e diabete mellito di lunga durata possono avere sintomi neuroglicopenici a valori più elevati.
I sintomi sono caratterizzati da attivazione adrenergica (talora inavvertiti o sfumati per concomitante neuropatia) già per valori fra 50 e 60 mg/dL e successivamente neuroglicopenia, che solitamente inizia per glicemia < 50 mg/dL (tabella). I sintomi neuroglicopenici iniziano con confusione mentale e, se la glicemia scende sotto 30 mg/dL, torpore; il coma ipoglicemico rappresenta l’espressione più grave dell’ipoglicemia e insorge solitamente per valori < 20 mg/dL.
| Sintomatologia dell’ipoglicemia | ||
| Autonomica o da attivazione adrenergica | Ansietà Senso di fame Tremori Pallore Sudorazione Tachicardia Cardiopalmo Midriasi |
|
| Neuroglicopenica (in ordine di comparsa) | Da coinvolgimento corticale | Cefalea Sonnolenza Torpore psichico Ridotta capacità di concentrazione Irritabilità |
| Da coinvolgimento diencefalico e mesencefalico | Convulsioni Spasmi Segno di Babinski Deviazione oculare |
|
| Da coinvolgimento bulbare | Coma Miosi Ipotermia Assenza del riflesso di accomodazione pupillare |
|
Il coma ipoglicemico può insorgere durante trattamento con insulina, sulfaniluree o glinidi. Nei diabetici tipo 1 in buon controllo si riportano in media 1-2 episodi settimanali di ipoglicemia lieve, mentre circa il 30% dei pazienti in trattamento insulinico intensivo è interessato da uno o più episodi di ipoglicemia grave. Nel diabete mellito tipo 2, soprattutto all’inizio, l’ipoglicemia grave è più rara, mentre, con il perdurare della malattia, la neuropatia rende il malato più a rischio per la difficoltà di avvertire i disturbi e per il deficit di increzione di ormoni contro-insulari. In presenza di grave neuropatia, l’ipoglicemia può svilupparsi velocemente fino ad essere grave, senza sintomi premonitori e con improvviso deterioramento del sensorio.
Aspetti clinici e diagnostici
La storia di diabete in trattamento con insulina, sulfaniluree o glinidi sarà ovviamente indispensabile per ipotizzare la diagnosi. I sintomi e segni dell’ipoglicemia, riportati in tabella, ove possibile potranno essere anamnesticamente utili per confortare la diagnosi. In un paziente diabetico, rispetto ad altre cause di coma l’assenza di segni di disidratazione (tipici dei comi chetoacidosico e iperosmolare) orienterà verso un coma ipoglicemico. In caso di coma ipoglicemico, inoltre, la cute più tipicamente è pallida e il paziente è solitamente sudato, con midriasi e iperpnea presenti all’inizio.
La diagnosi è semplice e basterà un semplice stick capillare con un reflettometro. La glicemia capillare con reflettometro sottostima di circa un 10% la glicemia su plasma ed è inoltre poco precisa a bassi valori. La precisione conta però poco, in quanto in questi casi troveremo valori bassi (al di sotto della sensibilità dello strumento) e solitamente 40 mg/dL con disturbo profondo della conoscenza dovrebbero far pensare a cause alternative o comunque concause importanti. Da ricordare che l’ipoglicemia severa può costituire un fattore di rischio per eventi miocardici acuti, in quanto lo stimolo adrenergico può essere causa di aritmia e l’ipoglicemia di per sé può peggiorare un quadro ischemico sottostante. Dunque andrà eseguito subito un ECG, da ripetere successivamente alla risoluzione dell’evento.
Terapia
Premessa la necessità dell’approccio standard in caso di coma, assicurando dunque la pervietà delle vie aeree e se possibile un accesso venoso, la diagnosi è semplice e rapida. La terapia deve tenere soprattutto conto del farmaco che ha determinato l’ipoglicemia.
In caso di ipoglicemia da insulina, soprattutto rapida, ci dobbiamo aspettare una ripresa non solo immediata ma anche definitiva dopo un primo trattamento, salvo casi di inoculazioni di grosse quantità, come ad esempio a scopo suicida. Una unità di insulina metabolizza circa 3 g di glucosio e questo potrà essere utile per calcolare orientativamente la quantità di glucosio da infondere.
In caso di coma ipoglicemico da sulfaniluree, ci dobbiamo aspettare che l’ipoglicemia tenda a ripresentarsi dopo il trattamento iniziale, per un tempo dipendente dalla quantità ingerita e dal tipo di sulfanilurea: per la glibenclamide, se ingerita in largo eccesso, ci dobbiamo ad esempio aspettare una tendenza a recidivare dell’ipoglicemia per un periodo anche di 24 ore o più.
Se vi è la possibilità di prendere rapidamente un accesso venoso, la somministrazione di glucosata rappresenta il modo più semplice. Potrà essere somministrato glucosio 10-20 g (30-50 mL glucosata al 33%), da ripetere fino a ripresa della coscienza e poi mantenere glucosata al 10% a 40 mL/ora e/o incoraggiare l’alimentazione.
Se non vi è possibilità di accesso venoso: glucagone 1 mg im o sc. L’azione del glucagone è pronta, ma di durata limitata a 60-90 minuti e dunque andrà anche in questo caso incoraggiata l’alimentazione alla ripresa della coscienza, soprattutto in caso di coma da sulfaniluree.
In caso di disturbo della coscienza meno importante e dunque con paziente in grado di obbedire a comandi come “aprire la bocca e masticare”, soprattutto nell’impossibilità di attuare terapia endovenosa o con glucagone, si potranno somministrare zuccheri per os. Sconsigliabili comunque bevande liquide (per la possibilità di inalazione del liquido) e caramelle o simili (che possono causare soffocamento). Zucchero da sciogliere in bocca o marmellate dense purchè contengano glucosio possono rappresentare una buona soluzione.
Conclusioni
Episodi ipoglicemici sono frequenti nei pazienti diabetici. Episodi gravi con disturbo di coscienza possono rappresentare un serio pericolo per il paziente. La capacità di riconoscimento dell’inizio dell’ipoglicemia e la possibilità di avere a disposizione carboidrati rappresentano il modo efficace di prevenzione di episodi severi.
I malati che riconoscono poco l’ipoglicemia dovrebbero portare con sé il glucagone ed eventualmente istruzioni per somministrarlo.
Se un paziente diabetico è in stato di incoscienza, la somministrazione di glucosio, indipendentemente dall’avere accertato l’ipoglicemia, è corretta e fa parte delle procedure per i pazienti in coma. Peraltro la diagnosi è semplice anche con l’aiuto di un banale reflettometro.
Circa la terapia, la principale insidia può derivare dal ripetersi dell’ipoglicemia se il malato ha introdotto ingenti quantità di ipoglicemizzanti orali o di insulina.
Bibliografia
- Cox DJ, Gonder-Frederick L, Ritterband L, et al. Prediction of severe hypoglycemia. Diabetes Care 2007, 30: 1370-3.
- Cryer PE, Davis SN, Shamoon H. Hypoglycemia in diabetes. Diabetes Care 2003, 26: 1902-12.
- Devangelio E, Monaco F. Sindromi ipoglicemiche. In: Prontuario di terapia endocrina e metabolica. Monaco F ed. SEU, Roma, 2006: 339.
Chetoacidosi diabetica
Anna Rita Angioni
Diabetologia territoriale, ASL 8 Cagliari
DEFINIZIONE
È un'acidosi metabolica provocata da un'eccessiva concentrazione ematica di corpi chetonici, prodotti in eccesso a causa di una carenza assoluta o relativa di insulina. È caratterizzata da iperglicemia (≥ 250 mg/dL), iperchetonemia e acidosi metabolica (pH arterioso < 7.30; HCO3- < 15 mEq/L) (1).
SEVERITÀ
La severità della chetoacidosi è determinata dal grado di acidosi e si differenzia in (2):
- lieve: pH venoso < 7.3 o HCO3- < 15 mEq/L;
- moderata: pH < 7.2 o HCO3- < 10 mEq/L;
- grave: pH < 7.1 o HCO3- < 5 mEq/L.
EPIDEMIOLOGIA
La chetoacidosi diabetica (DKA) è una grave complicanza acuta del diabete mellito, gravata da un elevato tasso di mortalità (2-5%), anche quando trattata in maniera corretta. Si manifesta principalmente nei pazienti con diabete mellito tipo 1, mentre è un'evenienza rara nel diabete di tipo 2.
L'incidenza varia a seconda dell'età e del sesso, essendo più frequente nelle donne e nei bambini, con un range che va da 4.6 a 13.4 casi/1000 persone/anno (3,4).
Può essere la manifestazione di esordio di un diabete tipo 1, con una frequenza che varia dal 15 al 30% (in Italia) e colpisce prevalentemente i bambini di età < 4 anni, spesso in condizioni socio-economiche disagiate, pertanto con difficoltà di accesso ai presidi di diagnosi e cura, oppure con patologie psichiatriche. Può manifestarsi, altresì, in pazienti con diagnosi nota di diabete mellito tipo 1 in caso di omissione della terapia insulinica, malattie intercorrenti gravi, disturbi alimentari, malfunzionamento di microinfusore.
Nel diabete mellito tipo 2, la DKA si manifesta più raramente, a un'età media di 40 anni e comporta un tasso di mortalità più elevato a causa dell'età più avanzata e del maggiore rischio cardiovascolare (5).
FATTORI PRECIPITANTI
Omissione della terapia insulinica (intenzionale o per errori), malfunzionamento di microinfusore, disordini alimentari, malattie psichiatriche, farmaci steroidei, abuso di alcool o cocaina, infezioni, infarto del miocardio, chirurgia, traumi, gravidanza (6).
FISIOPATOLOGIA
La DKA è determinata da una carenza assoluta di insulina e da un concomitante aumento degli ormoni di contro-regolazione (glucagone, catecolamine, cortisolo e GH). Queste due condizioni determinano da un lato iperglicemia e dall'altro iperchetonemia, coinvolgendo tre attori principali: tessuti periferici, in particolare il muscolo, tessuto adiposo e fegato.
Il glucagone agisce sul fegato, determinando glicogenolisi e gluconeogenesi, e sul muscolo, determinando proteolisi. Le catecolamine (in particolare l'epinefrina) aumentano la liberazione di glucagone, agiscono sul muscolo, aumentando la proteolisi, e sul tessuto adiposo, determinando lipolisi. Il cortisolo aumenta la proteolisi e il GH riduce la lipogenesi e aumenta la lipolisi (fig. 1) (7).
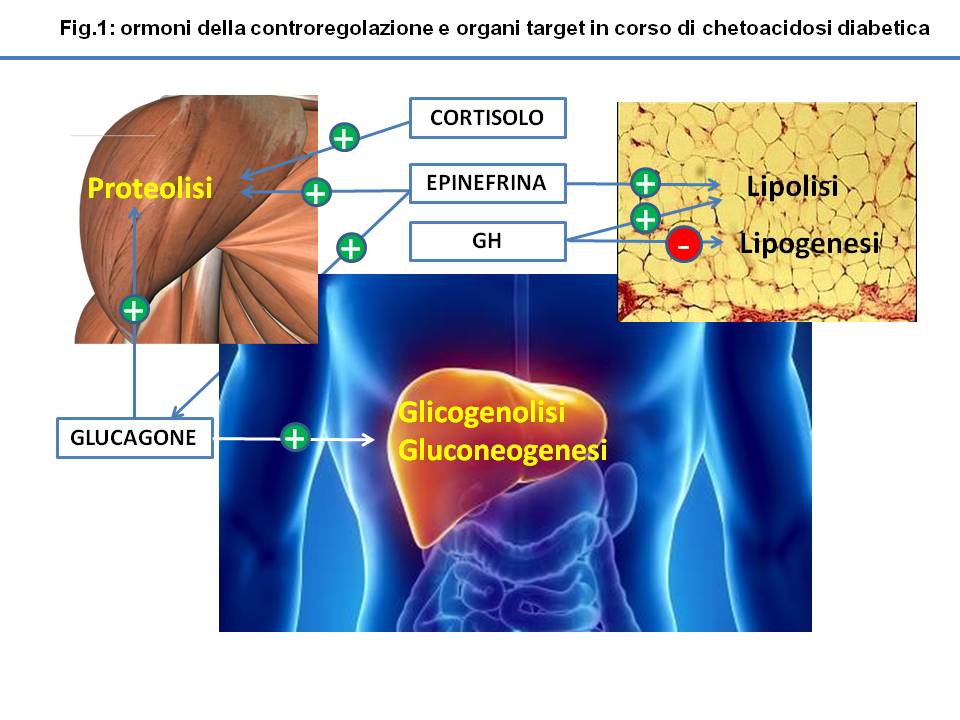
Contemporaneamente, il deficit di insulina determina alterazioni che comportano squilibri elettrolitici e osmotici attraverso le seguenti tappe fisiopatologiche (fig. 2):
- l'impossibilità da parte dei tessuti periferici di utilizzare il glucosio per il normale metabolismo determina iperglicemia;
- la mancata captazione di glucosio da parte delle cellule epatiche stimola la glicogenolisi, mentre l'afflusso di substrati provenienti dalla lipolisi (acidi grassi liberi) e dalla proteolisi (aminoacidi) stimola la gluconeogenesi epatica, con ulteriore aumento della concentrazione in circolo di glucosio che concorre a determinare l'iperglicemia;
- l'iperglicemia è responsabile di glicosuria, che, poichè il glucosio è una sostanza osmoticamente attiva, richiama acqua ed elettroliti, determinando diuresi osmotica e disidratazione; la disidratazione porta in tempi rapidi a iperosmolarità;
- il processo della gluconeogenesi, inoltre, comporta l'aumentata produzione ed eliminazione di corpi chetonici, come prodotti di scarto a partire dai trigliceridi, determinando iperchetonemia; al fine di neutralizzare gli effetti dei corpi chetonici, viene esaurita la riserva alcalina e questo porta alla chetoacidosi;
- con la glicosuria e la diuresi osmotica si arriva ad una perdita di acqua di circa 100 mL/kg e di sodio di 7-10 mEq/L, da cui deriva shock ipovolemico e aumento dell'azotemia che possono portare a morte;
- d'altra parte, iperosmolarità plasmatica e acidosi creano un passaggio di cationi tra compartimento intra- ed extra-cellulare, ovvero gli ioni H+ entrano all'interno della cellula e gli ioni K+ escono dalla cellula. Questo scambio crea uno stato di ipokaliemia intra-cellulare. Il valore di potassio plasmatico è apparentemente normale, ma in realtà la perdita di potassio può arrivare a 5-7 mEq/L;
- lo stato di disidratazione e ipokaliemia intra-cellulare può portare a coma e quindi a morte (7).
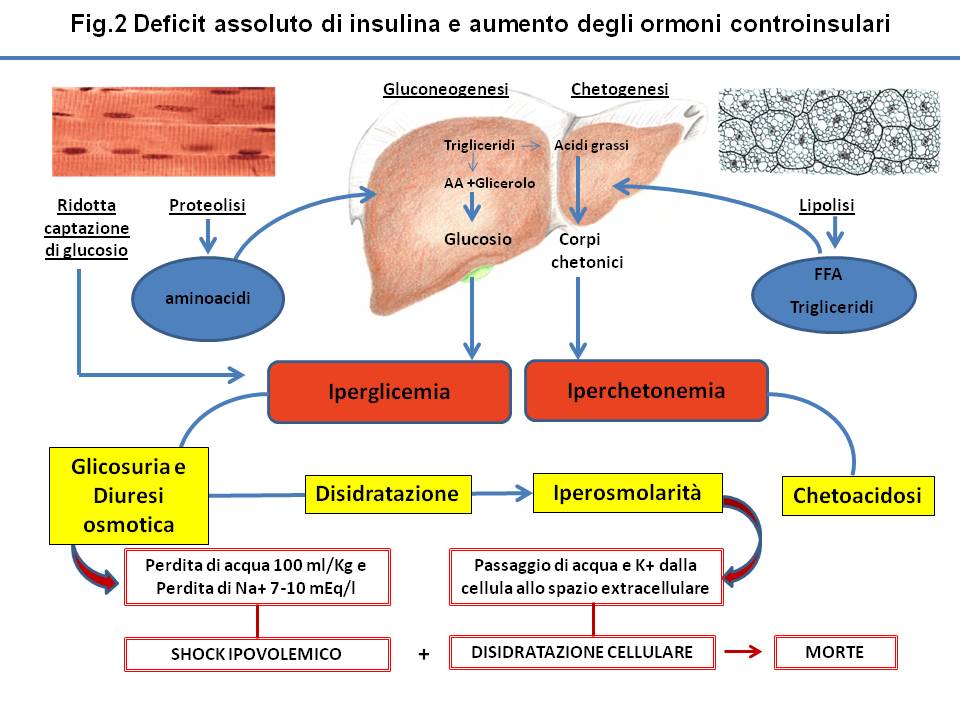
SINTOMATOLOGIA (tab. 1)
Sintomi e segni rilevati in corso di DKA sono ricavabili dai tre principali momenti fisiopatologici: disidratazione, acidosi metabolica e iperosmolarità.
La disidratazione è determinata dalla poliuria e dalla nicturia, cui consegue aumentata sensazione di sete e polidipsia. La cute si presenta secca e plicabile, si rilevano ipotensione sistolica e tachicardia secondaria. Nelle fasi avanzate si può verificare oligo-anuria.
L'acidosi metabolica determina tachipnea compensatoria, con respiro profondo (respiro di Kussmaul) e ipotensione da vasodilatazione. L'iperchetonemia è responsabile del caratteristico alito acetonemico (odore di frutta marcia), dolori addominali, nausea e vomito.
L'iperosmolarità è responsabile delle alterazioni del sensorio fino al coma (8).
| Tabella 1 Segni e sintomi di DKA |
| Poliuria, nicturia, polidipsia (nelle fasi avanzate oligo-anuria) Cute secca e plicabile Ipotensione sistolica, tachicardia secondaria Respiro di Kussmaul, tachipnea, alito acetonemico Dolori addominali, nausea e vomito Alterazioni del sensorio fino al coma |
INDAGINI DIAGNOSTICHE (tab. 2)
La diagnosi di DKA procede attraverso l'esecuzione di: anamnesi ed esame obiettivo, esami ematici e urinari, valutazione del bilancio idrico, emogasanalisi, elettrocardiogramma.
Anamnesi
Molti casi di DKA si verificano in pazienti con diagnosi nota di diabete mellito tipo 1 che omettono di praticare la terapia insulinica, pertanto è fondamentale indagare se precedentemente era nota la diagnosi di diabete (fondamentale in molti casi il supporto dei familiari), se è stata omessa o malpraticata la terapia insulinica, importante conoscere le modalità e tempistica di esordio del quadro acuto (9). In caso di diagnosi non nota, importante conoscere la familiarità per diabete e altre patologie autoimmuni.
Esame obiettivo
Rilevare i parametri vitali permette di evidenziare i segni sopradescritti e riportati in tabella 1 (9,10):
- pressione arteriosa: ipotensione sistolica;
- temperatura: generalmente nella norma, elevata in corso di infezioni intercorrenti;
- frequenza cardiaca: tachicardia;
- frequenza respiratoria: tachipnea con respiro di Kussmaul, alito acetonemico;
- saturazione di ossigeno: generalmente normale;
- Glasgow-Coma Scale: lieve, moderato-grave a seconda dell'alterazione dello stato di coscienza;
- valutazione neurologica;
- stato di disidratazione: cute secca e sollevabile in pliche, mucose aride, giugulari detese sia in clino che in ortostatismo, bulbi oculari infossati, estremità fredde, compresi naso e orecchie, cavo ascellare asciutto;
- peso: se rilevabile, va confrontato con un valore precedente.
Bilancio idrico
La perdita d'acqua corporea si misura secondo la seguente formula (11):
H2O persa = [0.6 x peso (kg)] x [(Na+ misurato (mEq/L)/Na+ normale) -1]
Esempio: 40 kg; Na+ misurato 150 mEq/L
H2O persa = (0.6 x 40)x[(150/135)-1] = 2.7 litri.
Esami ematici
Glicemia: ≥ 300 mg/dL.
K+: normale o basso. La riduzione del potassio è dovuta al vomito e alle perdite renali ma, a causa dell'acidosi metabolica, il K+ passa dal comparto intra-cellulare al plasma, determinando valori falsamente normali di potassiemia. Occorre fare molta attenzione a questa alterazione elettrolitica in corso di terapia. Infatti, non si deve considerare il valore misurato, ma il valore calcolato secondo la seguente formula:
K+ reale = K+ misurato (mEq/L) – 6 x (7.4-pH)
Na+: iponatremia per natriuresi osmotica, formazione di sali con i chetoni, diluizione per richiamo di acqua dal compartimento intra-cellulare a quello extra-cellulare. Anche per il sodio occorre calcolare il sodio reale attraverso questa formula:
Na+ corretto = Na+ misurato (mEq/L) + [(glicemia (mg/dL) - 100)/100]
Azotemia e creatininemia: se aumentate, indicano una contrazione della funzionalità renale e confermano lo stato di disidratazione.
Emocromo: poliglobulia, aumento dell'ematocrito e dell'emoglobina; leucocitosi si può osservare in corso di infezioni precipitanti il quadro acuto o in risposta allo stress della DKA.
Chetonemia: ß-idrossi-butirrato > 3 mmol/L. Questo parametro, se disponibile, permette di confermare la chetoacidosi e può essere usato per monitorare la risposta alla terapia.
Emogasanalisi: pH < 7.3 e HCO3- < 20 mmol/L per consumo di bicarbonato.
Esame urine: glicosuria e chetonuria.
ECG
In corso di ipopotassiemia si osservano onde T appiattite, depressione del tratto ST, onda U prominente (12,13).
| Tabella 2 Indagini diagnostiche in corso di DKA |
|
Anamnesi ed esame obiettivo |
| Tabella 3 Formule per il calcolo del sodio e del potassio corretti in corso di DKA |
| Na+ corretto = Na+ misurato (mEq/L) + [(glicemia (mg/dL) - 100)/100] Es. Na+ 130 mEq/L; glicemia 300 mg/dL Na+ = 130 + [(300 -100)/100] = 130 + 2 = 132 mEq/L |
| K+ corretto = K+ misurato - 6 (7.4 - pH misurato) Es. K+ 4 mEq/L; pH 7.1 K+ = 4 – 6 (7.4 – 7.1) = 4 - 6(0.3) = 4 - 1.8 = 2.2 mEq/L |
TERAPIA
L'obiettivo del trattamento è quello di correggere tutte le alterazioni caratteristiche della DKA, secondo un preciso ordine di priorità, volto alla risoluzione del quadro generale e alla prevenzione di pericolose complicanze acute. Pertanto, occorre attenersi a linee guida scritte e condivise da tutta l'equipe e basate su documenti elaborati da centri con grande esperienza sul campo. Le linee guida attualmente utilizzate sono quelle della International Society for Pediatric and Adolescent Diabetes (ISPAD) (10).
Le prime misure da adottare sono quelle di supporto immediato:
- garantire la pervietà delle vie aeree e in caso di obnubilamento del sensorio posizionare un sondino naso-gastrico per evitare le lesioni "ab-ingestis";
- somministrare ossigeno al 100% con maschera facciale in caso di grave compromissione di circolo e shock;
- assicurare un accesso venoso per prelievi ematici, sia in fase diagnostica che in fase di monitoraggio;
- utile il monitoraggio elettrocardiografico che permette, attraverso lo studio dell'onda T, di valutare eventuali iper- o ipokaliemie (14).
Successivamente si passa alla terapia della chetoacidosi, che prevede le seguenti tappe: reidratazione, correzione degli squilibri elettrolitici, terapia insulinica.
È importante predisporre due vie di infusione separate: una per la reidratazione e una per l'insulina, in modo da poter mantenere costante la reidratazione e variare l'infusione di insulina.
La reidratazione ha lo scopo non solo di ripristinare il volume circolante, ma anche di provvedere a migliorare la sensibilità periferica all'insulina, migliorare la funzionalità renale e favorire l'escrezione renale di glucosio, ridurre il livello degli ormoni contro-insulari, favorire la riduzione spontanea della glicemia e concorrere al blocco della chetogenesi. Nelle prime due ore di infusione di liquidi si osserva riduzione della glicemia anche in assenza di terapia insulinica. La reidratazione deve essere lenta e protratta, per 24-48 ore in base alla risposta del paziente, e non deve superare i 4 L/m2/24 ore per il pericoloso rischio di edema cerebrale.
La scelta del tipo di soluzione da utilizzare dipende dal calcolo del sodio corretto (vedi formula sopra):
- se Na+ corretto è < 150 mEq/L, è consigliabile una soluzione normosalina di NaCl allo 0.9%, perchè è in grado di ridurre l'osmolarità relativamente aumentata della DKA e, considerato il rischio di edema cerebrale, il ritorno alla normalità deve essere graduale;
- se il valore di Na+ corretto è > 150 mEq/L, è consigliabile la soluzione di NaCl allo 0.45%.
La velocità di infusione, in entrambi i casi, è di 8 mL/kg/h per le prime 2 ore, 5 mL/kg/h per le successive 24-48 ore (12,13,15).
La seconda fase del trattamento richiede la contemporanea somministrazione di insulina e potassio: mai somministrare insulina senza correggere la kaliemia, in quanto l'azione dell'insulina determina l'ingresso intra-cellulare non solo del glucosio ma anche del potassio e questo comporta una riduzione del potassio circolante a livelli potenzialmente fatali.
L'infusione di potassio deve avvenire alla dose di 0.1-0.2 mEq/kg/h all'inizio della terapia insulinica (16,17), ovvero si pratica aggiungendo alla soluzione fisiologica 40 mEq/L (20 mEq/L di potassio fosfato + 20 mEq/L di potassio cloruro, per evitare l'ipocalcemia da eccesso di fosfato). La velocità di infusione va regolata in base ai valori di potassiemia (17,18) (tab. 4).
| Tabella 4 Schema di somministrazione del potassio |
|
| Potassiemia (mEq/L) | Velocità di infusione del potassio |
| < 3.0 | 30 mEq/h |
| 3.0-4.0 | 20 mEq/h |
| 4.0-5.0 | 10 mEq/h |
| > 5.0 | stop infusione |
La terapia insulinica si avvale attualmente sia di insulina umana che di analoghi rapidi dell'insulina (lispro e aspart), che hanno ottenuto l'indicazione alla somministrazione ev. Non c'è indicazione ad eseguire un bolo iniziale di insulina perchè aumenta il rischio di edema cerebrale (19). La dose raccomandata per la somministrazione ev è di 0.05-0.1 U/kg/h (0.05 U per età < 5 anni). Il monitoraggio della glicemia deve essere molto stretto, in modo tale da poter abbinare all'insulina l'infusione di una soluzione glucosata al 5% quando i valori di glicemia arrivano intorno ai 250 mg/dL (20). Questo atteggiamento è fondamentale per prevenire la più temibile complicanza della terapia sopra descritta, ossia l'edema cerebrale. In caso di impossibilità di praticare la terapia ev, si può procedere con terapia sc alla dose di 0.15 U/kg ogni 2 ore, con monitoraggio della glicemia (21).
| Tabella 5 Protocollo terapeutico della DKA |
||
| Fase | Presidio | Modalità |
| Supporto vitale |
|
|
| Reidratazione |
NaCl 0.9% (per Na+ corretto < 150 mEq/L) NaCl 0.45% (per Na+ corretto > 150 mEq/L) |
|
| K | 0.1-0.2 mEq/kg/h | |
| Insulinizzazione (dopo la seconda ora) |
Insulina |
50 U di insulina + 500 cc di soluzione fisiologica (10 mL = 1 U) con differente velocità di infusione:
|
MONITORAGGIO
A causa dell'elevata mortalità e della possibile comparsa di complicanze, il quadro clinico deve essere attentamente monitorato (1):
- ogni ora: parametri vitali, glicemia, bilancio idrico, ECG, sodio, potassio, cloro;
- ogni 2-3 ore: chetonemia fino a negativizzazione;
- ogni 6 ore: emogasanalisi fino a normalizzazione dei parametri;
- ogni 6-8 ore: elettroliti (più spesso se necessario).
COMPLICANZE DELLA TERAPIA DELLA DKA: EDEMA CEREBRALE
Ha incidenza dello 0.5-0.9% di tutte le DKA (20), ma elevata mortalità, pari al 21-24% dei casi (22).
In genere si manifesta precocemente, entro le prime 6-8 ore dall'esordio, ma è possibile anche a distanza di 20-25 ore (23).
La sintomatologia è caratterizzata da cefalea, vomito a getto, irritabilità, agitazione, incontinenza, aumento della pressione arteriosa. La diagnosi è certa in presenza di anomala risposta verbale o motoria al dolore, posture da decorticazione o decerebrazione (flessione e adduzione degli arti superiori con estensione degli arti inferiori intra-ruotati nel primo caso, estensione con rotazione interna sia degli arti superiori che inferiori nel secondo caso); paralisi dei nervi cranici (soprattutto III, IV e VI), pattern respiratori neurogeni (Cheyne-Stokes, tachipnea). Devono essere considerati sintomi d'allarme vomito, sonnolenza, cefalea, aumento della pressione diastolica, accompagnati da fluttuazione del livello di coscienza e incontinenza sfinterica (1,20).
L'edema cerebrale è da considerare un'emergenza assoluta e deve essere trattato tempestivamente, con la somministrazione di mannitolo 1 g/kg ev in 20 minuti. Inoltre occorre dimezzare la velocità di infusione delle soluzioni reidratanti, sollevare la testata del letto ed eventualmente procedere a intubazione. Un fattore di rischio per l'insorgenza dell'edema cerebrale è la somministrazione di bicarbonati, il cui uso non è consigliabile di routine. L'ISPAD consiglia l'uso dei bicarbonati, alla dose di 1 mL/kg (1-2 mmol/kg) in 2-3 ore, esclusivamente nei seguenti casi (1):
- pH < 6.9;
- HCO3- < 5 mEq/L;
- shock grave con deficit di contrattilità miocardica.
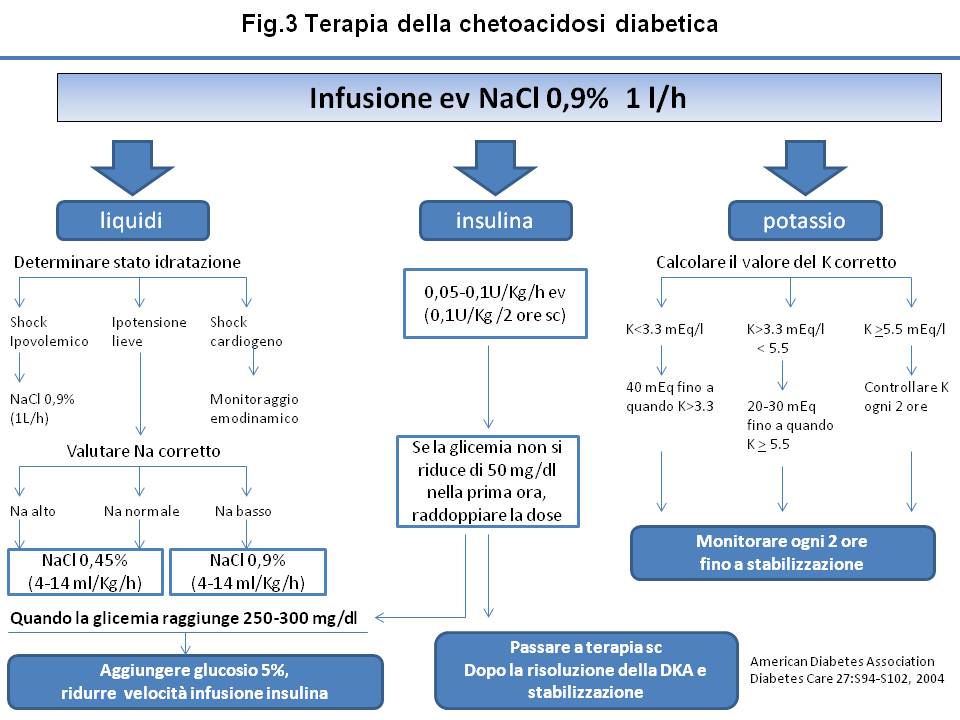
BIBLIOGRAFIA
- Swift PG. International Society of Pediatric and Adolescent Diabetes. ISPAD Clinical practice consensus guidelines 2006-2007. Diabetes education. Pediatr Diabetes 2007, 8: 103-9.
- Chase HP, Garg SK, Jelley DH. Diabetic ketoacidosis in children and the role of outpatient management. Pediatr Rev 1990, 11: 297–304.
- Laffel L. Sick-day management in type 1 diabetes. Endocrinol Metab Clin North Am 2000, 29: 707-23.
- Pinhas-Hamiel O,Dolan LM, Zeitler PS. Diabetic ketoacidosis among obese African-American adolescents with NIDDM. Diabetes Care 1997: 20: 484–6.
- Zdravkovic V, Daneman D, Hamilton J. Presentation and course of type 2 diabetes in youth in a large multi-ethnic city. Diabet Med 2004, 21: 1144–8.
- Rewers A, Chase HP, MaCKenzie T, et al. Predictors of acute complications in children with type 1 diabetes. JAMA 2002, 287: 2511–8.
- Laffel L. Ketone bodies: a review of physiology, pathophysiology and application of monitoring to diabetes. Diabetes Metab Res Rev 1999, 15: 412-26.
- Powers AC. Diabetes mellitus. In: Kasper DL, Braunwald E, Fauci AS, et al (Eds). Harrison's Principles of Internal Medicine (16th ed.). McGraw-Hill, New York NY: pp 2152-80.
- Morris AD, Boyle DI, McMahon AD, et al. Adherence to insulin treatment, glycaemic control, and ketoacidosis, in insulin-dependent diabetes mellitus. Lancet 1997: 350: 1505–10.
- Wolfsdorf J, Craig ME, Daneman D, et al. Diabetic ketoacidosis in children and adolescents with diabetes. Pediatric Diabetes 2009: 10 (Suppl 12): 118–133.
- Casagranda I, Davio P. Alterazioni idroelettrolitiche. In: Manuale di Medicina d’Urgenza. Mc Graw-Hill, Milano 2002.
- American Diabetes Association. Standards of medical care in diabetes-2014. Diabetes Care 2014, 37 (suppl 1): S14-80.
- AMD-SID. Standard Italiani per la cura del diabete mellito. 2014.
- Malone JI, Brodsky SJ. The value of electrocardiogram monitoring in diabetic ketoacidosis. Diabetes Care 1980, 3: 543–7.
- Harris GD, Fiordalisi I. Physiologic management of diabetic ketoacidemia. A 5-year prospective pediatric experience in 231 episodes. Arch Pediatr Adolesc Med 1994, 148: 1046–52.
- Nabarro JD, Spencer AG, Stowers JM. Treatment of diabetic ketosis. Lancet 1952, 1: 983–9.
- Rosenbloom AL, Hanas R. Diabetic chetoacidosis (DKA): treatment guidelines. Clin Pediatr (Phila) 1996, 35: 261-6.
- Rosenbloom AL. The management of diabetic chetoacidosis in children. Diabetes Ther 2010, 1: 103-20.
- Lindsay R. Bolte RG. The use of an insulin bolus in low-dose insulin infusion for pediatric diabetic ketoacidosis. Pediatr Emerg Care 1989, 5: 77-9.
- Dunger DB, et al. ESPE/LWPES consensus statement on diabetic ketoacidosis in children and adolescents. Arch Dis Child 2004, 89: 189-94.
- Manna T, Steinmetz L, Campos PR, et al. Subcutaneous use of a fast-acting insulin analog: an alternative treatment for pediatric patients with diabetic ketoacidosis. Diabetes Care 2005, 28: 1856–61.
- Edge JA, Ford-Adams ME, Dunger DB. Causes of death in children with insulin-dependent diabetes 1990–96. Arch Dis Child 1999, 81: 318–23.
- Glaser N, et al. Risk factors for cerebral edema in children with diabetic ketoacidosis. The Pediatric Emergency Medicine collaborative Research Committee of the American Academy of Pediatrics. N Engl J Med 2001, 344: 264-9.
- Bello FA, Sotos JF. Cerebral oedema in diabetic ketoacidosis in children. Lancet 1990, 336: 64.
Coma iperosmolare
Daniele Barbaro
Endocrinologia, Livorno
EPIDEMIOLOGIA E PATOGENESI
Il coma iperosmolare si verifica per lo più in pazienti di mezza età o anziani con diabete tipo 2 spesso misconosciuto.
È caratterizzato da grave iperglicemia e iperosmolarità ma non chetosi. È classicamente preceduto da un periodo di intensa poliuria e polidipsia e spesso questi malati per dissetarsi bevono bevande zuccherine. In alcuni casi può essere precipitato da un ridotto apporto di liquidi in pazienti anziani soli o costretti a letto.
L’iperglicemia severa è legata a un deficit parziale ma importante di insulina, l’iperglicemia determina poliuria e disidratazione, la quale attiva la secrezione degli ormoni contro-insulari. In caso di difficoltà di apporto idrico o per perdita di liquidi, a seguito ad esempio di un trattamento diuretico, si innesca un circolo vizioso, che conduce a insufficienza renale e incapacità di escrezione renale di glucosio, con conseguente peggioramento progressivo dell’iperglicemia. L’assenza di chetosi si pensa sia dovuta al fatto che vi è comunque una certa quantità di insulina in grado di inibire la lipolisi da parte del tessuto adiposo; l’assenza di chetosi, inoltre, può contribuire a rendere il quadro meno sintomatico e più insidioso.
Esistono di solito situazioni precipitanti: malattie intercorrenti, severe e acute, o farmaci tra cui appunto diuretici, ma anche glucocorticoidi e anti-psicotici.
La mortalità è elevata: intorno al 50% nelle casistiche più vecchie e ancora intorno al 10-15% anche in centri con adeguata esperienza.
DIAGNOSI
La diagnosi di coma iperosmolare non è difficile, ma implica esami di laboratorio. L’utilizzo di un reflettometro mostrerà un valore più elevato del limite superiore, ma la diagnosi andrà confortata con una valutazione precisa della glicemia: questa è per definizione > 600 mg/dL, solitamente > 800 mg/dL (e spesso anche > 1000-1200 mg/dL). Vi è inoltre assenza di acidosi: pH > 7.30 e bicarbonati > 18 mEq/L. I chetoni serici e urinari sono assenti o in scarsa quantità (la tabella riporta i principali aspetti di diagnosi differenziale rispetto al coma chetoacidosico).
| Criteri diagnostici nella chetoacidosi diabetica e nella sindrome iperosmolare | ||||
| Criteri diagnostici | Chetoacidosi | Sindrome iperglicemica iperosmolare | ||
| Lieve | Moderata | Severa | ||
| Glucosio plasmatico (mg/dL) | > 250 | > 250 | > 250 | > 600 |
| pH arterioso | 7.25-7.30 | 7.00-7.24 | < 7.00 | > 7.30 |
| Bicarbonato sierico (mEq/L) | 15-18 | 10-15 | < 10 | > 18 |
| Chetoni urinari | Positivi | Positivi | Positivi | Bassi |
| Chetoni sierici | Positivi | Positivi | Positivi | Bassi |
| Osmolarità sierica | Variabile | Variabile | Variabile | > 320 |
| Anion gap | > 10 | > 12 | > 12 | Variabile |
| Stato mentale | Vigile | Vigile/ sonnolenza | Coma | Variabile |
| Deficit tipici | ||||
| Acqua totale (L) | 6 | 9 | ||
| Acqua (mL/kg) | 100 | 100-200 | ||
| Na+ (mEq/kg) | 7-10 | 5-13 | ||
| Cl– (mEq/kg) | 3-5 | 5-15 | ||
| K+ (mEq/kg) | 3-5 | 4-6 | ||
| PO4 (mmol/kg) | 5-7 | 3-7 | ||
| Mg++ (mEq/kg) | 1-2 | 1-2 | ||
| Ca++ (mEq/kg) | 1-2 | 1-2 | ||
In realtà, in un terzo dei casi vi può essere un quadro misto, con sovrapposizione di chetoacidosi e pertanto sarà comunque opportuno eseguire emogasanalisi.
È fondamentale l’esclusione di altre patologie importanti che possono essere state la causa scatenante e che possono anche essere causa di disturbo di coscienza.
Dal punto di vista clinico, la marcata disidratazione rappresenta l’elemento fondamentale, accompagnata da ipotensione e tachicardia in assenza dei segni clinici di acidosi (non ci sono respiro di Kussmaul e alito acetonemico). Possono essere presenti crisi convulsive, più spesso parziali. Possono esserci segni o sintomi della concomitante patologia, ma anche in caso di infezione sottostante la febbre può essere assente.
TERAPIA
La terapia si basa sui vari presupposti fisiopatologici fondamentali e sull’attento monitoraggio di sodio, potassio, quadro ECG e compenso emodinamico.
1. Reintegro dei liquidi
I malati con coma iperosmolare possono avere un deficit idrico anche di 8-10 litri e il reintegro di essi produce non solo un ripristino delle condizioni emodinamiche e dunque anche della funzione renale, ma anche una progressiva riduzione di ormoni contro-insulari stimolati dalla contrazione del volume plasmatico.
L’inizio dell’idratazione con soluzione salina fisiologica è preferibile alla soluzione ipotonica e la prima fase del trattamento viene eseguita con 1-2 litri nell’arco di due ore. L’infusione deve ovviamente proseguire, seppur a ritmo più lento (4-14 mL/kg/h) in base allo stato di disidratazione. A questo punto, si calcola la sodiemia corretta con la formula:
Na+ corretto = Na+ misurato (mEq/L) + [(glicemia (mg/dL) - 100)/100]
- in caso di sodiemia corretta normale o alta, è opportuno utilizzare soluzioni ipotoniche allo 0.45%;
- se la sodiemia corretta è bassa/ai limiti bassi della norma, si può continuare con la soluzione salina fisiologica.
Quando la glicemia arriva a 250-300 mg/dL, per i motivi specificati dopo, classicamente si inizia ad infondere glucosata al 5%.
L’idratazione riduce di per sé la glicemia, ma il trattamento insulinico rappresenta comunque il secondo caposaldo del trattamento.
2. Terapia insulinica
La schema di trattamento prevede un bolo iniziale di 10 unità di insulina rapida da fare ev, seguito da 5 U/h (sempre ev in bolo o in infusione), con monitoraggio della glicemia ogni ora. Queste dosi di insulina possono essere incrementate o diminuite di un 10-20% in base al peso corporeo del paziente.
In alcuni testi si legge che la somministrazione di insulina dovrebbe essere iniziata dopo 2-3 ore dall’inizio della somministrazione di liquidi, ma personalmente inizio subito al momento dell’inizio dell’infusione.
Bisogna tener presente che se anche si usano gli analoghi ultrarapidi (come ormai è consuetudine), essi hanno una durata di azione fino a 5 ore e dunque con la somministrazione oraria vi è la tendenza ad un accumulo. Questo è il motivo per cui appena la glicemia si avvicina a 250-300 mg/dL vi è un rischio di ipoglicemia e si deve passare a glucosata.
La gestione a questo punto va individualizzata, potendo scegliere fra opzioni diverse: solo glucosata, glucosata più piccoli boli di insulina orari in base alla glicemia, solo glucosata con dentro insulina in quantità tale da metabolizzare il glucosio somministrato (1 unità metabolizza 3 grammi di glucosio). Lo scopo è comunque quello di mantenere la glicemia intorno a 200-250 mg/dL in attesa della piena ripresa della coscienza.
3. Somministrazione di potassio
Il deficit di potassio è solitamente severo e la somministrazione di insulina può determinare ipopotassiemia. Pertanto se la potassiemia è < 3.3 mEq/L, la somministrazione di insulina andrebbe iniziata dopo la correzione dell’ipopotassiemia. L’ECG rappresenta inoltre un metodo importantissimo per monitorare l’apporto potassico dentro la miocellula cardiaca.
4. Altre terapie
Completano lo schema terapeutico l’uso di eparina a basso peso molecolare per il rischio tromboembolico e l’eventuale terapia di supporto.
CONCLUSIONI
Il coma iperosmolare è una condizione severa, gravata da elevata mortalità. Anche in questo caso la prevenzione è di importanza capitale. I punti fondamentali sono cogliere i sintomi che precedono questo tipo di scompenso e/o fare una corretta anamnesi prima di prescrivere farmaci in grado di precipitare il quadro.
BIBLIOGRAFIA
- Kitabchi AE, Murphy MB, Umpierrez GE, Kreisberg R. Hyperglycemic crises in adult patients with diabetes: a consensus statement from the American Diabetes Association. Diabetes Care 2006, 29: 2739-48.
- Kitabchi AE, Nyenwe EA. Hyperglycemic crises in diabetes mellitus: diabetic ketoacidosis and hyperglycemic hyperosmolar state. Endocrinol Metab Clin N Am 2006, 35: 725-51.
- Devangelio E, Bucci I, Napolitano G, Monaco F. Pancreas endocrino. In: Prontuario di terapia endocrina e metabolica. Monaco F ed. SEU, Roma, 2006: 249.
Acidosi lattica
Camillo Giammartino
SC Endocrinologia, Azienda Ospedaliera Terni
Quanto è frequente?
La metformina è senza dubbio uno dei farmaci più utilizzati nella terapia del diabete mellito. È una biguanide con analogie strutturali con la fenformina, ritirata dal mercato nord-americano nel 1976 per la segnalazione di parecchi casi di acidosi lattica. È escreta, immodificata, per via renale e non è nefrotossica. Nel caso della metformina, sono molto controversi i dati relativi al suo ruolo nella comparsa di acidosi lattica. Alcune stime indicano un’incidenza di 3-9 casi/100.000 pazienti/anno (1), mentre alcune casistiche più recenti stimano una incidenza 5-16 volte superiore (2-4). Salpeter (5) dimostra che, nelle condizioni definite nei trials presi in esame in una revisione Cochrane, non vi sono differenze di incidenza di acidosi lattica tra utilizzatori di metformina e utilizzatori di altri ipoglicemizzanti orali. È noto anche che, in percentuali variabili fino al 94% (6), i pazienti ai quali viene prescritta la metformina presentano, in vario grado, controindicazioni al suo utilizzo. In ogni caso, la comparsa di acidosi lattica è ancora gravata da elevata mortalità che può arrivare al 45% (7-8).
Che tipo di alterazione dell'equilibrio acido-base?
L’acidosi lattica viene distinta, secondo la classificazione di Cohen-Woods (9), in:
- tipo A: determinata da ipoperfusione, ipossia o aumentata produzione di lattato;
- tipo B: determinata da gravi alterazioni metaboliche, quali errori congeniti del metabolismo, eccessiva stimolazione adrenergica o avvelenamento.
Nel caso della metformina (MALA - Metformin Associated Lactic Acidosis), l'acidosi lattica può essere di entrambi i tipi, in funzione della condizione che la determina (11). L'alterazione dell'equilibrio acido-base è rappresentata da acidosi metabolica ad elevato gap di anioni (> 12 mEq/L). La misurazione dei livelli di acido lattico indica valori > 5 mmol/L (10).
Quando sospettarla?
L'esordio del quadro clinico può essere relativamente rapido, ma anche insidioso in virtù del progressivo peggioramento delle condizioni cliniche predisponenti.
I sintomi sono: nausea, vomito, dolori addominali, malessere generalizzato, mialgie, irrequietezza, tachipnea, respiro di Kussmaul, insufficienza renale, scompenso cardiaco (11).
Quali sono le condizioni che predispongono alla MALA?
Insufficienza renale, epatopatie con aumento di 2.5-3 volte dei livelli di ALT/GPT (12), gravidanza, insufficienza cardiaca, insufficienza respiratoria, uso di mezzi di contrasto iodato, ogni condizione in grado di determinare ipossia ed ipoperfusione renale (11).
Quale grado di insufficienza renale controindica l'uso della metformina?
In letteratura non vi è concordanza su quale parametro utilizzare: i livelli sierici di creatinina o il tasso stimato di filtrazione glomerulare (eGFR). I livelli sierici di creatinina sono definiti in 1.5 mg/dL (132 µmol/L) per l'uomo e 1.4 mg/dL (123 µmol/L) per la donna. Tali riferimenti vanno considerati poco attendibili e le più recenti linee guida utilizzano come riferimento il tasso stimato di filtrazione glomerulare (eGFR in mL/min/1.73 m2) (13-16), con le seguenti indicazioni:
- ≥ 60: nessuna controindicazione all'uso di metformina;
- 45-60: continua a usare metformina, controlla la funzionalità renale 2-3 volte all'anno;
- 30-45: dimezza la posologia della metformina e controlla la funzionalità renale ogni 3 mesi;
- < 30: la terapia con metformina va sospesa o non prescritta.
Va posta infine attenzione al concomitante uso di farmaci in grado di ridurre la funzionalità renale (FANS, ACE-inibitori, sartani, diuretici) (15).
Esecuzione di esami radiologici con mezzo di contrasto durante terapia con metformina
Diverse linee guida hanno indicato la sospensione della terapia con metformina il giorno dell’esecuzione dell'esame e la ripresa del trattamento dopo 48 ore, previa verifica della normalità dei parametri di funzionalità renale. Una revisione sistematica di tali linee guida indica che, in presenza di normali parametri di funzionalità renale, non vi sono evidenze che giustifichino la sospensione della terapia con metformina, soprattutto se è prevista la esecuzione di esami con "bassa carica" di mezzo di contrasto (TC), rispetto ad esami che utilizzano quantità più elevate (esami angiografici, coronarografie) (17).
Terapia
La terapia della acidosi lattica indotta da metformina è ancora oggetto di controversie.
Infatti, mentre è obbligatoria la correzione delle condizioni che hanno favorito la comparsa dell'acidosi (ipoperfusione tessutale, scompenso cardiaco congestizio, insufficienza renale, ipo-ossigenazione), rimangono ancora controversi l'utilizzo dei bicarbonati e il ruolo della emodialisi.
L'uso dei bicarbonati va gestito con molta accuratezza, perché dosaggi troppo elevati o la troppo rapida correzione dell'acidosi possono portare a peggioramento dell'acidosi o ad alcalosi da "rimbalzo". Tale attenzione va posta in modo particolare nei pazienti che hanno sviluppato arresto cardiaco o grave insufficienza respiratoria. L'indicazione può essere quella di somministrare 1-2 mmol/kg di bicarbonato di sodio in infusione lenta. L'uso del bolo di bicarbonato trova spazio solo per valori di pH molto bassi (< 7.0) nel tentativo di riportare tale valore a 7.1-7.2.
Il ruolo della emodialisi è indicato in alcuni case reports, laddove i valori di pH siano molto bassi e/o i valori di acido lattico molto elevati (18). Viene raccomandata l'emodialisi in bagno di bicarbonato se le condizioni emodinamiche del paziente sono sufficientemente stabili (19); in caso contrario, altri case reports consigliano l'uso dell'emofiltrazione continua, sempre in bagno di bicarbonato (20). Sia l'emodialisi, sia l'emofiltrazione offrirebbero il vantaggio di correggere l'acidosi e rimuovere la metformina, anche se il farmaco presenta un ampio volume di distribuzione e un elevato legame tessutale.
Bibliografia
- Stang MR, Wysowski DK, Butler-Jones D. Incidence of lactic acidosis in metformin users. Diabetes Care 1999, 22: 925-7.
- van Berlo-van de Laar IRF, Vermeij CG, Doorenbos CJ. Metformin associated lactic acidosis: incidence and clinical correlation with metformin serum concentration measurements. J Clin Pharm Therap 2011, 36: 376-82.
- Renda F, Mura P, Finco G, et al. Metformin-associated lactic acidosis requiring hospitalization. A national 10 years survey and a sistematic literature review. Eur Rev Med Pharmacol Sci 2013, 17 (suppl 1): 45-9.
- Kamber N, Davis WA, Bruce DG, Davis TME. Metformin and lactic acidosis in an Australian community setting: the Freemantle Diabetes Study. Med J Aust 2008, 188: 446-9.
- Salpeter SR, Greyber E, Pasternak GA, Salpeter EE. Risk of fatal and nonfatal lactic acidosis with metformin use in type 2 diabetes mellitus. Cochrane Database Syst Rev 2010, 4: CD002967.
- Calabrese AT, Coley KC, DaPos SV, et al. Evaluation of prescribing practices. Risk of lactic acidosis with metformin therapy. Arch Intern Med 2002, 162: 434-7.
- Lalau JD, Race JM. Lactic acidosis in metformin-treated patients. Drug Saf 1999, 20: 377-84.
- Misbin RI, Lanh Green R, Stadel BV, et al. Lactic acidosis in patients with diabetes treated with metformin. N Engl J Med 1998, 338: 265-6.
- Woods HK, Cohen R. Clinical and biochemical aspects of lactic acidosis. 1st Ed. Oxford Blackwell Scientific, 1976.
- Liamis G, Milionis HJ, Elisaf M. Pharmacologically-induced metabolic acidosis. Drug Saf 2010, 33: 371-91.
- Kopec KT, Kowalski MJ. Metformin-Associated Lactic Acidosis (MALA): case files of the Einstein Center Medical Toxicology Fellowship. J Med Toxicol 2013, 9: 61-6.
- Riethof M, Flavin PL, Lindavall B, et al. Institute for Clinical Systems Improvement. Diagnosis and management of type 2 diabetes mellitus in adults. Updated april 2012.
- Lipska KJ, Bailey CJ, Inzucchi SE. Use of metformin in the setting of mil-to-moderate renal insufficiency. Diabetes Care 2011, 34: 1431-7.
- Abrahamson MJ, Barzilay JI, Blonde L, et al. AACE Comprehensive diabetes management algorithm 2013. Endocr Pract 2013, 19: 327-36.
- Canadian Diabetes Association Clinical Practice Guidelines Expert Committee. Canadian Diabetes Association 2013 Clinical Practice Guidelines for the Prevention and Management of Diabetes in Canada. Can J Diabetes 2013, 37 suppl 1: S1-212.
- Associazione Medici Diabetologi-Società Italiana di Diabetologia. Standard Italiani per la cura del diabete mellito. 2014.
- Georgen SK, Rumbold G, Compton G, Harris C. Systematic review of current guidelines and their evidence base, on risk of lactic acidosis after administration of contrast medium for patients receiving metformin. Radiology 2010, 254: 261-9.
- Androguè HJ, Madias NE. Management of life-threatening acid-base disorders. N Engl J Med 1998, 338: 26-34.
- Akoglu H, Akan B, Piskinpasa S, et al. Metformin-associated lactic acidosis treated with prolonged hemodialysis. Am J Emerg Med 2011, 29: 575.e3-e5.
- Pan LTT, Mac Laren G. Continuous venovenous haemodiafiltration for metformin-induced lactic acidosis. Anaesth Intensive Care 2009, 37: 830-2.
Complicanze croniche del diabete
Overview sulle complicanze croniche del diabete
Giorgio Borretta
Endocrinologia, AO S Croce e Carle, Cuneo
(aggiornato al 7 gennaio 2020)
Le complicanze croniche del diabete costituiscono la principale causa di morbilità e mortalità nei pazienti diabetici. Esse comprendono la malattia cardio-vascolare, anche definita macro-angiopatia diabetica, e le classiche complicanze micro-vascolari, quali nefropatia, retinopatia e neuropatia diabetiche. Tra le complicanze croniche del diabete vanno annoverate anche la disfunzione erettile e le complicanze del piede, che riconoscono una patogenesi mista, su base vasculopatica e neuropatica.
Le conseguenze delle complicanze croniche del diabete in fase avanzata sono altamente invalidanti, con pesanti conseguenze anche in termini di economia socio-sanitaria. Inoltre, in molti casi, i sintomi correlati alle complicanze si manifestano tardivamente, limitando così possibilità ed efficacia delle cure. Di conseguenza, le misure di prevenzione e lo screening per la diagnosi precoce delle complicanze croniche del diabete rivestono un ruolo di assoluta e primaria importanza. L’ottimizzazione del compenso glicemico e il controllo dei principali fattori di rischio “modificabili”, come l’ipertensione arteriosa, l'obesità, le dislipidemie e il fumo, consentono di ridurre significativamente il rischio di sviluppare le principali complicanze del diabete e di rallentarne la progressione verso gli stadi più avanzati e invalidanti. Nel contempo, l’applicazione su vasta scala dello screening, con indagini per lo più poco costose, facilmente accessibili e da effettuare periodicamente in tutti i pazienti diabetici, permette di riconoscere precocemente le alterazioni subcliniche delle complicanze diabetiche in fase iniziale. La diagnosi precoce consente in primo luogo di rafforzare le misure per il controllo ottimale dei fattori di rischio e, in secondo luogo, di mettere in atto gli interventi terapeutici che, a secondo del tipo di complicanze, si sono dimostrati efficaci nell’arrestare o perlomeno nel ritardare la progressione delle stesse complicanze, con guadagno significativo in termini di salute, qualità di vita e di economia socio-sanitaria.
Infine, come dimostrato da recenti trial di intervento, anche il trattamento con nuovi farmaci euglicemizzanti è in grado di ritardare o ridurre l’incidenza di complicanze croniche micro- e macro-vascolari.
Tuttavia, come evidenziato in recenti survey nazionali e internazionali, pur con differenze da paese a paese, la percentuale di pazienti diabetici sottoposti con regolarità allo screening precoce delle complicanze croniche del diabete risulta ancora largamente inadeguata. Si rende quindi necessario, come sottolineato dalle società scientifiche del settore, uno sforzo aggiuntivo per estendere le misure di intervento efficaci nel ridurre incidenza e gravità delle complicanze croniche del diabete e i costi ad esse correlate, anche mediante il ricorso a nuove tecnologie, come la tele-medicina.
Le principali linee guida nazionali e internazionali (1,2) aggiornano periodicamente, sulla base delle migliori e più recenti evidenze scientifiche, le raccomandazioni per un'appropriata gestione clinica del diabete e delle sue complicanze. Lo screening e il trattamento delle complicanze croniche del diabete sono trattati approfonditamente in appositi capitoli redatti da autori di consolidata esperienza nell’assistenza al paziente diabetico.
Bibliografia
- AMD-SID. Standard italiani per la cura del diabete mellito. 2018.
- Diabetes Care in the Hospital. Standard of Medical Care in Diabetes - 2020. Diabetes Care 2020, 43 suppl 1.

