Aggiornamenti ipertiroidismo
In attesa degli aggiornamenti di Endowiki, si possono trovare articoli aggiornati ai seguenti link:
- Linee guida ETA 2018 sulla gestione della disfunzione tiroidea associata ad amiodarone. Breaking News 16/2018.
- Falsa diagnosi di ipertiroidismo in corso di assunzione di integratori. AME Breaking News 15/2017
- Nuove linee guida ATA: diagnosi e trattamento delle tireopatie in gravidanza e nel post-partum. AME Breaking News n 1-1/1-2/2017.
- Il morbo di Basedow in gravidanza. AME Flash n 2/2017.
- Linee guida ATA 2016: diagnosi e trattamento ipertirodismo e altre cause di tireotossicosi. AME Flash 16/2016, parte 1, parte 2, parte 3
- Tireostatici a bassa dose prolungata nell'ipertiroidismo. AME News 22/2016
- Agranulocitosi da tireostatici. AME News n 63/2016
- Opzioni terapeutiche nel Basedow in età pediatrica. AME News n 70/2016
Patogenesi dell'orbitopatia di Graves
Maria Grazia Deiana, Silvia Caprioli, Vincenzo Toscano, Salvatore Monti
UOC di Endocrinologia – Azienda Ospedaliera S. Andrea, Facoltà di Medicina e Psicologia - “Sapienza” Università di Roma
La patogenesi dell’orbitopatia di Graves (GO), la più frequente manifestazione extra-tiroidea della malattia di Graves (MG), è complessa e non ancora completamente chiarita. La GO è una patologia autoimmunitaria conseguente all’interazione tra suscettibilità genetica, dovuta alla presenza di alcuni geni (HLA, CTLA-4, TCR), e fattori ambientali. I fattori ambientali giocano un ruolo prevalente nello sviluppo della malattia (1). Il fumo di sigaretta, è il più importante fattore ambientale o esogeno ed è associato allo sviluppo e alla gravità della GO e alla ridotta risposta alla terapia. La terapia con il radiodiodio, possibile trattamento dell’ipertiroidismo, può indurre un peggioramento della GO per distruzione delle cellule follicolari tiroidee con rilascio di citochine infiammatorie, attivazione delle cellule T ed aumento del titolo degli anticorpi anti-recettore del TSH (TRAb). Lo stress causa una modificazione della risposta cellulo-mediata da Th1 a Th2, con un’aumentata suscettibilità allo sviluppo di patologie autoimmunitarie.
A livello istologico è presente un infiltrato costituito prevalentemente da linfociti T CD4+ e macrofagi e, in minor misura, da linfociti B e cellule NK. La durata della malattia influenza il tipo di infiltrato linfocitario: nei primi due anni predominano i Th1 e, successivamente, i Th2 (1). Il recettore del TSH (R-TSH) è il principale antigene implicato nella patogenesi dell’orbitopatia ed è stata evidenziata una correlazione tra l’espressione del R-TSH orbitario e la gravità della GO. Livelli maggiori di R-TSH sono stati riscontrati in pazienti con MG e orbitopatia rispetto a quelli con MG senza orbitopatia; l’espressione maggiore di R-TSH si osserva nelle forme attive di GO (1). Altri antigeni (tireoglobulina, TPO, diversi antigeni dei muscoli oculari) potrebbero essere implicati, ma il loro ruolo non è ancora chiaro.
I fibroblasti orbitari rappresentano il bersaglio principale del processo autoimmunitario, andando incontro alla perdita della loro normale funzione. Nel tessuto orbitario si distinguono fibroblasti che esprimono la glicoproteina Thy1 (Thy1+) e fibroblasti che non la esprimono (Thy1-). I Thy1+ se esposti a IFNγ e TNFα, citochine prodotte dal linfociti Th1, producono glicosaminoglicani (GAG) che si accumulano nel perimisio dei muscoli extra-oculari e, richiamando acqua, causano edema ed aumento del volume muscolare (2). I fibroblasti Thy1- (pre-adipociti) esprimono il R-TSH e, per effetto dei TRAb, si differenziano in adipociti maturi con incremento del tessuto adiposo orbitario e aumento dell’espressione del R-TSH (2). I linfociti T sono richiamati nell’orbita dalla produzione di diverse chemochine; l’IFNγ stimola il rilascio di CXCL10, una chemochina prodotta dai fibroblasti orbitari che favorisce la migrazione dei Th1. La produzione di CXCL10 è elevata nelle fasi attive di malattia e si riduce con la durata della malattia quando prevale la risposta Th2 (3). Inoltre, l’iperespressione e l’attivazione di IGF1-R causa il rilascio di IL-16 e della chemochina RANTES, che richiamano le cellule T attivate e altre cellule mononucleate nell’orbita, perpetuando il processo infiammatorio. La produzione di TGFβ causa il differenziamento dei Thy1+ in miofibroblasti, che partecipano alla fibrosi tipica delle fasi tardive della malattia (2). Nella GO il prevalente coinvolgimento del tessuto muscolare o adiposo nell’orbita dipende dalla proporzione di fibroblasti Thy1+ e Thy1- presenti nell’orbita (4).
I segni e i sintomi dell’orbitopatia sono determinati dalla reazione autoimmunitaria ed infiammatoria, responsabile dell’aumento del volume dei tessuti retro-orbitari, che si svolge nell’ambito di una struttura anatomica rigida: la cavità orbitaria. L’aumento del volume dei muscoli extra-oculari e del tessuto adiposo orbitario è responsabile dell’insorgenza dell’esoftalmo, che a sua volta può contribuire alla retrazione palpebrale. Tale retrazione palpebrale può causare la mancata chiusura della rima palpebrale, con esposizione della cornea e possibile danno corneale, prevalentemente in presenza di lagoftalmo. L’edema e l’eritema della palpebra, l’iperemia e la chemosi congiuntivale sono causate dall’estensione del processo infiammatorio nella regione anteriore dell’occhio e dalla congestione venosa da ostacolato deflusso venoso e linfatico, secondario all’incremento della pressione. L’ispessimento dei muscoli extra-oculari e la fibrosi sono, infine, responsabili della diplopia. In casi molti gravi l’ispessimento dei muscoli orbitari può causare compressione del nervo ottico con perdita del visus, un quadro denominato neuropatia ottica distiroidea (5). In alternativa, è possibile che la proptosi sia tale da determinare uno stiramento del nervo ottico.
Bibliografia
- Prabhakar BS, Bahn RS, Smith TJ. Perspective on the Pathogenesis of Graves’ Disease and Ophthalmopathy. Endocr Rev 2003, 24: 802-35.
- Bahn RS. Graves’ Ophthalmopathy. N Engl J Med 2010, 362: 726-38.
- Antonelli A, Rotondi M, Ferrari SM, et al. Interferon-gamma-inducible alpha-chemokine CXCL10 involvement in Graves' ophthalmopathy: modulation by peroxisome proliferator-activated receptor-gamma agonists. J Clin Endocrinol Metab 2006, 91: 614-20.
- Smith TJ, Koumas L, Gagnon A, et al. Orbital fibroblast heterogeneity may determine the clinical presentation of thyroid associated ophthalmopathy. J Clin Endocrinol Metab 2002, 87: 385-92.
- Bartalena L, Marcocci C, Bogazzi F, et al. Relation between therapy for hyperthyroidism and the course of Graves' ophthalmopathy. N Engl J Med 1998, 338: 73-8.
Quadri clinici e classificazioni dell'orbitopatia di Graves
Alfonsina Chiefari, Silvia Caprioli, Vincenzo Toscano, Salvatore Monti
UOC di Endocrinologia – Azienda Ospedaliera S. Andrea, Facoltà di Medicina e Psicologia -“Sapienza” Università di Roma
Definizione
L’oftalmopatia tiroidea è il complesso di manifestazioni oculari clinicamente evidenti in circa il 50% dei pazienti con malattia di Graves, che possono interessare, anche se con una frequenza minore, pazienti con tiroidite cronica autoimmune o manifestarsi in condizioni di eutiroidismo (1).
L’oftalmopatia generalmente associata alla malattia di Graves è conosciuta con nomi diversi, che fanno riferimento alle caratteristiche cliniche, alla relazione con la malattia di Graves o anche solo alla relazione con la patologia tiroidea. Le numerose definizioni indicano che l’eziopatogenesi di questa condizione tuttora non risulta completamente chiarita e che la malattia presenta diverse manifestazioni cliniche, spesso lievi, ma non raramente gravi ed invalidanti, tanto da comportare profonde alterazioni della qualità della vita e della funzione visiva. Recentemente è stata introdotta la denominazione di “Orbitopatia di Graves” (OG), con la quale viene messo in risalto che molte delle alterazioni patologiche coinvolgono il contenuto dell’orbita piuttosto che il solo globo oculare.
Epidemiologia
La prevalenza è dell’1% nella popolazione generale. È clinicamente manifesta nel 30-50% dei pazienti con malattia di Graves, ma alterazioni subcliniche sono dimostrabili nella maggior parte di essi mediante metodiche di imaging (TC o RMN) o attraverso la misura della pressione intra-oculare. L’incidenza stimata nella popolazione generale è di 16/100.000 per anno per le donne e 3/100.000 per gli uomini, ma negli ultimi anni si è osservato un declino. L’incidenza ha una distribuzione bimodale, con due picchi localizzati nella quinta e settima decade di vita, con età di insorgenza leggermente più alta nei soggetti di sesso maschile, in cui si registra anche una maggiore frequenza di orbitopatia di grado severo così come nei pazienti di età avanzata, mentre i casi pediatrici sono in genere lievi.
Sintomi e segni
Il sintomo più comune all’inizio della malattia è il cambiamento nell’aspetto dovuto alla retrazione palpebrale, con o senza proptosi o edema peri-orbitario. Proprio tale percezione si accompagna spesso ad importanti conseguenze sul piano psicologico e relazionale. Altri sintomi comuni dipendono dalla comparsa dei segni di interessamento dei tessuti molli e dall’irritazione corneale: sensazione di “sabbia negli occhi”, fotofobia e lacrimazione eccessiva (2,3).
La diplopia è meno comune come sintomo iniziale e quando presente viene riferita al risveglio o nelle posizioni estreme di sguardo, accompagnata talora da dolore. Quest’ultimo può essere percepito anche a riposo oltre che nei movimenti oculari. Solo il 5% dei pazienti riferisce disturbi visivi, come riduzione del visus o alterazioni della percezione dei colori. Questi ultimi sono dei potenziali marcatori di neuropatia ottica distiroidea (DON).
| Sintomi | Segni |
| Fotofobia Lacrimazione Senso di corpo estraneo Senso di secchezza Senso di irritazione Senso di oppressione Dolore spontaneo Dolore nei movimenti oculari Diplopia |
Edema palpebrale Iperemia palpebrale Iperemia congiuntivale Chemosi Infiammazione plica e caruncola Retrazione palpebrale Lagoftalmo Proptosi Interessamento corneale Diplopia |
Retrazione palpebrale. Contrariamente ad una diffusa convinzione è questo, e non la proptosi, il segno più frequente dell’orbitopatia di Graves. Lo sguardo fisso con occhi sbarrati, conseguente alla retrazione palpebrale (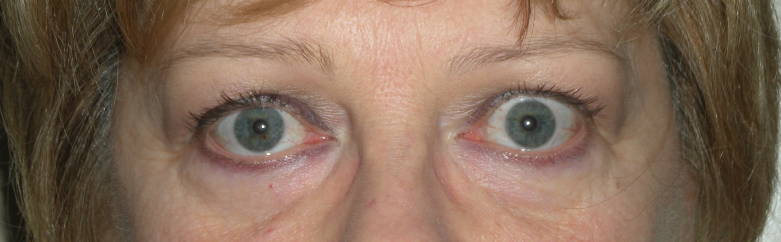 ), è un aspetto comune di presentazione di questi pazienti e interessa soprattutto la palpebra superiore. L’incremento dei livelli circolanti di ormoni tiroidei e l’aumentata attività simpatica sono responsabili in una fase iniziale della retrazione palpebrale (2) che, con il tempo, diviene permanente a causa dell’infiltrazione del muscolo di Muller da parte di linfociti e fibroblasti e dei conseguenti esiti cicatriziali. Nella valutazione della retrazione si tiene conto della posizione delle palpebre in posizione primaria di sguardo. La posizione di entrambe le palpebre viene misurata in riferimento al limbus sclero-corneale, che in condizioni fisiologiche è coperto dalla palpebra superiore e solo lambito marginalmente da quella inferiore. La retrazione viene misurata come valore positivo in mm. Nello schema in alto è rappresentata una retrazione palpebrale monolaterale: è visibile una striscia di bianco della sclera tra il limbus e il margine palpebrale superiore.
), è un aspetto comune di presentazione di questi pazienti e interessa soprattutto la palpebra superiore. L’incremento dei livelli circolanti di ormoni tiroidei e l’aumentata attività simpatica sono responsabili in una fase iniziale della retrazione palpebrale (2) che, con il tempo, diviene permanente a causa dell’infiltrazione del muscolo di Muller da parte di linfociti e fibroblasti e dei conseguenti esiti cicatriziali. Nella valutazione della retrazione si tiene conto della posizione delle palpebre in posizione primaria di sguardo. La posizione di entrambe le palpebre viene misurata in riferimento al limbus sclero-corneale, che in condizioni fisiologiche è coperto dalla palpebra superiore e solo lambito marginalmente da quella inferiore. La retrazione viene misurata come valore positivo in mm. Nello schema in alto è rappresentata una retrazione palpebrale monolaterale: è visibile una striscia di bianco della sclera tra il limbus e il margine palpebrale superiore.
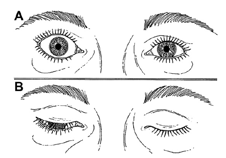
Lagoftalmo (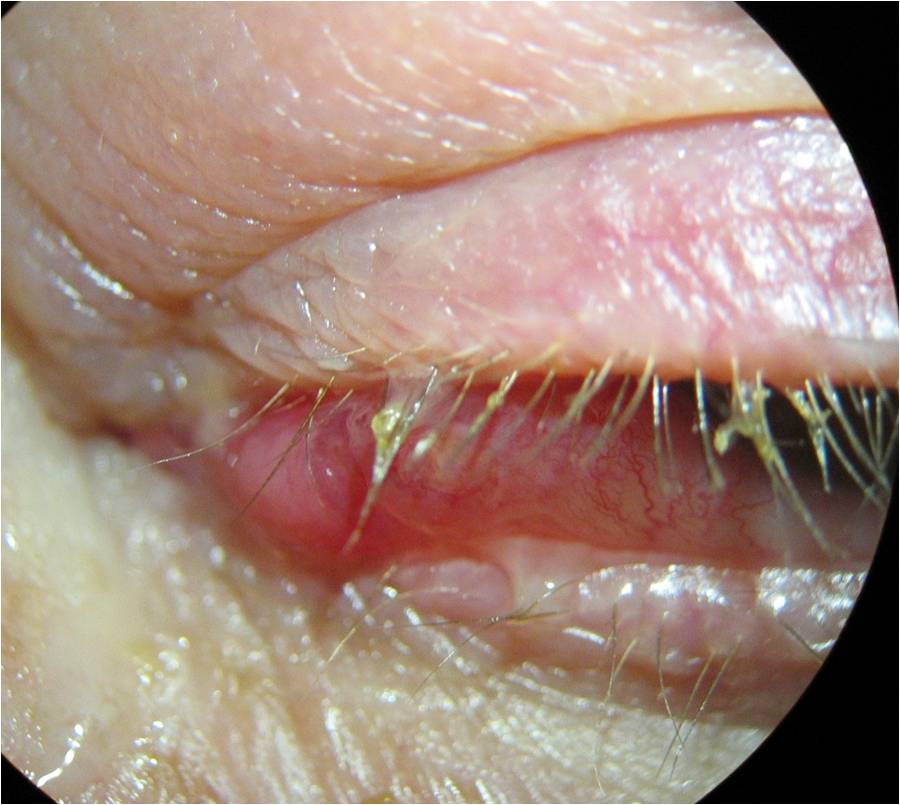 ). È l’incapacità della palpebra di coprire completamente la superficie dell’occhio attraverso la chiusura palpebrale (disegno in basso). Dipende dalla retrazione palpebrale, dalla proptosi e dalla motilità palpebrale. L’eccessiva esposizione corneale che ne deriva contribuisce da un lato ad esacerbare lo stimolo irritativo sull’occhio e dall’altro predispone ad una grave e temibile complicanza che è l’ulcerazione corneale. Il rischio di ulcerazione della cornea è correlato sia al lagoftalmo che all’assenza del riflesso protettivo di Bell (deviazione degli occhi verso l’alto durante il sonno o nella chiusura forzata delle palpebre). Questo non è presente nel 10% dei soggetti sani, ma può anche essere perso nei soggetti con orbitopatia di Graves a causa della limitazione del movimento del muscolo retto inferiore. Il lagoftalmo non è un marcatore di attività clinica, ma è associato ad un maggiore rischio di sequele pericolose per la vista. Vi può anche essere un’assenza o un ritardo nella discesa della palpebra superiore nello sguardo verso il basso (segno di von Graefe).
). È l’incapacità della palpebra di coprire completamente la superficie dell’occhio attraverso la chiusura palpebrale (disegno in basso). Dipende dalla retrazione palpebrale, dalla proptosi e dalla motilità palpebrale. L’eccessiva esposizione corneale che ne deriva contribuisce da un lato ad esacerbare lo stimolo irritativo sull’occhio e dall’altro predispone ad una grave e temibile complicanza che è l’ulcerazione corneale. Il rischio di ulcerazione della cornea è correlato sia al lagoftalmo che all’assenza del riflesso protettivo di Bell (deviazione degli occhi verso l’alto durante il sonno o nella chiusura forzata delle palpebre). Questo non è presente nel 10% dei soggetti sani, ma può anche essere perso nei soggetti con orbitopatia di Graves a causa della limitazione del movimento del muscolo retto inferiore. Il lagoftalmo non è un marcatore di attività clinica, ma è associato ad un maggiore rischio di sequele pericolose per la vista. Vi può anche essere un’assenza o un ritardo nella discesa della palpebra superiore nello sguardo verso il basso (segno di von Graefe).
Altri segni estremamente comuni sono quelli a carico dei tessuti molli. La loro presenza o assenza definisce l’attività della malattia e il grado di coinvolgimento ne descrive la severità.
Edema palpebrale (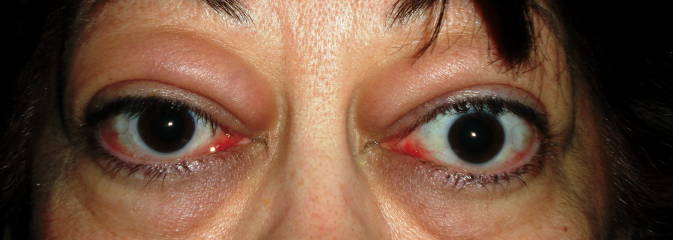 ). Il grado di riempimento del tessuto peri-orbitario varia tra i soggetti sani, in base all’età, alla massa corporea e all’integrità del setto orbitario anteriore. Poiché quest’ultimo si indebolisce con l’età, è comune che vi sia un prolasso del grasso. Per distinguere le due condizioni, bisogna valutare la cute posta tra i cuscinetti di grasso: nel normale processo di invecchiamento questa si presenta rugosa ma non ispessita e i cuscinetti di grasso sono ancora distinguibili.
). Il grado di riempimento del tessuto peri-orbitario varia tra i soggetti sani, in base all’età, alla massa corporea e all’integrità del setto orbitario anteriore. Poiché quest’ultimo si indebolisce con l’età, è comune che vi sia un prolasso del grasso. Per distinguere le due condizioni, bisogna valutare la cute posta tra i cuscinetti di grasso: nel normale processo di invecchiamento questa si presenta rugosa ma non ispessita e i cuscinetti di grasso sono ancora distinguibili.
Iperemia palpebrale (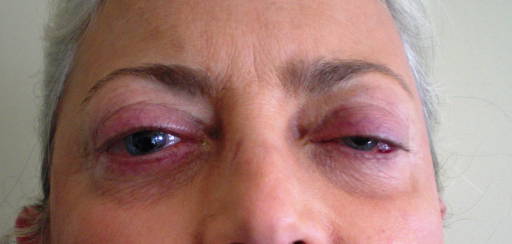 ). L’iperemia palpebrale localizzata può interessare il margine palpebrale, pretarsale (ed essere confusa con la condizione più comune di blefarite) o più comunemente la restante porzione di palpebra definita pre-settale. Nella sua valutazione può essere utile prendere come riferimento il colore della cute del viso.
). L’iperemia palpebrale localizzata può interessare il margine palpebrale, pretarsale (ed essere confusa con la condizione più comune di blefarite) o più comunemente la restante porzione di palpebra definita pre-settale. Nella sua valutazione può essere utile prendere come riferimento il colore della cute del viso.
Iperemia congiuntivale (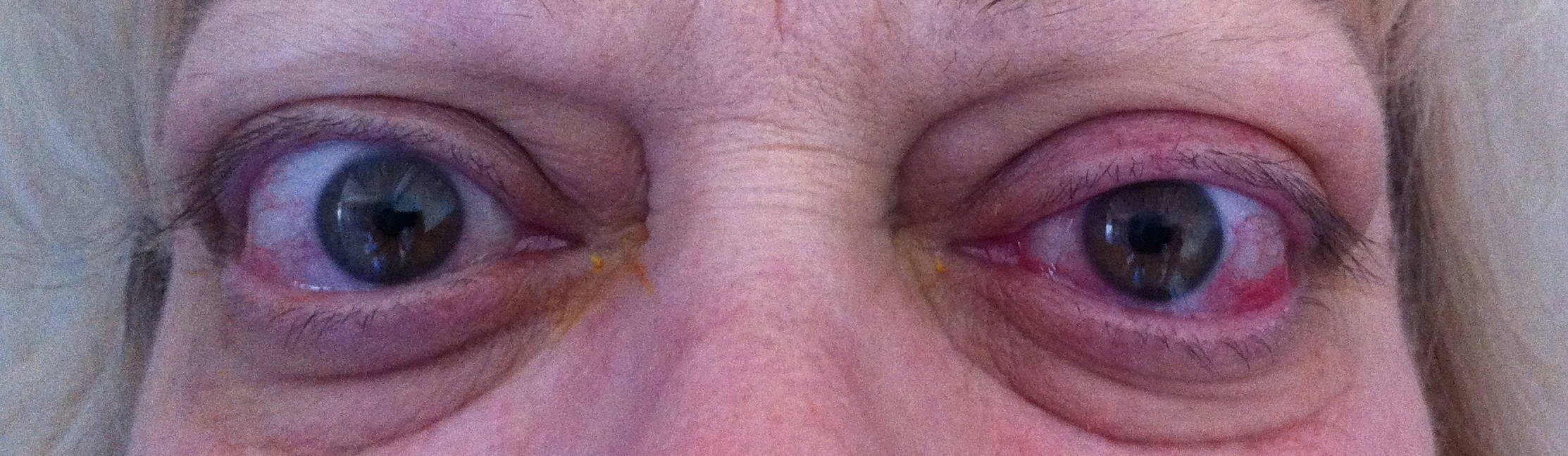 ). Questo segno non dipende soltanto dalla retrazione palpebrale e dall’esposizione della superficie oculare, infatti pazienti in fase non attiva di malattia presentano la sclera bianca anche in presenza di retrazione palpebrale o proptosi marcata. È da mettersi in relazione piuttosto con l’aumento di volume dei tessuti dell’orbita, con conseguente aumento della pressione endo-orbitaria che ostruisce il ritorno venoso.
). Questo segno non dipende soltanto dalla retrazione palpebrale e dall’esposizione della superficie oculare, infatti pazienti in fase non attiva di malattia presentano la sclera bianca anche in presenza di retrazione palpebrale o proptosi marcata. È da mettersi in relazione piuttosto con l’aumento di volume dei tessuti dell’orbita, con conseguente aumento della pressione endo-orbitaria che ostruisce il ritorno venoso.
Chemosi (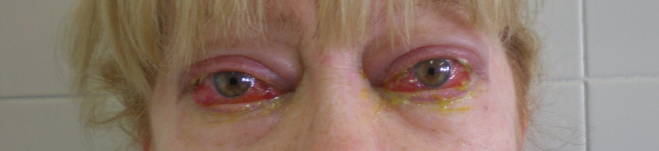 ). Si tratta di una protrusione edematosa della congiuntiva. Gradi minori di chemosi devono essere distinti dalla frequente condizione di congiuntivocalasi, caratterizzata da pieghe ridondanti di congiuntiva che compaiono spesso in età avanzata ai margini palpebrali. La diagnosi differenziale richiede l’utilizzo di una lampada a fessura. La chemosi più grave può essere individuata anche senza questo ausilio, semplicemente spingendo con un dito verso l’alto la palpebra inferiore e osservando lateralmente sulla superficie dell’occhio se il tessuto edematoso viene mobilizzato.
). Si tratta di una protrusione edematosa della congiuntiva. Gradi minori di chemosi devono essere distinti dalla frequente condizione di congiuntivocalasi, caratterizzata da pieghe ridondanti di congiuntiva che compaiono spesso in età avanzata ai margini palpebrali. La diagnosi differenziale richiede l’utilizzo di una lampada a fessura. La chemosi più grave può essere individuata anche senza questo ausilio, semplicemente spingendo con un dito verso l’alto la palpebra inferiore e osservando lateralmente sulla superficie dell’occhio se il tessuto edematoso viene mobilizzato.
Edema della plica e della caruncola (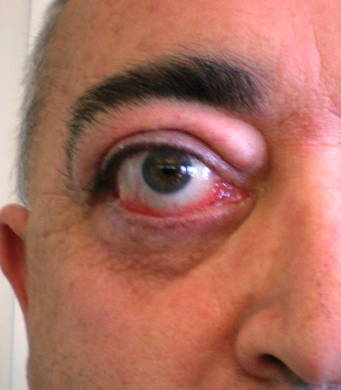 ). La normale posizione della caruncola è variabile ed è influenzata dalla posizione del globo oculare, per cui può apparire più sporgente se è presente proptosi. Bisogna distinguere questa condizione da quella di edema. Inoltre, sebbene la plica e la caruncola abbiano generalmente comportamenti simili, è possibile che una sia infiammata ed edematosa e l’altra no, pertanto dovrebbero essere valutate entrambe separatamente.
). La normale posizione della caruncola è variabile ed è influenzata dalla posizione del globo oculare, per cui può apparire più sporgente se è presente proptosi. Bisogna distinguere questa condizione da quella di edema. Inoltre, sebbene la plica e la caruncola abbiano generalmente comportamenti simili, è possibile che una sia infiammata ed edematosa e l’altra no, pertanto dovrebbero essere valutate entrambe separatamente.
Il metodo comparativo fotografico rimane quello più affidabile per la valutazione dei segni interessanti i tessuti molli.
Lesioni corneali. La rottura della cornea è un fenomeno secondario all’incapacità di proteggere la stessa con la chiusura palpebrale. Gradi lievi di cheratite puntata sono comuni, ma se le palpebre coprono completamente la cornea in questi soggetti non vi è rischio di ulcerazione. Se invece la cornea rimane visibile, la cheratite puntata può rapidamente progredire verso l’ulcerazione e la successiva perforazione.
Pressione intra-oculare. È determinata dalla produzione di umor acqueo dal corpo ciliare, dalla resistenza al drenaggio attraverso il sistema trabecolare e dal livello di pressione nelle vene episclerali. Nei pazienti con OG è comune riscontrare un aumento della pressione intra-oculare di 1-15 mmHg nello sguardo verso l’alto. Questo può essere spiegato da una inelasticità del muscolo retto inferiore fibrotico e dall’incapacità dello stesso di rilasciarsi sul globo quando l’antagonista porta l’occhio verso l’alto, causando compressione e quindi aumento della pressione nelle vene episclerali e congestione orbitaria. Tuttavia, tale aumento della pressione si associa alla comparsa di glaucoma meno frequentemente rispetto al resto della popolazione.
Proptosi. È dovuta alla spinta in avanti del globo oculare. Si può considerare una “auto-decompressione” dell’orbita che è una struttura rigida tranne anteriormente, dove è presente il setto orbitario anteriore. Il grado di proptosi dipende quindi dall’ingrandimento muscolare, dall’eccesso di grasso retro-orbitario, ma anche dall’elasticità del setto. Se rigido, non c’è una proptosi importante, ma in compenso si ha un aumento significativo della pressione intra-orbitaria con compressione del nervo ottico e maggior rischio di DON. Il rischio è minore se il setto è più lasso, in questo caso vi sarà però una proptosi più marcata. Per valutare la proptosi si utilizza l’esoftalmometro di Hertel (figura), un sistema di triangolazione che quantifica la posizione dell’apice corneale. È costituito da una bacchetta graduata per la misurazione della distanza intercantale, cioè la distanza dei canti esterni dei due occhi, detta base, e da due sistemi di specchi a forma di triangolo rettangolo, che, grazie alla riflessione dell’immagine corneale su una scala graduata, permettono di calcolare la sporgenza dell’apice corneale rispetto al bordo orbitario. Viene considerato significativo l’esoftalmo che si discosta di oltre 2 mm dal limite di normalità di 18 mm (dai 14 mm nei bambini).

Esoftalmometro di Hertel
Diplopia e strabismo. Sono conseguenti all’alterazione della motilità del globo oculare a causa dell’infiammazione prima e della fibrosi poi dei muscoli estrinseci. La limitazione è di tipo restrittivo, per cui è impedita la rotazione dell’occhio nella direzione opposta a quella del muscolo coinvolto.
La diplopia può essere valutata sia soggettivamente che oggettivamente. Quella soggettiva viene valutata con uno score (4).
| Score di diplopia soggettivo (Gorman) | |
| Grado I | diplopia intermittente, si manifesta quando il paziente è stanco |
| Grado II | diplopia incostante, si manifesta nelle posizioni estreme di sguardo laterale e verso l’alto |
| Grado III | diplopia costante, presente in posizione primaria di sguardo ma correggibile con il prisma |
| Grado IV | diplopia costante, non correggibile con il prisma |
Orbitopatia attiva o quiescente: clinical activity score. Attraverso una valutazione strettamente clinica è possibile ricavare indicazioni circa la presenza o meno di infiammazione in atto a carico dell’orbita. Il Clinical Activity score è un punteggio numerico ottenuto dalla combinazione di due sintomi e cinque segni di interessamento dei tessuti molli (5). A ciascun elemento viene assegnato un punto sulla base della presenza o assenza dello stesso. Ad un valore uguale o superiore a 3 corrisponde una patologia in fase attiva.
| Clinical activity score (CAS) | |
|
Dolore orbitario spontaneo |
Iperemia delle palpebre |
Tale punteggio nasce dall’esigenza di orientare correttamente la scelta terapeutica nelle diverse fasi di malattia e si è rivelato uno strumento efficace nel predire la risposta al trattamento medico e radioterapico. In presenza di un punteggio alto, l’azione anti-infiammatoria e immunosoppressiva dei suddetti trattamenti si accompagna ad una più elevata probabilità di successo e questo ne giustifica l’impiego nonostante i potenziali effetti avversi. Se il punteggio è basso, verosimilmente la patologia è in una fase di quiescenza e l’unico intervento possibile è di tipo chirurgico (6).
Sebbene indispensabile per una prima valutazione, risulta purtroppo di scarsa utilità nel monitoraggio del paziente nel tempo. Basandosi infatti sul binomio assenza/presenza, solo la scomparsa di un determinato segno o sintomo influisce sul punteggio finale, mentre un miglioramento degli stessi, lieve o importante che sia, lo lascia immodificato (3).
Valutazione della gravità. La severità descrive il grado di deficit funzionale o estetico presente nelle diverse fasi di malattia.
La classificazione NO SPECS è stata introdotta da Werner nel 1969 e, nonostante le successive modifiche (7), rimane di scarsa utilità. I pazienti, infatti, non progrediscono necessariamente da una classe all’altra e ciascun aspetto è poco definito, lasciando spazio alla soggettività e impedendo una comparazione dei dati ai fini di studio. L’acronimo risulta tuttavia un efficace aiuto mnemonico per l’esame clinico dei pazienti.
| NOSPECS | |
| N o symptoms or signs | Classe 0 |
| O nly signs | Classe 1 |
| S oft tissue involvement | Classe 2 |
| P roptosis | Classe 3 |
| E xtraocular muscle involvement | Classe 4 |
| C orneal involvement | Classe 5 |
| S ight loss | Classe 6 |
| Classificazione NO SPECS modificata | ||
| CLASSE | GRADO | |
| 0 | No sintomi e segni | |
| 1 | Solo segni | |
| Coinvolgimento dei tessuti molli | ||
| 2 | 0 | assente |
| a | minimo | |
| b | moderato | |
| c | marcato | |
| Proptosi > 3 mm al limite normale | ||
| 3 | 0 | assente |
| a | 23-24 mm | |
| b | 25-27 mm | |
| c | ≥28 mm | |
| Coinvolgimento dei muscoli extra-oculari in base alla diplopia | ||
| 4 | 0 | assente |
| a | intermittente | |
| b | incostante | |
| c | costante | |
| Coinvolgimento corneale | ||
| 5 | 0 | assente |
| a | cheratite puntata | |
| b | ulcerazione | |
| c | edema, necrosi e perforazione | |
| Perdita della vista dovuta a neuropatia ottica | ||
| 6 | 0 | assente |
| a | pallore papillare, deficit del campo visivo e acuità visiva ridotta max a 3/10 | |
| b | stessi segni e acuità visiva ridotta tra 1/10 e 2/10 | |
| c | stessi segni ma visione < 1/10 fino alla cecità completa | |
Più recentemente nel 2008 l’EUGOGO (European Group of Graves’ Orbitopathy) ha proposto una classificazione sulla base della severità dell’orbitopatia di Graves che prevede 3 gradi: lieve, moderato-severa, con compromissione della vista (8).
Se nella definizione dell’attività di malattia è rilevante la presenza di un coinvolgimento dei tessuti molli, per la valutazione della severità bisogna attribuirgli un grado e tener conto, in associazione a questo, anche di altri parametri, oggettivamente misurabili e quantificabili, quali la retrazione palpebrale, la proptosi, l’interessamento corneale e quello muscolare descritto in termini di diplopia.
| Valutazione EUGOGO della severità | |
| GO lieve |
Retrazione palpebrale < 2 mm |
| GO moderato-severa |
Retrazione palpebrale > 2 mm |
| GO con compromissione della vista |
Neuropatia ottica distiroidea (DON) |
Neuropatia ottica distiroidea (DON). La compromissione del nervo ottico è una manifestazione secondaria di malattia severa e, benché colpisca solo il 3-5% dei pazienti con GO, comporta un rischio considerevole di cecità. Fattori di rischio sono il sesso maschile, l’età avanzata, il diabete ed il fumo.
La gravità di tale condizione non è di immediata evidenza clinica, considerando che in molti casi si accompagna ad un esoftalmo non significativo. Il principale meccanismo di insulto sul nervo è, infatti, l’aumento della pressione in corrispondenza dell’apice orbitario: essa dipende dalla combinazione di due fattori che sono, da un lato l’ingrandimento delle strutture muscolari che vi passano attraverso, e dall’altro l’eccessiva tensione costituzionale del setto orbitario anteriore, che limita la protrusione del globo oculare e la conseguente “auto-decompressione”. Più di rado è il prolasso di grasso nella fessura orbitaria a premere sul nervo ottico. Meno frequentemente è lo stiramento del nervo ottico a comprometterne la funzione: si verifica con l’aumentare del grado di proptosi, che può arrivare nei casi più gravi fino alla sublussazione del bulbo oculare.
Anche un’acuità visiva normale non esclude la diagnosi, che è invece supportata dalla presenza di anomalie nella discriminazione dei colori, edema della papilla, deficit pupillare afferente e deficit del campo visivo: tutti questi reperti devono pertanto essere attentamente ricercati. Il CAS è più di frequente uguale o superiore a 4. La diplopia, pur se molto comune, non è un requisito diagnostico di DON (9). Anche se la diagnosi resta clinica, validi ausili per identificare la DON sono i potenziali evocati visivi e le metodiche di diagnostica per immagini per evidenziare l’apical crowding.
Orbitopatia di Graves monolaterale
L’interessamento orbitario è più spesso bilaterale anche se asimmetrico. La monolateralità riguarda il 5-15% dei casi di orbitopatia tiroide-correlata (1): tale condizione quindi, seppur da considerare come campanello d’allarme nel processo diagnostico differenziale, non esclude la diagnosi di GO. Spesso infatti il coinvolgimento dell’orbita controlaterale è solo subclinico o piuttosto si tratta di uno stadio precoce di malattia con successiva evoluzione bilaterale (10).
Bibliografia
- Putta-Manohar S, Perros P. Epidemiology of Graves' orbitopathy. Pediatr Endocrinol Rev 2010, 7 Suppl 2: 182-5.
- Bartley GB, Fatourechi V, Kadrmas EF, et al. Clinical features of Graves’ ophthalmopathy in an incidence cohort. Am J Ophthalmol 1996, 121: 284-90.
- Dickinson AJ, Perros P. Controversies in the clinical evaluation of active thyroid-associated orbitopathy: use of a detailed protocol with comparative photographs for objective assessment. Clin Endocrinol 2001, 55: 283-303.
- Bahn RS, Gorman CA. Choice of therapy and criteria for assessing treatment outcome in thyroid-associated ophthalmopathy. Endocrinol Metab Clin North Amer 1987, 16: 391-407.
- Pinchera A, Wiersinga W, Glinoer D, et al. Classification of eye changes of Graves’ disease. Thyroid 1992, 2: 235-6.
- Mourits MP, Prummel MF, Wiersinga WM, et al. Clinical activity score as a guide in the management of patients with Graves’ ophthalmopathy. Clin Endocrinol 1997, 47: 9–14.
- Werner SC. Modification of the classification of the eye changes of Graves' disease. Am J Ophthalmol 1977, 83: 725-7.
- Bartalena L, Baldeschi L, Dickinson A, et al. Consensus statement of the European Group on Graves' orbitopathy (EUGOGO) on management of GO. Eur J Endocrinol 2008, 158: 273–85.
- McKeag D, Lane C, Lazarus JH, et al; European Group on Graves' Orbitopathy (EUGOGO). Clinical features of dysthyroid optic neuropathy: a European Group on Graves'Orbitopathy (EUGOGO) survey. Br J Ophthalmol. 2007, 91: 455-8.
- Wiersinga WM, Smit T, van der Gaag R, et al. Clinical presentation of Graves' ophthalmopathy. Ophthalmic Res 1989, 21: 73-82.
Inquadramento diagnostico clinico, biochimico e strumentale dell'orbitopatia di Graves
Alfonsina Chiefari, Silvia Caprioli, Vincenzo Toscano, Salvatore Monti
UOC di Endocrinologia – Azienda Ospedaliera S. Andrea, Facoltà di Medicina e Psicologia - “Sapienza” Università di Roma
La diagnosi di orbitopatia è semplice nei pazienti con ipertiroidismo che presentano esoftalmo bilaterale, ma diventa più insidiosa se non vi è una disfunzione tiroidea di base e le manifestazioni cliniche sono meno evidenti. Nessun segno o sintomo preso singolarmente è specifico di malattia; fortemente indicativi sono la presenza di retrazione palpebrale associata ad esoftalmo e il coinvolgimento della muscolatura oculare estrinseca o del nervo ottico nel contesto di una disfunzione tiroidea pregressa o in atto (1).
| Diagnosi differenziale dell'orbitopatia di Graves |
| Linfoma Neoplasie primitive o metastatiche Tumore delle cavità nasali e dei seni Fistola del seno cavernoso carotideo Pseudotumor orbitae e miosite orbitaria |
Una visita oculistica completa comprende, oltre alla valutazione di segni e sintomi per la definizione del Clinical Activity Score (CAS) e della gravità, l’esoftalmometria, l’esame del campo visivo e del fondo oculare, la misura della pressione oculare e dell’acuità visiva e la valutazione della visione dei colori. La diplopia e le alterazioni della motilità oculare devono essere indagate con una visita ortottica.
Indagini di laboratorio
Nessun test di laboratorio è attualmente in grado di diagnosticare con certezza l’orbitopatia di Graves, ma la funzionalità tiroidea (TSH, FT4 ed FT3 ) e gli anticorpi anti-tiroide (Ab anti-recettore del TSH e Ab anti-TPO) devono essere eseguiti in ogni paziente in cui vi è un sospetto diagnostico. L’orbitopatia si associa infatti nell'85% dei casi ad un ipertiroidismo, ma in una percentuale minore dei casi compare in pazienti con ipotiroidismo da tiroidite cronica autoimmune o in pazienti con funzionalità tiroidea perfettamente nella norma, che svilupperanno o meno una disfunzione tiroidea successivamente (2). In tal caso la correlazione tiroidea dell’orbitopatia è possibile grazie alla positività auto-anticorpale. In particolare, la misura nel siero degli anticorpi anti-recettore del TSH è utile per la diagnosi nei pazienti eutiroidei (3) ed è raccomandata nei casi già diagnosticati in considerazione della correlazione positiva tra i livelli di tali anticorpi e la severità e l’attività della malattia e del loro valore prognostico del corso dell’orbitopatia (4,5).
Valutazione della motilità oculare
La diplopia, quale sintomo cardine di una anomalia oculomotoria, deve essere valutata nelle nove posizioni di sguardo (centrale, ai 4 punti cardinali e alle 4 semidiagonali). L’esame ortottico serve a valutare la presenza di diplopia, ma in alcuni casi molto complessi, le minime ipofunzioni associate non riescono ad essere correttamente evidenziate. A questo scopo si utilizza lo schermo di Hess, detto anche coordimetro di Hess o schermo di Lancaster.
Lo strumento: è costituito da una serie di linee orizzontali e verticali a formare una fitta rete. La distanza di ogni linea sottende un angolo visivo di 5° e vi sono identificati punti di fissazione su linee che si intersecano sottendendo angoli di 5°, 15° e 30°. Detto strumento serve di aiuto nella quantificazione delle variazioni oculomotorie riscontrate con l’esame ortottico.
La tecnica: la valutazione della motilità oculare tramite lo schermo di Hess impiega colori complementari per la dissociazione dei due occhi. Il paziente porta occhiali con filtro colorato diverso per ciascun occhio, in modo che, attraverso queste lenti, un occhio veda i punti di fissazione mentre l’altro vede solamente la luce dell’indicatore. Il paziente deve sovrapporre, in successione, l’indicatore su ciascuno dei punti di fissazione e la posizione relativa dell’indicatore viene registrata sul diagramma separatamente per i 2 occhi, in modo da rappresentare la funzione muscolare dei due occhi nelle varie posizioni di sguardo.
Vantaggi: facile eseguibilità e riproducibilità nel tempo, che permette di monitorare successivamente le variazioni indotte dalla patologia o da un eventuale trattamento.
Limiti: pre-esistenza di eventuali disordini della visione binoculare, in pazienti con patologie oculari che presentano danni a livello del bulbo oculare o uno dei suoi elementi. La presenza di opacità catarattose o di danni retinici impedisce la corretta esecuzione dell’esame; taluni disturbi del visus particolarmente accentuati, possono rendere ineseguibile l’esame, in quanto non permettono al paziente una visualizzazione corretta dello schermo. Pre-esistenti strabismi latenti o manifesti possono, in caso di personale non specializzato, complicare una corretta diagnosi impedendone la formulazione. Deve sempre essere eseguita un’anamnesi specialistica accurata, con lo scopo di evidenziare eventuali strabismi latenti pre-esistenti che la patologia gravesiana ha semplicemente slatentizzato.

Foto superiore: schermo di Hess normale con esatta corrispondenza nelle nove posizioni di sguardo
Foto inferiore: schermo di Hess patologico in paziente affetto da orbitopatia. In occhio destro impossibilità nella depressione
Il campo visivo
Nell’orbitopatia di Graves l’erniazione del grasso orbitario attraverso il forame ottico può provocare sofferenza a livello del nervo ottico. La campimetria è un esame strumentale che permette di valutare la sensibilità luminosa differenziale (sia l’estensione che l’omogeneità) di ogni punto dello spazio percepito dall’occhio fissante un punto fisso.
Lo strumento: è un sistema che associa un computer ad una cupola nella quale vengono proiettati stimoli luminosi con specifiche caratteristiche di luminosità e grandezza.
La tecnica: il paziente, poggiato su una mentoniera in visione monoculare e fissante un unico punto fisso, segnala la percezione dello stimolo luminoso spingendo un pulsante. Il risultato viene stampato in una veste grafica che permette di rilevare la presenza di eventuali aree di sofferenza, dette scotomi, che possono distinguersi in assoluti, nel caso in cui il danno risulti ormai consolidato, e relativi per forme di sofferenza lieve. La moderna perimetria statica automatica, che si distingue dalla precedente definita manuale e dinamica, permette di fornire per ogni punto del campo visivo esaminato un valore di riferimenti detto soglia. La risposta dell’esame è data dalla rappresentazione dei valori soglia in scala colorimetrica o di grigi: tanto più essi sono alterati, maggiormente verranno rappresentati con colori scuri. Altre due mappe permettono infine di comparare l’esame con quello di riferimento considerato normale, permettendo subito di sapere, di quanto e come, l’esame eseguito si discosta dalla normalità. La moderna perimetria permette inoltre di ottenere delle informazioni statistiche, che tramite analisi di regressione lineare attribuiscono valori di significatività alle variazioni rilevate in esami successivi.
Nell’orbitopatia di Graves: danni a livello del nervo ottico si possono manifestare con la presenza di scotomi centrali o paracentrali, che possono associarsi ad acuità visiva normale o a bruschi cali del visus; di difficile riscontro sono invece i deficit perimetrici periferici che non si associato a perdita dell’acuità visiva. L’esecuzione dell’esame perimetrico è quindi sempre indispensabile, anche nelle forme con sintomatologia modesta o nulla a carico del segmento anteriore dell’occhio. L’esame ortottico, di complemento indispensabile alla visita oculistica, che mostri un deficit marcato della muscolatura estrinseca, può preannunciare una sofferenza a livello della porzione intra-orbitaria del nervo ottico. L’esame perimetrico risulta infine indispensabile per la valutazione di eventuali danni indotti dall’ipertono oculare, secondario all’aumento della pressione intra-orbitaria che può provocare danno alla testa del nervo ottico, dando origine a difetti campimetrici patognomonici.
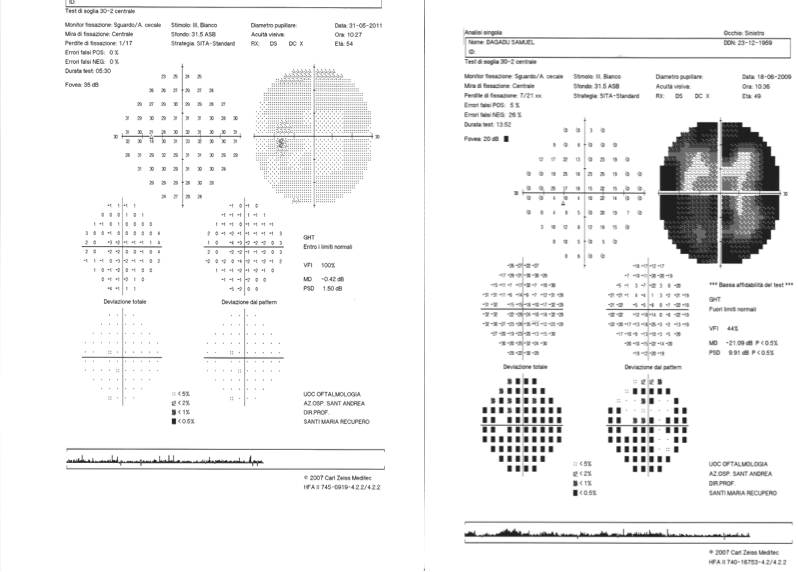
Figura sinistra: campo visivo normale, assenza di deficit della sensibilità; destra: campo visivo gravemente alterato. Ben evidenti le aree scure di sofferenza della sensibilità; in colore nero le aree con perdita assoluta della percezione visiva.
Potenziali evocati visivi
Sono una metodica valida di indagine che permette di analizzare le strutture visive retino-corticali. Essi permettono di studiare l’attività elettrica del cervello umano sano o patologico, registrando le correnti elettriche che vengono generate da uno stimolo luminoso anche di debole intensità. La forma e la latenza del potenziale rilevato, evidenziano alterazioni clinicamente latenti delle vie afferenti e permettono di individuare un difetto sensitivo, quantificandone l’entità. Tale metodica di indagine è utile sia in corso di patologie sistemiche, che coinvolgono il sistema nervoso (quali patologie degenerative acute o croniche), che nelle lesioni focali delle vie sensitive. Per generare un potenziale registrato tramite elettrodi, la stimolazione usata può essere varia.
Lo strumento: Gli occhi vengono studiati separatamente e le onde generate vengono registrate attraverso tre elettrodi, uno posto in sede occipitale, definito attivo, il secondo, detto elettrodo di referenza, che viene collocato sulla fronte ed il terzo, la terra, sul lobo di un orecchio. Lo stimolo può essere rappresentato o da una immagine a barre o a scacchi bianchi o neri (oppure a diverso colore), oppure può essere usato uno stimolo a variazione di luminanza, cioè un flash stroboscopico con la possibilità di modificare l’intensità o la frequenza. I risultati dei PEV sono rappresentati da un tracciato nel quale si possono identificare alcune componenti con polarità negativa (N) o positiva (P), seguite dal valore medio in latenza in ms nella popolazione normale (75-100) e con ampiezza variabile in rapporto all’età del paziente.
L’aumento della latenza della risposta corticale P100 è suggestiva di ritardo di conduzione nel nervo ottico. In caso di neurite o lesione compressiva del nervo ottico, il PEV può anche scomparire. In caso di miglioramento della patologia, si assiste alla comparsa di una risposta, pur se ritardata e di ampiezza ridotta, che progressivamente migliora al migliorare dell’acuità visiva. L’esame e l’evoluzione dell’ampiezza è il parametro che meglio si correla con l’acuità visiva. È inoltre possibile studiare in modo specifico la funzione foveale afferente attraverso le componenti N75 e P100 e le afferenze periferiche con la N105 e P135. Sebbene il PEV sia una risposta corticale, essa riflette lesioni a livelli di tutta la via ottica, potendo identificare le lesioni prechiasmatiche, chiasmatiche e post-chiasmatiche.
Le alterazioni rilevate dei potenziali evocati non devono essere sempre considerate patognomoniche di patologie, ma devono essere sempre correlate al quadro clinico in esame. Nell’orbitopatia di Graves che determina compressione a livello del nervo ottico (prechiasmatica), è presente una risposta occipitale con latenza normale ma con ampiezza patologicamente ridotta.
Diagnostica per immagini
Le metodiche di imaging non sono necessarie per confermare un sospetto diagnostico, soprattutto quando questo è posto sulla base di un'evidenza clinica e avvalorato da appropriate indagini biochimiche.
L’imaging trova indicazione:
- in fase diagnostica, in presenza di un quadro clinico monolaterale o asimmetrico (20% dei pazienti con GO) al fine di escludere altre patologie che, da un punto di vista clinico, possono mimare l’orbitopatia di Graves
- in una fase successiva, qualora la decisione terapeutica possa essere influenzata da informazioni ottenute tramite queste metodiche
- nel sospetto di un coinvolgimento del nervo ottico.
Le tecniche di diagnostica per immagini utilizzate sono principalmente: ecografia orbitaria, TC e RMN.
Ecografia orbitaria. Questa metodica, benché facilmente accessibile sul territorio, dai costi limitati e di semplice esecuzione in mani esperte, presenta dei limiti non indifferenti. Permette, infatti, la visualizzazione solo della porzione anteriore e media dell’orbita, ma non di quella posteriore, sede di potenziale compressione sul nervo ottico. Ha pertanto uno scarso valore nella diagnosi differenziale con le altre lesioni dell’orbita localizzate in profondità (6).
Tomografia computerizzata. La presenza nell’orbita di grasso intra- ed extra-conico agisce come un mezzo di contrasto naturale, che permette un’ottima visualizzazione delle strutture ossee in contrapposizione con i tessuti molli dell’orbita. Per tale motivo l’esame TC viene preferito nella programmazione di un intervento di decompressione orbitaria e nel successivo follow-up post-chirurgico (7). Inoltre, la TC delle orbite è un esame relativamente rapido, che non richiede l’uso di mezzo di contrasto, disponibile su larga scala e dai costi moderati. Bisogna considerare tuttavia l’esposizione del cristallino ad una certa dose di radiazioni, che lo rende un esame poco idoneo a rivalutazioni successive nel tempo, soprattutto in soggetti giovani.
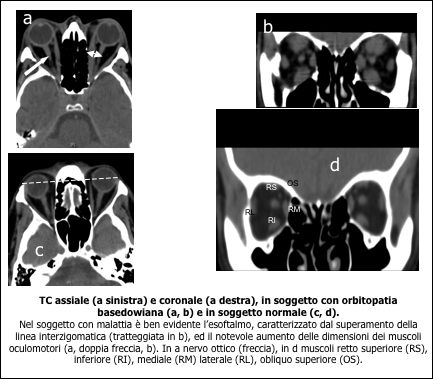
Risonanza magnetica nucleare. Questa tecnica diagnostica è in grado di fornire immagini influenzate dalla densità di protoni contenuti in un tessuto, parametro che aumenta in presenza di edema infiammatorio. Ha il vantaggio, quindi, di fornire informazioni circa l’attività di malattia (8): se infatti sia la TC che l’ecografia individuano un ingrandimento muscolare, nessuna delle due tecniche diagnostiche permette di distinguere se sia di tipo edematoso o fibrotico. La RMN è quindi un utile strumento nei casi in cui la valutazione dell’attività di malattia su base esclusivamente clinica sia dubbia e per predire in tal modo la risposta al trattamento, sia di tipo immuno-soppressivo che radioterapico (9). È un esame che non prevede l’esposizione a radiazioni ionizzanti, ma allo stesso tempo è costoso, con tempi di esecuzione piuttosto lunghi e con una distribuzione limitata sul territorio. Ha inoltre delle limitazioni intrinseche nella metodica per i portatori di dispositivi metallici e i soggetti claustrofobici.
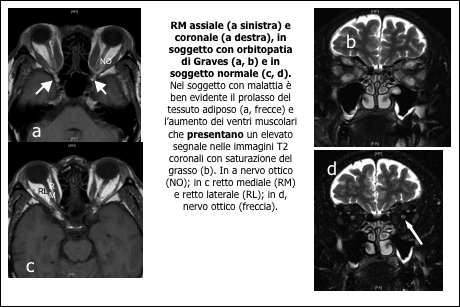
| Reperti suggestivi di orbitopatia di Graves all’esame TC/RMN (6) | |
| Proptosi mono o bilaterale (protrusione del globo oculare oltre la linea inter-zigomatica) Ispessimento fusiforme dei muscoli extra-oculari (coinvolti soprattutto retto inferiore e mediale), con risparmio dell’inserzione muscolare sul globo oculare Incremento del grasso intra- ed extra-conico Compressione del nervo ottico all’apice dell’orbita (crowded orbital apex syndrome) o impressione della lamina papiracea Assenza di lesioni infra-orbitarie occupanti spazio |
|
| Vantaggi e limiti di TC e RM nello studio dell’orbitopatia di Graves | ||
| Vantaggi | Limiti | |
| TC | Larga disponibilità Costo limitato Minore durata dell’esame Buona visualizzazione delle strutture ossee Possibile applicazione in caso di contro-indicazioni alla RM (pacemaker o altri device elettromedicali) |
Mancanza di informazioni sull’attività di malattia Dose radiante (dose media al cristallino 40 mSv/esame) |
| RM |
Non uso di radiazioni ionizzanti |
Limitata nella valutazione delle strutture ossee e calcifiche Tempi di esecuzione più lunghi (20-30 minuti) Controindicazioni (presenza di dispositivi elettronici o corpi estranei di natura metallica, claustrofobia) Costi elevati Minore disponibilità sul territorio |
Apical crowding. Si definisce come una obliterazione dei piani adiposi che circondano il nervo ottico per almeno il 25% della sua circonferenza. È un reperto tipico di Neuropatia Ottica Distiroidea (DON), che può essere valutato all’esame TC e caratterizza insieme ad altri reperti quella definita come “crowded orbital apex syndrome”. Questi sono: l’aumento del diametro dei muscoli extra-oculari, l’appiattimento del nervo ottico all’apice, il prolasso del grasso orbitario nella fessura superiore, la proptosi, l’ingrandimento della vena oftalmica superiore e la dislocazione anteriore della ghiandola lacrimale (10).
Bibliografia
- Bartley GB, Gorman CA. Diagnostic criteria for Graves’ ophthalmopathy. Am J Ophthalmol 1995, 119: 792-5.
- Putta-Manohar S, Perros P. Epidemiology of Graves' orbitopathy. Pediatr Endocrinol Rev 2010, 7 Suppl 2: 182-5.
- Eckstein A, Esser J, Mann K, et al. Clinical value of TSH receptor antibodies measurement in patients with Graves' orbitopathy. Pediatr Endocrinol Rev 2010, 7 Suppl 2: 198-203.
- Gerding MN, et al. Association of thyrotropin receptor autoantibodies with the clinical features of Graves’ ophthalmopathy. Clin Endocrinol 2000, 52: 267–71.
- Eckstein AK, et al. TSH-receptor autoantibodies are independent risk factors for Graves’ ophthalmopathy and help to predict severity and outcome of the disease. J Clin Endocrinol Metab 2006, 91: 3464–70.
- Kahaly GJ. Imaging in thyroid-associated orbitopathy. Eur J Endocrinol 2001, 145: 107–18.
- Kirsch E, Hammer B, von Arx G. Graves' orbitopathy: current imaging procedures. Swiss Med Wkly 2009, 139: 618-23.
- Mayer EJ, Fox DL, Herdman G, et al. Signal intensity, clinical activity and cross-sectional areas on MRI scans in thyroid eye disease. Eur J Radiol 2005, 56: 20-4.
- Kirsch EC, Kaim AH, De Oliveira MG, et al. Correlation of signal intensity ratio on orbital MRI-TIRM and clinical activity score as a possible predictor of therapy response in Graves’ orbitopathy—a pilot study at 1.5 T. Neuroradiology 2010, 52: 91–7.
- Nugent RA, Belkin RI, Neigel JM, et al. Graves’ orbitopathy: correlation of CT and clinical findings. Radiology 1990, 177: 675-82.
Terapia medica dell'orbitopatia di Graves
Sara Nazzarena Morgante, Silvia Caprioli, Alfonsina Chiefari, Vincenzo Toscano, Salvatore Monti
Facoltà di Medicina e Psicologia, “Sapienza” Università di Roma; UOC di Endocrinologia, AO S. Andrea
(aggiornato al 23 maggio 2017) questo capitolo è in attesa di aggiornamento
Il decorso naturale dell’Orbitopatia di Graves (OG) è generalmente autolimitante e migliora spontaneamente. Tale patologia necessita di un trattamento medico specifico quando è in fase di attività clinica e in funzione del grado di severità.
MISURE GENERALI
Indipendentemente dalle caratteristiche cliniche e dalla sintomatologia dell’OG, è fondamentale l’astensione dall’abitudine al fumo, in quanto fattore di rischio per la comparsa e la progressione dell’OG e per la scarsa risposta al trattamento (1).
Una normale funzionalità tiroidea è fondamentale per il controllo dell’OG, considerando l’influenza che sia l’ipertiroidismo che l’ipotiroidismo hanno sul decorso naturale della malattia. L’ipotiroidismo, raramente primitivo, più frequentemente secondario al sovradosaggio di farmaci anti-tiroidei, può essere responsabile di una progressione dell’OG. L’ipertiroidismo è presente nella maggioranza dei pazienti con OG (80%). La scelta terapeutica dell’ipertiroidismo (farmaci anti-tiroidei, radioiodio o tiroidectomia) influenza l’andamento dell’OG, attraverso la rimozione degli antigeni tiroidei e la conseguente presumibile attenuazione della reazione autoimmune. Qualora sia indicata la terapia radiometabolica per la gestione dell’ipertiroidismo, al fine di evitare il peggioramento, o l’insorgenza de novo, dell’OG, è opportuno intraprendere la profilassi steroidea, in particolare nei fumatori e nei pazienti con ipertiroidismo severo o di recente insorgenza:
- ad alto rischio di progressione o insorgenza de novo di OG: prednisone 0.3-0.5 mg/kg/die per 3 mesi;
- basso rischio di progressione o insorgenza de novo di OG: prednisone 0.2 mg/kg/die per 6 settimane.
L’utilizzo dei farmaci anti-tiroidei di per sé è neutrale sull’andamento dell’OG, tuttavia è stato osservato che indirettamente può dare un vantaggio, probabilmente attraverso una graduale e progressiva riduzione dei livelli degli anticorpi anti-recettore del TSH. Esistono due possibili regimi terapeutici con i farmaci anti-tiroidei: titration (dosaggio in base ai valori degli ormoni tiroidei) e block-replace (alto dosaggio abbinato a L-tiroxina sodica) (2). I dati disponibili non evidenziano nel complesso vantaggi significativi del regime "block and replace" a fronte della sua maggiore complessità di impiego.
TRATTAMENTO SPECIFICO
È legato alla severità e all’attività della malattia (3).
OG DI GRADO LIEVE
Il coinvolgimento oculare è lieve e l’atteggiamento più idoneo da adottare è quello del “wait and see”. Infatti, questa forma di OG tende spesso a migliorare spontaneamente.
Si possono, tuttavia, mettere in atto misure di supporto locale per alleviare la sintomatologia: il sollevamento della testata del letto è utile per ridurre l’edema peri-orbitario, la fotofobia può essere attenuata tramite l’uso di occhiali da sole scuri, il senso di irritazione e di corpo estraneo con lacrime artificiali e gel.
È consigliabile l’utilizzo di lacrime artificiali senza conservanti, con proprietà osmoprotettive (4).
Se presente lagoftalmo, il paziente deve essere istruito circa il posizionamento di bende che mantengano la palpebra chiusa e impediscano l’esposizione corneale durante il sonno, da associare all’utilizzo di gel o unguenti.
Per correggere la diplopia lieve, si può fare uso di prismi.
La somministrazione di selenio migliora significativamente la qualità di vita, migliora il quadro clinico oculare e rallenta la progressione della malattia.
Qualora si associ una compromissione della qualità della vita (valutata con specifico questionario), è possibile proporre gli stessi trattamenti indicati per la forma moderato-severa.
OG DI GRADO MODERATO-SEVERO
FORME ATTIVE
Trattamento di prima linea
La terapia di prima scelta, in presenza di attività clinica, si basa sull’utilizzo di glucocorticoidi ad alte dosi. I glucocorticoidi hanno dimostrato un effetto benefico su edema dei tessuti molli, acuità visiva e motilità oculare, mentre l’effetto sulla proptosi è piuttosto limitato. È raccomandato il trattamento per via endovenosa, perché più efficace e meglio tollerato rispetto alla via orale e locale (retro-bulbare e sub-congiuntivale).
Il regime terapeutico proposto dalla Consensus del 2008 dell’European Group On Graves Orbitopathy (EUGOGO) prevede la somministrazione, in monoterapia, di 500 mg di metilprednisolone una volta a settimana per 6 settimane, seguiti da 250 mg una volta a settimana per altre 6 settimane (dose totale 4.5 g) (1). Tale schema, secondo le linee guida ETA/EUGOGO 2016, viene considerato un dosaggio intermedio, utilizzabile nella maggioranza delle forme di OG moderato-severe in fase attiva.
Un regime ad alto dosaggio, per le forme particolarmente gravi, prevede la somministrazione, in monoterapia, di 750 mg di metilprednisolone una volta a settimana per 6 settimane, seguiti da 500 mg una volta a settimana per altre 6 settimane (dose totale 7.5 g) (4).
All’inizio e nel corso della terapia infusionale, è necessario valutare la presenza di eventuali epatopatie e di altri potenziali effetti avversi (5) del trattamento con glucocorticoidi, quali ipertensione, iperglicemia, patologie gastriche, infezioni, osteoporosi e glaucoma, per intraprendere eventuali terapie specifiche volte al controllo degli stessi.
| Schema terapeutico con metilprednisolone ev per OG di grado moderato-severo in fase attiva | |
| Prima di intraprendere il trattamento | Controllare:
|
| Preparazione | Metilprednisolone (Solumedrol) in 250 mL di soluzione fisiologica + Inibitore di Pompa Protonica |
| Somministrazione | Infusione ev lenta (40 gocce al minuto - circa due ore) Rilevare la pressione arteriosa all’inizio e al termine dell’infusione |
| Schema | Schema dosaggio-intermedio: 500 mg a settimana per sei settimane, poi 250 mg per altre sei settimane Schema alto-dosaggio: 750 mg a settimana per 6 settimane, poi 500 mg per altre 6 settimane Dose massima totale: 8 g |
| Durante il trattamento | Eseguire i controlli di glicemia, funzionalità epatica, emocromo completo, esame urine con urinocoltura ed eventuale antibiogramma, sangue occulto nelle feci Consigliare la terapia orale con inibitori di pompa protonica |
Trattamenti di seconda linea
Secondo ciclo di corticosteroidi (dose massima 8 g).
Radioterapia orbitaria: 20 Gy (frazionati in 10 dosi da 2 Gy), in associazione a basse dosi di glucocorticoidi per via orale.
Ciclosporina, in associazione con il prednisone, si è mostrata efficace nei casi di OG moderata-severa, non controllata dalla terapia corticosteroidea.
Rituximab (6,7) ha mostrato risultati incoraggianti, simili a quelli ottenuti con i glucocorticoidi endovena, tuttavia il potenziale effetto benefico deve essere confermato in studi più ampi e controllati.
Altri trattamenti
Iniezioni peri-oculari di triamcinolone acetonide (40 mg/mL) hanno dimostrato di ridurre diplopia e volume dei muscoli extra-oculari.
Lenti prismatiche in caso di diplopia in posizione primaria di sguardo.
Tossina botulinica per la correzione della retrazione palpebrale superiore e del lagoftalmo.
Immunoglobuline per via endovenosa hanno efficacia non superiore rispetto al trattamento tradizionale (glucocorticoidi e radioterapia). Peraltro il costo eccessivo e il rischio di trasmissione di malattie infettive ne limita l’utilizzo nel trattamento dell’OG.
L’uso degli analoghi della somatostatina ha dimostrato effetti benefici marginali.
FORME INATTIVE
Questa condizione richiede differenti step di chirurgia riabilitativa:
- chirurgia decompressiva
- chirurgia muscolare
- chirurgia palpebrale
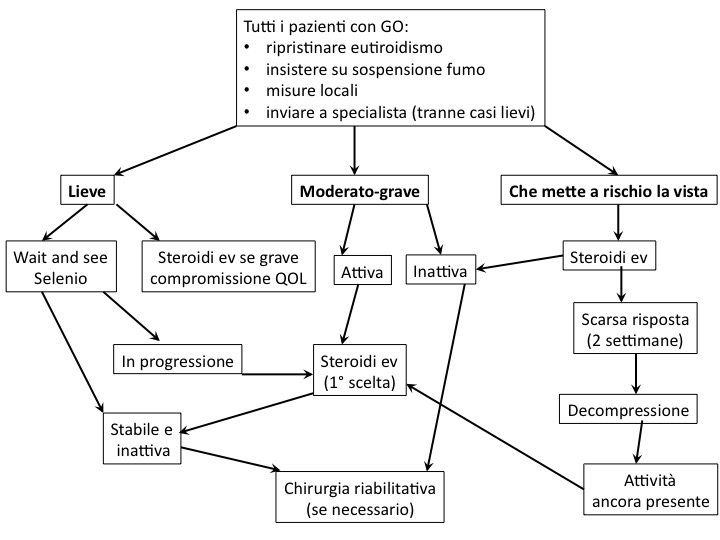
Flow-chart per la gestione GO (modificata da 4)
BIBLIOGRAFIA
- Bartalena L, Baldeschi L, Dickinson A, et al. Consensus statement of the European Group on Graves' orbitopathy (EUGOGO) on management of GO. Eur J Endocrinol 2008, 158: 273–85.
- Abraham P, Avenell A, Park CM, et al. A systematic review of drug therapy for Graves’ hyperthyroidism. Eur J Endocrinol 2005, 153: 489–98.
- Dickinson J, Perros P. Thyroid-associated orbitopathy: who and how to treat. Endocrinol Metab Clin North Am 2009, 38: 373-8.
- Bartalena L, et al. The 2016 European Thyroid Association/European Group of Graves’ Orbitopathy guidelines for the management of Graves’ Orbitopathy. Eur Thyroid J 2016, 5: 9-26.
- Zang S, Ponto KA, Kahaly GJ. Intravenous glucocorticoids for Graves’ orbitopathy: efficacy and morbidity. J Clin Endocrinol Metab 2011, 96: 320-32.
- Salvi M, Vannucchi G, Curro N, et al. Efficacy of B-cell targeted therapy with rituximab in patients with active moderate to severe Graves’ orbitopathy: a randomized controlled study. J Clin Endocrinol Metab 2015, 100: 422–31.
- Salvi M, Vannucchi G, Curro N, et al. Small dose of rituximab for Graves’ orbitopathy: new insights into the mechanism of action. Arch Ophthalmol 2012, 130: 122–4.
Radioterapia per l'orbitopatia di Graves
Mattia Falchetto Osti*, Linda Agolli*, Salvatore Monti**
*Cattedra di Radioterapia, “Sapienza” Università di Roma, Facoltà di Medicina e Psicologia
** UOC di Endocrinologia – Azienda Ospedaliera S. Andrea, Facoltà di Medicina e Psicologia - “Sapienza” Università di Roma
L’orbitopatia di Graves (OG) è la più frequente manifestazione extra-tiroidea della malattia di Graves. E’ una patologia di origine autoimmune, caratterizzata dall’aumento di volume dei tessuti retro-orbitari. L’OG si presenta in forma severa nel 3-5% dei casi. Le opzioni di trattamento nella forma moderata-severa sono i farmaci corticosteroidei ad alte dosi, la chirurgia e la radioterapia a fasci esterni (EBRT – external beam radiotherapy) della regione orbitaria, associata o meno ai corticosteroidi per via sistemica.
La radioterapia a fasci esterni agisce con un meccanismo anti-infiammatorio aspecifico e con un meccanismo immuno-soppressivo specifico sui linfociti e sui fibroblasti localizzati nel tessuto retro-orbitario.
Il trattamento combinato (radioterapia + corticosteroidi per via sistemica) si è dimostrato essere la modalità più efficace di terapia, con tassi di risposta dal 50 al 70% dei casi. Il trattamento combinato e la radioterapia o i corticosteroidi in terapia esclusiva sono stati confrontati in due trial clinici: i risultati migliori si sono osservati con il trattamento combinato [1]. La radioterapia, come anche il trattamento con corticosteroidi, trova indicazione nella fase attiva della GO.
Indicazioni radioterapiche
L’intento della radioterapia a fasci esterni è quello di ostacolare la progressione di malattia e di migliorare il quadro sintomatico soggettivo e oggettivo del paziente, ma è possibile che si verifichino riesacerbazioni dell’orbitopatia anche dopo il trattamento radiante della malattia. Inizialmente, si verifica un miglioramento di natura soggettiva con riduzione dei sintomi, quali lacrimazione, diplopia, dolore oculare e fotofobia. Successivamente, migliorano i segni oggettivi, come l’edema palpebrale e l’iperemia congiuntivale. I controlli periodici con TC e RMN delle orbite post-trattamento EBRT mostrano diminuzione dell’ipertrofia dei muscoli retti, principalmente i retti inferiori e mediali [2]. Inoltre, le indagini radiologiche indicano anche una riduzione dell’attività infiammatoria dell’orbita e del volume dei tessuti molli retro-orbitari.
La radioterapia può essere impiegata anche nel trattamento delle forme moderate di GO, per migliorare principalmente la motilità oculare e la diplopia, con meno efficacia sull’esoftalmo e sui tessuti molli.
I benefici ottenuti con la radioterapia sono visibili clinicamente e radiologicamente dopo un intervallo di 6-12 mesi.
Tecnica radioterapica e frazionamenti
La pianificazione della terapia radiante si esegue in base alle immagini acquisite alla TC di centraggio pre-trattamento. Per l’immobilizzazione del paziente durante le applicazioni, è necessaria una maschera termoplastica personalizzata, che serve per garantire lo stesso posizionamento. La precisione del trattamento viene documentata da controlli periodici con immagini portali digitali.
Il trattamento avviene attraverso due campi laterali contrapposti, con dimensioni variabili da 4x4 a 5.5x5.5 cm, angolati di 5-10° per preservare i cristallini. Il limite superiore e inferiore del campo sono il tetto e il pavimento dell’orbita, rispettivamente; il limite anteriore e posteriore sono il canto laterale dell’occhio e l’apice del seno sfenoidale, rispettivamente.
Il tipo di frazionamento standard applicato è quello con una dose totale di 20 Gy, erogata in 10 frazioni da 2 Gy al giorno per 2 settimane. Esistono altri frazionamenti, come il trattamento ipofrazionato protratto, eseguito in 10 frazioni settimanali da 1 Gy per una dose totale di 10 Gy e durata totale di 10 settimane.
Uno studio randomizzato ha confrontato diversi tipi di frazionamento (1 Gy settimanale per 20 settimane per una dose totale di 20 Gy vs. 1 Gy al giorno per 2 settimane per una dose totale di 10 Gy vs. 2 Gy al giorno per 2 settimane per una dose totale di 20 Gy), dimostrando risultati clinici simili con migliore tolleranza per i regimi protratti [3].
L’OG è caratterizzata da ricadute frequenti e per tale motivo la radioterapia deve assicurare una copertura del target estremamente efficace, con maggior risparmio degli organi a rischio. Le nuove tecniche radioterapiche come l’IMRT (radioterapia a intensità modulata) possono essere utilizzate in studi prospettici o randomizzati futuri per verificare il tasso di risposta e gli effetti avversi.
Tossicità
Il quadro clinico della malattia si può aggravare durante la radioterapia.
Gli effetti avversi acuti più frequenti sono l’aumento della lacrimazione e la comparsa di congiuntivite acuta che si risolve di solito a pochi giorni dalla fine dell’EBRT.
Le tossicità tardive radioterapie-correlate sono la retinopatia, la cataratta e probabili secondi tumori [4]. La cataratta è la complicanza più frequente, presente in circa 10% dei casi trattati, ed è tipicamente polare posteriore. La retinopatia è una complicanza rara, riportata generalmente dopo 6-36 mesi dalla fine della radioterapia. La radioterapia della regione orbitale è controindicata nei pazienti affetti da diabete o ipertensione severa, quando i segni della retinopatia sono presenti prima dell’irradiazione. Finora, non è stata riportata nessuna patologia neoplastica nel distretto testa-collo legato al trattamento radioterapico, anche se è necessario un lungo follow-up; è opportuno pertanto utilizzare molta cautela nel trattare soggetti di età inferiore a 35 anni.
Bibliografia
- Ng CM, Yuen HK, Choi KL, et al. Combined orbital irradiation and systemic steroids compared with systemic steroids alone in the management of moderate-to-severe Graves’ ophthalmopathy: a preliminary study. Hong Kong Med J 2005, 11: 322-30.
- De Deus Cardoso CC, Giordani AJ, Borri Wolosker AM, et al. Protracted hypofractionated radiotherapy for Graves’ ophthalmopathy: a pilot study of clinical and radiological response. Int J Rad Oncol Biol Phys 2012, 82: 1285-91.
- Kahaly GJ, Rosler HP, Pitz S, et al. Low- versus high-dose radiotherapy for Graves ophthalmopathy: a randomized single blind trial. J Clin Endocrinol Metabol 2000, 85: 102-8.
- Marcocci C, Bartalena L, Rocchi R, et al. Long-term safety of orbital radiotherapy for Graves’ ophthalmopathy. J Clin Endocrinol Metabol 2003, 88: 3561-6.
Overview sul trattamento chirurgico del'orbitopatia di Graves
Lelio Baldeschi
Orbita, Oculoplastic lacrimal diseases and Surgery, Department of Ophthalmology, Catholic University of Louvain; Academic Hospital Saint Luc, Bruxelles, Belgium
PUNTI PRINCIPALI
- L’orbitopatia tiroide-correlata è una malattia debilitante, sia dal punto di vista estetico che funzionale, che diminuisce la qualità di vita dei pazienti affetti, con frequente perdita di auto-stima, stabilità psico-sociale e capacità lavorativa.
- Il controllo del metabolismo tiroideo, se alterato, e l’immuno-soppressione, se necessaria, possono contrastare la tendenza della malattia a evolvere verso forme di maggiore gravità e contribuiscono alla riduzione dei tipici segni e sintomi di recente insorgenza.
- Le alterazioni somatiche e funzionali stabili prodotte dalla malattia rispondono al trattamento chirurgico, che può anche rendersi necessario nel caso di forme gravi di malattia, con otticopatia o esposizione corneale, non curabili con la sola terapia medica.
- In considerazione del fatto che l’orbitopatia (così come le possibili conseguenze del suo trattamento chirurgico) colpisce l’apparato visivo, la riabilitazione chirurgica è di pertinenza oftalmologica. Può durare 1.5-2 anni e comprendere: decompressione orbitaria, chirurgia strabologica e palpebrale, sia funzionale che estetica.
- Il trattamento chirurgico dell’orbitopatia è efficace e le complicanze chirurgiche sono rare, quando è eseguito in centri di riferimento e da chirurghi dedicati.
INTRODUZIONE
L’orbitopatia tiroide correlata (OTC), detta anche orbitopatia di Graves o di Flajani-Graves-Basedow, è la manifestazione più frequente e debilitante dell’ipertirodismo di Graves-Basedow, per quanto, anche se più raramente, possa manifestarsi in pazienti eutiroidei o con ipotiroidismo, esito di tiroiditi autoimmuni. Può essere associata a dermopatia (mixedema pretibiale), acropatia e raramente a psicosi.
L’OTC si manifesta con alterazioni somatiche e funzionali di vario grado a carico della regione peri-orbitaria, delle palpebre, dell’occhio e più in generale dell’apparato visivo. Le forme più gravi (3-5%) possono portare alla perdita della vista, per quanto la qualità di vita sia diminuita nella maggior parte dei pazienti affetti, indipendentemente dalla gravità della malattia. Frequenti sono perdita di auto-stima, stabilità psico-sociale e capacità lavorativa.
La prevalenza dell’OTC nell’adulto in Europa è di circa 1000 casi per milione di abitanti, e si riduce a 500 casi per milione di abitanti se consideriamo le forme da moderate a gravi e quelle gravissime a rischio di cecità. Il genere femminile è maggiormente colpito, con una frequenza variabile da 9.3 a 1.4 volte maggiore rispetto a quello maschile, a seconda che si tratti di OTC lieve o grave. Il genere femminile è solitamente colpito tra la 4° e la 5° decade di vita, quello maschile solitamente in età più avanzata e in maniera più grave. Raramente l’OTC può essere una patologia pediatrica (1).
L’OTC è caratterizzata da una “fase dinamica” precoce, in cui i segni e i sintomi prima progrediscono, aggravandosi in maniera più o meno rapida, dopodiché si fanno meno gravi e si vanno stabilizzando nella “fase statica” che segue. In ambedue le fasi può essere indicata la terapia chirurgica.
Nella fase dinamica la terapia è principalmente medica e per essa si rimanda al capitolo specifico, per quanto la terapia chirurgica possa spesso rendersi necessaria sotto forma di decompressione orbitaria. Questo avviene quando la terapia medica non è sufficiente a controllare la disfunzione del nervo ottico, nota come otticopatia distiroidea, cagionata dalla compressione che i muscoli extra-oculari aumentati di volume possono esercitare sul nervo stesso o dal suo stiramento dovuto ad esoftalmo di grado estremo. In quest’ultimo caso può rendersi necessaria la decompressione orbitaria in urgenza per correggere gravi soluzioni di continuo della cornea, non trattabili con la sola chirurgia palpebrale, e a rischio di cheratiti, endo/panoftalmiti, o addirittura di perforazione del bulbo oculare.
Nella fase statica post-infiammatoria la terapia è chirurgica e tesa a correggere le alterazioni somatiche e funzionali stabili residuate dalla fase precedente. Essa consiste in una combinazione di interventi oftalmologici, che solitamente includono chirurgia dell’orbita, chirurgia strabologica e oftalmo-plastica (2).
CHIRURGIA OFTALMICA PER ORBITOPATIA DISTIROIDEA
Non è completamente noto l’esatto meccanismo alla base delle alterazioni dell’autoimmunità che innescano l’OTC. Per questo motivo, non esiste una terapia medica specifica che possa bloccare tutte le citochine che, a partire dall’attivazione di linfociti Th e fibroblasti, portano per vari gradienti chemiotattici alla deposizione dei glicosaminoglicani. Il processo autoimmunitario alla base dell’OTC induce aumento di volume dei tessuti molli contenuti all’interno dell’orbita ossea, che causa congestione venosa con impedimento del fisiologico deflusso venoso verso il seno cavernoso e inversione dello stesso verso il circolo venoso facciale. Questo circolo vizioso porta ad aumento della pressione intra-orbitaria, responsabile sia della progressione dell’orbitopatia che dei suoi tipici segni e sintomi (3). Sebbene la terapia medica possa influenzare positivamente l’evoluzione della malattia, scarsi sono gli effetti dei trattamenti immuno-soppressivi aspecifici sulle alterazioni somatiche e funzionali conclamate che la malattia può produrre.
Qualsiasi procedura chirurgica tesa a diminuire l’aumentata pressione endo-orbitaria per mezzo di un aumento del volume dell’orbita ossea e/o di una rimozione del grasso orbitario è definita decompressione orbitaria (4,5).
A seconda della gravità dell’orbitopatia, la riabilitazione chirurgica può essere più o meno estesa. Il trattamento completo, che può richiedere chirurgia decompressiva, chirurgia strabologica, allungamenti palpebrali, blefaro-plastiche, può avere una durata complessiva di 1.5-2 anni.
La chirurgia decompressiva porta a riduzione dell’esoftalmo, dell’edema peri-orbitario e, in circa il 50% dei pazienti, a una riduzione dell’apertura della rima palpebrale. Può migliorare lo strabismo restrittivo distiroideo ma questo, più spesso, viene indotto o peggiorato dal dislocamento dei tessuti molli orbitari prodotto dalla decompressione. La chirurgia strabologica deve, per questo, seguire la chirurgia decompressiva e, considerando che lo strabismo verticale influenza la posizione delle palpebre, la chirurgia strabologica deve precedere quella palpebrale. In buona sostanza, la riabilitazione chirurgica dell’OTC deve rispettare la cronologia sopra indicata, dal momento che la procedura precedente può influenzare la necessità e l’estensione di quella che segue. In casi particolari sono possibili eccezioni e possono essere eseguite contemporaneamente più procedure chirurgiche, favorendo così una riabilitazione più rapida (2).
La chirurgia riabilitativa può essere eseguita nella fase statica, post-infiammatoria dell’OTC, dopo che il quadro clinico è rimasto stabile per 6-8 mesi sia dal punto di vista metabolico che oftalmologico. Al contrario, la chirurgia decompressiva, che può rendersi necessaria nella fase acuta dell’OTC per la cura dell’otticopatia distiroidea e della cheratopatia da esposizione refrattarie alla terapia medica, è da intendersi come chirurgia funzionale e deve essere eseguita in urgenza, senza perciò la necessità di rispettare le tempistiche della chirurgia riabilitativa (2,5).
Chirurgia decompressiva
In origine la chirurgia decompressiva era utilizzata limitatamente al trattamento di quelle forme gravi di OTC in cui la funzione visiva era a rischio, a causa di otticopatia o di cheratopatia da esposizione non reversibili con trattamenti più conservativi. Più di recente le indicazioni a questo tipo di chirurgia sono state estese al trattamento dell’esoftalmo e dei sintomi tipici dell’orbitopatia. Altre indicazioni più recenti alla chirurgia decompressiva sono la sub-lussazione del bulbo oculare, che può essere causa di otticopatia e/o esposizione corneale acuta, l’amaurosi posturale in pazienti con orbitopatia inattiva e le pieghe coroideali (5,6).
Attualmente la chirurgia decompressiva si avvale di osteotomie, che coinvolgono la parete mediale, il pavimento orbitario, la parete laterale, e/o lipectomie, solitamente ma non esclusivamente limitate al quadrante orbitario infero-laterale. Questa zona, in cui non sono presenti strutture anatomiche importanti, rappresenta infatti un’area particolarmente sicura per questo tipo di procedura chirurgica. Quale sia la più conveniente sequenza di osteotomie e lipectomie continua ad essere argomento di discussione.
Osteotomie a rotazione e impianti alloplastici sovra-periostei, sebbene siano stati sporadicamente usati per camuffare, più che per correggere, l’esoftalmo, sono procedure di non comprovata efficacia e i loro margini, che si rendono spesso evidenti, non contribuiscono a ottimizzare il risultato estetico finale della riabilitazione chirurgica.
Chirurgia strabologica
Nel paziente affetto da OTC può rendersi necessaria la correzione dello strabismo restrittivo dovuto alla malattia ed eventualmente peggiorato dalla chirurgia decompressiva o di quello iatrogeno indotto ex novo da tale chirurgia.
Lo strabismo a piccolo angolo può giovarsi del trattamento con lenti prismatiche, mentre lo strabismo stabile a più ampio angolo abbisogna di trattamento chirurgico. Questo può essere eseguito in più procedure, oppure correggendo contemporaneamente la componente verticale e quella orizzontale dello strabismo. Nel primo caso, si operano prima i retti verticali, che come azione terziaria sono adduttori, mentre nel secondo caso non possono essere operati più di 2 muscoli retti contigui nello stesso occhio, al fine di rendere minimo il rischio di possibili processi ischemici a carico del segmento anteriore.
Nello strabismo distiroideo la chirurgia è solitamente eseguita sui muscoli retti, l’inciclotropia e l’exciclotropia sono rare e di solito secondarie, rispettivamente, a ipoglobo e restrizione del retto inferiore. Gli interventi, che solitamente consistono in recessioni più o meno estese, sono eseguiti in prima istanza al fine di ripristinare la fusione in posizione primaria di sguardo, successivamente (ma anche contemporaneamente) possono essere richieste miopessie retro-equatoriali, al fine di ridurre l’estensione delle incomitanze periferiche. Le complicanze sono rare.
Chirurgia palpebrale
La retrazione palpebrale è un segno comune dell’OTC, che riguarda il 91% dei pazienti nel corso della malattia (7). La retrazione palpebrale superiore e inferiore è dovuta a una combinazione di infiammazione, fibrosi, stimolazione adrenergica e restrizione dei retti verticali. L’esoftalmo contribuisce ad aumentare l’ampiezza della rima palpebrale, dislocando le palpebre.
Di recente, è stato dimostrato che la chirurgia decompressiva eseguita per via coronale, che non ha nessun effetto sui retrattori palpebrali, riduce in maniera simile la dislocazione sia della palpebra superiore che di quella inferiore (8). La correzione della retrazione palpebrale superiore e inferiore può essere ottenuta mediante recessione/allungamento dei retrattori. Solo le forme più gravi a carico della palpebra inferiore richiedono l’inserimento di spaziatori di varia natura tra i retrattori recessi e il margine inferiore del tarso. Questo si rende necessario al fine di offrire la rigidità e il supporto necessari al riposizionamento della palpebra in posizione fisiologica contro l’azione della forza di gravità. A tal fine sono stati utilizzati diversi materiali (autologhi, omologhi, xenogenici, o sintetici) e, nonostante rimanga controverso quale sia il più conveniente, la mucosa prelevata dal palato duro rappresenta un’ottima soluzione, per quanto non sia trascurabile il disconfort e la possibile morbosità al sito di prelievo.
Il risultato del trattamento chirurgico della retrazione palpebrale superiore è senza dubbio meno prevedibile di quello del trattamento della retrazione palpebrale inferiore. La terapia medica della retrazione palpebrale superiore con α-bloccanti topici è poco efficace e la terapia topica o sistemica con bloccanti adrenergici post-gangliari come la guanetidina è associata a effetti collaterali molteplici e indesiderabili. Un’opzione terapeutica può essere rappresentata dalla tossina botulinica, la cui efficacia limitata nel tempo implica la necessità di trattamenti ripetuti. La tossina botulinica può inoltre indurre temporanee ipercorrezioni della retrazione palpebrale superiore o complicanze quali deficit di elevazione e paralisi dell’orbicolare, che sono altamente indesiderabili in pazienti a rischio di esposizione corneale come quelli affetti da OTC.
In considerazione del fatto che il trattamento della retrazione palpebrale superiore è una delle ultime procedure che può rendersi necessaria nel lungo e stressante trattamento riabilitativo del paziente affetto da OTC, e che, sebbene siano stati proposti differenti trattamenti, nessuno di essi si è dimostrato migliore degli altri, è fortemente raccomandabile usare la tecnica chirurgica meno invasiva e di più rapida esecuzione. Coerentemente con queste considerazioni, è stato proposto un approccio sistematico per la cura di gradi diversi di retrazione palpebrale superiore. Esso prevede (9):
- per retrazioni lievi (≤ 3 mm) la Müllerectomia trans-congiuntivale senza suture;
- per retrazioni moderato-gravi (> 3 mm) una recessione en-block del complesso di congiuntiva retrattori attraverso un approccio anteriore (blefarotomia) o trans-congiuntivale senza suture.
Nel paziente affetto da OTC gli interventi di blefaroplastica superiore, inferiore, plastica del sopracciglio e della fronte richiedono tecniche sostanzialmente simili a quelle richieste per il trattamento dei processi involutivi senili delle stesse regioni, tuttavia nell’OTC alcune strutture come il grasso sub-orbicolare e il corrugatore del sopracciglio meritano un’attenzione particolare.
Complicanze
Le complicanze più serie sono dovute alla chirurgia decompressiva, sebbene, in generale, essa sia considerata una procedura sicura ed efficace quando praticata in centri di riferimento e da chirurghi dedicati (10). Complicanze comuni della chirurgia decompressiva includono strabismo, disestesie del nervo infra-orbitario, sinusiti, entropion della palpebra inferiore e distopia bulbare (5).
La complicanza di gran lunga più frequente e temuta della chirurgia decompressiva è la diplopia, che ha un impatto fortemente negativo sulla qualità di vita dei pazienti affetti da OTC ed è certamente una delle ragioni che alimenta lo scetticismo di alcuni verso questo trattamento chirurgico.
Solo sporadicamente sono state descritte fistole liquorali, infezioni, vasospasmi, insulti ischemici, infarti ed emorragie coinvolgenti il sistema nervoso centrale (5).
Complicanze lievi, che rispondono solitamente alla terapia medica, includono erosioni corneali, dellen secondarie alla chemosi congiuntivale che può venirsi a creare nell’immediato post-operatorio, e riattivazione dell’orbitopatia a poche settimane dall’intervento nell’1.3% dei casi (11).
BIBLIOGRAFIA
- Perros P, Hegedus L, Bartalena L, et al. Graves' orbitopathy as a rare disease in Europe: a European Group On Graves' Orbitopathy (EUGOGO) Position Statement. Orphanet 2017, 12: 72.
- Baldeschi L. Rehabilitative surgery. In: Wiersinga WM, Kahaly G, editors. Graves’ Orbitopathy. A Multidisciplinary Approach - Questions and Answers, 3rd Karger, Basel, Switzerland, 2017.
- Bahn RS. Pathophysiology of Graves’ ophthalmopathy: the cycle of disease. J Clin Endocrinol Metab 2003, 88: 1939-146.
- Baldeschi L. Orbital decompressions: status of the art and unresolved issues. In: Guthoff R, Katowitz J, Eds. Essential in ophthalmology: Orbit and Oculoplastic. Springer, Berlin, 2007: 143-51.
- Baldeschi L, Morris DS. Orbital decompression. In: Wiersinga WM, Kahaly G, editors. Graves’ Orbitopathy. A Multidisciplinary Approach - Questions and Answers, 3rd Karger, Basel, Switzerland, 2017.
- Rose GE. Postural visual obscurations in patients with inactive thyroid eye disease; a variant of “hydraulic” disease. Eye 2006, 20: 1178-85.
- Bartley GB, Fatourechi V, Kadrmas EF, et al. Clinical features of Graves’ ophthalmopathy in an incidence cohort. Am J Ophthalmol 1996, 121: 284-90.
- Baldeschi L, Wakelkamp IMMJ, Lindeboom R, et al. Early versus late orbital decompression in Graves’ orbitopathy: a retrospective study in 125 patients. Ophthalmology 2006, 113: 874-8.
- Baldeschi L. Correction of lid retraction and exophthalmos. In: Geerling G, Brewitt H, Eds. Surgery for the dry eye. Scientific evidence and guidelines for the clinical management of dry eye associated ocular surface disease. Karger, Basel, 2008: 103-26.
- Bahn RS. Is orbital decompression a safe and effective treatment for Graves' orbitopathy? Nat Clin Pract Endocrinol Metab 2007, 3: 796-7.
- Baldeschi L, Lupetti A, Vu P, et al. Reactivation of Graves’ orbitopathy after rehabilitative orbital decompression. Ophthalmology 2007, 114: 1395-402.
Chirurgia decompressiva per l'orbitopatia di Graves
Giuseppina Fini, Elidon Mici, Ludovica Marcella Ponzo, Carmela Maria Pia Scannavino, Pasquale Virciglio, Francesco Ricotta
Cattedra di Chirurgia Maxillo-Facciale, Dipartimento NESMOS, Facoltà di Medicina e Psicologia, Sapienza Università di Roma
Premesse e storia
Dollinger1 nel 1911 descriveva il primo intervento di decompressione orbitaria per il trattamento di un esoftalmo, eseguito utilizzando un’orbitotomia laterale secondo la tecnica che Kronlein nel 18892 aveva codificato per rimuovere una neoplasia orbitaria; l’entità della decompressione risultava comunque modesta.
Per molti anni, la tecnica descritta da Walsh-Ogura nel 19573, consistente nell’abbattimento della parete laterale e del pavimento orbitario, è stata il gold standard per la decompressione orbitaria. Nel 1990 Kennedy e colleghi4 riportavano l’esperienza dei primi interventi endoscopici trans-nasali. Da allora, sono state sviluppate numerose tecniche chirurgiche per ottenere una decompressione ottimale: abbattimento del pavimento orbitario5, della parete mediale dell’orbita6, combinazione di queste3,7, della parete laterale1,2, osteotomia del malare associata a depressione delle pareti mediale e inferiore8,9, abbattimento di tre pareti10,11, di quattro12-14, rimozione del grasso orbitario, e rimozione della porzione laterale del pavimento orbitario15 e della parete laterale insieme alla mobilizzazione della cornice orbitaria laterale16. Il tutto mediante l’ausilio di tecniche classiche o endoscopiche17,18. La moltitudine di tecniche disponibili (circa 18 secondo uno studio condotto dall’EUGOGO19) è testimone del fatto che nessuna si è dimostrata nettamente superiore all’altra o comunque che una tecnica può essere considerata migliore nella risoluzione di alcune condizioni piuttosto che in altre.
Qualsiasi tecnica venga presa in considerazione, l’entità della riduzione della proptosi è funzione del numero di pareti coinvolte nel trattamento chirurgico20, dell’entità dell’esoftalmo precedente l’intervento e del numero e grandezza delle incisioni eseguite sulla peri-orbita21. Inoltre, quando le varie metodiche chirurgiche, prese singolarmente, non sono sufficienti per la correzione della protrusione oculare è possibile effettuarle in combinazione. Possiamo riassumere che tali metodiche associabili tra loro siano in ordine di invasività e complessità: lipectomia, decompressione orbitaria, espansione orbitaria.
Quattro sono i principali approcci cutanei: coronale, sovra-palpebrale, sotto-palpebrale, cantotomia mediale e/o laterale.
Figura 1. Incisione Bicoronale

Figura 2. Incisione Trans-palpebrale

Figura 3. Cantotomia mediale
Figura 4. Aspetto intra-operatorio accesso trans-palpebrale inferiore
Rimozione del grasso intra-orbitario
Nel 1964 Rundle iniettò della paraffina nello spazio retro-bulbare di un cadavere. Questo determinò il riscontro di una proptosi di 6 mm dopo l’iniezione di circa 4 cc di paraffina. Studi successivi hanno messo in evidenza che il grasso intra-orbitario raggiunge un volume di circa 8 cc negli individui sani, mentre aumenta a circa 10 cc nei soggetti con orbitopatia di Graves. Questo suggerì ad Olivari che la riduzione del grasso intra-orbitario avrebbe prodotto una correzione significativa nei pazienti con orbitopatia tiroidea, oltre a determinare una decompressione del nervo ottico spesso coinvolto dall’aumento di tale tessuto. Olivari fu il primo a pubblicare i risultati chirurgici di 147 procedure dal 1991: a una asportazione media di grasso orbitario asportato di circa 6 cc si associava una riduzione dell’esoftalmo di circa 5.9 mm; l’acuità visiva veniva ripristinata in 6/10 pazienti con visione compromessa pre-operatoriamente.
In una pubblicazione più recente è stato descritto che il 40% del grasso orbitario poteva essere prelevato dal quadrante infero-laterale, il 25% dal quadrante infero-mediale, il 20% dal quadrante supero-mediale e il 15% da quello supero-laterale. L’utilizzo di questa tecnica è controindicato in pazienti che hanno effettuato radioterapia pre-operatoria, a causa della fibrosi indotta da tale metodica che inficia sul risultato finale del trattamento chirurgico nella gran parte dei casi (maggior incidenza di complicanze intra-operatorie e risultato estetico meno soddisfacente).
Figura 5. Percentuali di prelievo grasso peri-orbitario
Decompressione orbitaria
Può essere effettuata sia con tecnica open che in endoscopia, attraverso l’abbattimeno di una o più pareti orbitarie (generalmente non più di tre). La tecnica di Van der Wall, basata sull’abbattimente del pavimento, della parete mediale e laterale, risulta essere senz’altro la più utilizzata. Tuttavia ad oggi preferiamo usufruire di una modifica alla tecnica stessa, provvedendo ad effettuare un abbattimento più limitato del pavimento, della parete mediale e della parete laterale, diminuendo drasticamente la percentuale di pazienti con strabismo post-operatorio.
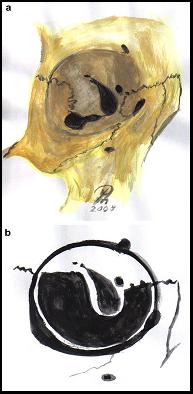
Figura 6. Tecnica di Van der Wall

Figura 7. Tecnica di Van der Wall modificata: notare l'abbattimento del pavimento e solo di parte della parete mediale e laterale
L’ausilio del trapano piezo-elettrico
Le sostanze piezoelettriche hanno la capacità di essere deformate, quando sono immesse in un campo elettrico. Se la polarità del campo cambia periodicamente, questi materiali iniziano a vibrare. Le vibrazioni ad ultrasuoni possono essere trasmesse a diversi materiali, solidi, liquidi o gassosi. Questa proprietà viene utilizzata in scaler a ultrasuoni con una frequenza funzionale di circa 20 kHz. L'aggiunta di un impulso a 50 kHz ogni 10 ns a questa frequenza basale aumenta la potenza del dispositivo ricevente, che permette di tagliare le ossa senza danneggiare i tessuti molli22. La chirurgia piezoelettrica è una tecnica poco invasiva che riduce il rischio di danni ai tessuti molli circostanti e a strutture importanti come nervi, vasi e mucosa. Si riducono anche i danni agli osteociti e consente una buona sopravvivenza delle cellule ossee durante la osteotomia. La chirurgia piezoelettrica è stata per la prima volta utilizzata da chirurghi maxillo-facciali per le osteotomie, ma di recente sono state proposte alcune applicazioni in neurochirurgia, otorinolaringoiatria e ortopedia23. I vantaggi nell’utilizzo di questo strumento sono quindi: alta precisione dell’osteotomia, minore emissione di calore al taglio con minore traumatismo sulle superfici ossee, preservazione delle strutture vascolari e nervose profonde, rapido recupero funzionale.
Figura 8. Trapano piezo-elettrico
Innesto di fibro-mucosa palatale
Tale metodica chirurgica viene applicata qualora residui la ptosi palpebrale residua dovuta all’esoftalmo. Lo scopo dell’innesto è quello di dare maggior spessore e consistenza alla palpebra ptosica (molto spesso quella inferiore), prelevando un frammento di fibromucosa palatale (area donatrice), e applicandolo a livello della congiuntiva palpebrale opportunamente preparata. I risultati estetici sono decisamente soddisfacenti, gravati da una bassissima percentuale di complicanze post-operatorie (mancato attecchimento dell’innesto, posizionamento erroneo, infezione dell’area donatrice).
Complicanze
Sulla base dell’osservazione che il paziente affetto da esoftalmopatia, che si sottopone a intervento chirurgico di decompressione orbitaria, non avverte particolare dolore nella prima ora post-intervento, ogni dolore che insorge prematuramente viene considerato anomalo e allarmante. Le complicanze immediate generalmente si manifestano nella prima ora successiva al trattamento chirurgico: chemosi congiuntivale, edema palpebrale, enoftalmo, erniazione del muscolo temporale, ematoma retro-bulbare responsabile di una cefalea importante, proptosi di nuova insorgenza; a queste possono aggiungersi altre condizioni patologiche, come l’ostruzione del seno mascellare dovuta all’erniazione del contenuto orbitario nel seno stesso o la compromissione transitoria o permanente del nervo sovra-orbitario e/o sotto-orbitario imputabile a una contusione iatrogena. Complicanze maggiori sono rappresentate invece da cecità, rottura della dura madre e meningite post-operatoria. Considerando invece la complicanza che più di frequente viene descritta in letteratura, non possiamo non soffermarci sulla comparsa o il peggioramento della diplopia 20,24,3. Walsh e Ogura riscontrarono un peggioramento della diplopia nel 33% dei casi3 e Garrity et al riportarono un 64% di nuove diplopie in un’ampia casistica di pazienti operati per via trans-antrale20. Per quanto riguarda la tecnica con approccio coronale, Mourits riporta percentuali variabili dal 3.2% al 10%, fino al 34%, in relazione al grado di miopatia presente25. È stato comunque evidenziato che a una maggiore riduzione della proptosi, indipendentemente dalla tecnica utilizzata, corrisponde una maggiore percentuale di comparsa o peggioramento della diplopia. La patogenesi di questa complicanza viene attribuita a un'espansione asimmetrica del contenuto orbitario: la rimozione del pavimento, infatti, permette di ottenere uno spazio ampio all’interno del quale andrà ad erniare il contenuto orbitario, ma è causa di uno spostamento verso il basso del bulbo e del muscolo retto inferiore, dovuti proprio alla perdita del sostegno strutturale offerto dalla struttura ossea stessa; la rimozione della parete mediale provoca altresì uno spostamento in questo senso del bulbo e del muscolo retto mediale, con conseguente perdità di simmetricità. Lo spostamento dei muscoli retti mediale ed inferiore, senza alcuna variazione di posizione di quello laterale giustifica lo strabismo convergente o verticale. Se invece i muscoli retto mediale o laterale subiscono uno spostamento simmetrico rispetto all’asse dell’orbita, l’effetto sulla motilità viene attenuato26.
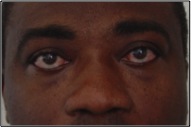

Figura 9. Paziente 1 pre (sinistra) e post (destra)

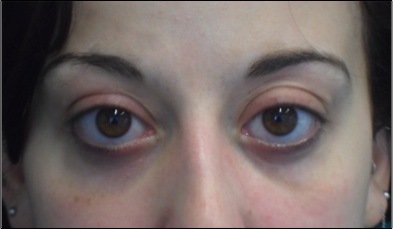
Figura 10. Paziente 2 pre (sinistra) e post (destra)
Bibliografia
- Dollinger J. The relief of pressure of the eye socket through removal of orbital bone in intense exophthalmos and corneal disease. Dtsch Med Wochenschr 1911: 1888-90.
- Kronlein RU. Zur pathologie und operative Behandlung der Dermodzysten der Orbita. Beitr Klin Chir 1989, 4: 14.
- Walsh TE, Ogura JH. Transantral orbital decompression for malignant exophthalmos. Laryngoscope 1957, 67: 544-68.
- Kennedy DW, Goodstein ML, Miller NR, et al. Endoscopic transantral orbital decompression. Arch Otorlaryngol Head Neck Surg 1990, 116: 275-82.
- Hirsh O, Urvaneck P. Behandlung eines excessiven exophthalmos dirch entfernung von orbitalfett von der kieferhole aus. Monatschr Ohrenksde 1930, 64: 212.
- Sewall EC. Operative control of progressive exophthalmos. Arch Otolaryngol 1936, 24: 621.
- Tessier P. Les Exophthalmies. Expansion chirurgicale de l’orbite. Ann Chir Plast 1969, 14: 207-14.
- Wolfe SA. Modified three-wall orbital decompression to correct persistent exophthalmos or exorbitism. Plast Reconstr Surg 1979, 64: 448-55.
- Mourits MP. Management of Graves’ ophthalmopathy. Thesis, University of Amsterdam, Rodopi, 1990.
- van der Pol JP, Korneef L, Gilissen JPA. Chirurgische rehabilitatie bij patienten mrt Graves’ ophthalmopathie; gunstige resultaten van orbitadecompressie via coronale benadering. Ned Tijdschr Geneeskd 1982, 40: 1971-4.
- Kennerdell JS, Maroon JC. An orbital decompression for severe dysthyroid exophthalmus. Ophthalmology 1982, 89: 467-72.
- Strance M, West M. A four wall orbital decompression for dysthyroid orbitopathy. J Neurosurg 1988, 68: 671-7.
- Olivari N. Transpalpebral decompression of endocrine ophthalmopathy by removal intraorbital fat: experience with 147 operations over 5 years. Plast Reconstr Surg 1991, 87: 627-41.
- Black PW, Thomas WC, Jurckiewicz MJ. The surgical amelioration of endocrine exophthalmos. Surgery 1967, 61: 544-9.
- Iliff CE, Iliff WJ, Iliff NT. Oculoplastic surgery. Philadelphia, PA, Saunders, 1979: pp 159-73.
- Matton G. Resection “en bloc” of the lateral wall and floor for decompression of the orbit in dysthyroid exophthalmos. Eur J Plast Surg 1991, 14: 114.
- Goldberg RA, Perry JD, et al. Strabismus after balanced medial plus lateral wall versus lateral wall only decompression for dysthyroid orbitopathy. Ophthal Plast Reconstr Surg 2000, 16: 271-7.
- Unal M, Leri F, Konuk O, et al. Balanced orbital decompression combined with fat removal in Graves’ ophthalmopathy: do we really need to remove the third wall? Ophthal Plast Reconstr Surg 2003, 19: 112-8.
- Mourits MP, Bijl H, et al (EUGOGO). Outcome of orbital decompression for disfiguring proptosis in patient with Graves’ orbitopathy using various surgical procedures. Br J Ophthalmol 2009, 93: 1518-23.
- Garrity JA, et al. Results of transantral orbital decompression in 428 patients with severe Graves’ Ophthalmopathy. Am J Ophthalmol 1993, 116: 533-47.
- Stanley RJ, McCaffrey TV. Superior and transantral orbital decompression procedures. Effects on increased intraorbital pressure and orbital dynamics. Arch Otolaryngol Head Neck Surg 1989, 115: 369-73.
- Sun D, Zhou ZY, Liu YH, et al. Development and application of ultrasonic surgical instruments. IEEE Trans Biomed Eng 1997, 44: 462–7.
- Vercellotti T, Nevins ML, Kim DM, et al. Osseous Response Following Resective Therapy with Piezosurgery. Int J Periont Restor Dent 2005, 25: 543-9.
- Scheper S, Joannides C, Fossion E. Surgical treatment of exophthalmos and exorbitism: a modified technique. J Craniomaxillofac Surg 1992, 20: 313-6.
- McNab AA. Orbital decompression for thyroid orbitopathy. A N Z J Ophtalmol 1997, 25: 55-61.
- Mourits MP, Koorneef L, Wiersinga WM, Prummel MF. Orbital decompression for Graves’ ophthalmopathy by inferomedial, by inferomedial plus lateral, and by coronal approach. Ophthalmology 1990, 97: 637-41.
Chirurgia strabologica per l'orbitopatia di Graves
Stefano Amodeo
Facoltà di Medicina e Psicologia, UOC di Oftalmologia, Università di Roma Sapienza; Ospedale Sant’Andrea di Roma.
(aggiornato a luglio 2025)
Anatomia dei muscoli extra-oculari
I muscoli extra-oculari, di origine mesodermica, iniziano il loro sviluppo tra la 3° e la 4° settimana di gestazione. L’allineamento del bulbo oculare è determinato dalla componente muscolare estrinseca e dai tessuti molli ad esso circostanti.
La posizione del bulbo oculare all’interno della cavità orbitaria presenta una tipica deviazione, con un angolo di circa 23° tra l’asse anatomico bulbare e l’asse antero-posteriore dell’orbita; tale peculiare posizione permette di spiegare le varie azioni motorie esercitate da ogni singolo muscolo extra-oculare.
Cinque dei sei muscoli extra-oculari originano dall’apice orbitario, il muscolo piccolo obliquo origina dall’osso mascellare subito posteriormente al bordo orbitario.
I muscoli retti (superiore, inferiore, laterale e mediale) si inseriscono sulla sclera tramite strutture tendinee, anteriormente all’equatore del bulbo oculare; i muscoli obliqui, muscoli rotatori dell’occhio, si inseriscono posteriormente all’equatore; il muscolo obliquo inferiore si inserisce nel quadrante infero-laterale del bulbo senza una particolare struttura tendinea.
Fisiologia dei movimenti oculari
La posizione degli occhi è, per ciascuno di essi, regolata dai sei muscoli extra-oculari, i quali opportunamente innervati, permettono di dirigere lo sguardo in tutte le direzioni. Esistono fini meccanismi nervosi che regolano il movimento contemporaneo di tutti questi muscoli:
- la “legge dell’innervazione reciproca” (legge di Sherrington) afferma che durante una visione simultaneamente un muscolo riceve uno stimolo a contrarsi, mentre il suo antagonista riceve uno stimolo di uguale entità ma di tipo inibitorio;
- la “legge della corrispondenza motoria” (legge di Hering) afferma che gli impulsi a contrarsi sono inviati contemporaneamente a quei muscoli che compiono la stessa azione, cioè che fanno compiere movimenti coniugati ai due occhi.
Il mancato allineamento degli assi visivi comporta una condizione chiamata “strabismo”.
Una deviazione di questi assi che intervenga in età infantile ha effetti diversi da una che interviene in età adulta: il sistema visivo di un bambino non è completamente formato, e può mettere in atto meccanismi di compenso, come la “soppressione” dell’immagine e la “corrispondenza retinica anomala”. Nell’adulto non sono possibili riadattamenti neuro-sensoriali di questo tipo, con conseguente deviazione degli assi visivi, che genera diplopia e confusione.
Definizione e classificazione di strabismo e diplopia
La diplopia è la percezione di uno stesso oggetto in due diverse zone del campo visivo; viene distinta in monoculare (percepita con un solo occhio) e binoculare (percepita con l’utilizzo contemporaneo dei due occhi), e può presentarsi in senso orizzontale, verticale ed obliquo.
In condizioni fisiologiche, le immagini provenienti da uno stesso oggetto cadono su punti retinici corrispondenti dei due occhi, in modo tale che le due proiezioni retiniche dell’oggetto siano integrate, a livello della corteccia cerebrale in un’unica immagine con un processo chiamato “fusione”.
Per distinguere tra diplopia monoculare e binoculare è sufficiente occludere alternativamente i due occhi: se la diplopia scompare si è di fronte ad una forma binoculare, mentre se permane è una forma monoculare che interessa l’occhio non occluso.
La diplopia monoculare è spesso dovuta a problematiche riguardanti l’occhio interessato, tra cui anche patologie che interessano i mezzi diottrici (come la cataratta).
La principale causa di diplopia binoculare è lo strabismo, ma il disturbo può anche essere dovuto a traumi, malattie del sistema nervoso centrale (tumori, sclerosi multipla, ipertensione endocranica), malattie neuro-muscolari (come la miastenia gravis) o diabete mellito.
Lo strabismo può essere classificato secondo due criteri generali:
- per “posizione” che gli occhi assumono: orizzontale (convergente o divergente), verticale o ciclo-torsionale;
- per “entità della deviazione” nelle varie posizioni di sguardo: se uguale nelle varie posizioni, si parla di strabismo concomitante; se diversa, si parla di strabismo inconcomitante, ed in questo caso la deviazione è massima nel campo d’azione del muscolo deficitario.
Un'ulteriore distinzione, in rapporto allo stato manifesto della deviazione, permette di identificare uno strabismo manifesto (eterotropia) e uno latente (eteroforia): nelle eteroforie si ottiene il parallelismo degli assi visivi e la fusione delle immagini con un notevole sforzo dei muscoli extra-oculari, con conseguente affaticamento e cefalea; nelle eterotropie, invece, la deviazione degli assi visivi è sempre evidente.
In caso di strabismo convergente (dove gli assi visivi convergono) si parla di esodeviazione (esoforia se latente, esotropia se manifesto), mentre se è divergente (con assi visivi divergenti) si parla di exodeviazione (exoforia se latente, exotropia se manifesto). Per una deviazione verso l’alto si parla di ipertropia, per una verso il basso di ipotropia.
Esistono forme di pseudo-strabismo, dove particolari conformazioni delle orbite e la fisionomia del volto simulano deviazione dei bulbi oculari non esistenti. Le forme di pseudo-strabismo possono essere facilmente evidenziate rilevando i riflessi corneali centrati rispetto al campo pupillare.
Lo strabismo “concomitante” riconosce diverse cause, come ostacoli di tipo ottico (opacità dei mezzi diottrici o difetti refrattivi particolarmente elevati), ostacoli di tipo sensoriale (malattie della retina o del nervo ottico), problemi relativi all’innervazione dei muscoli extra-oculari (paralisi sopra-nucleari), o problemi relativi al meccanismo di accomodazione/convergenza.
Lo strabismo “inconcomitante” è, fondamentalmente, di tipo paralitico: le cause possono riguardare diverse strutture del sistema nervoso ed essere di varia natura (neoplastica, traumatica, vascolare, infettive, miastenia gravis e altre patologie autoimmuni, e metaboliche), oppure interessare direttamente particolari muscoli (come nel morbo di Graves-Basedow, con infiltrati che interessano il ventre muscolare e ne limitano la funzionalità).
Nelle forme inconcomitanti è presente, spesso, diplopia, alterata localizzazione degli oggetti nello spazio e torcicollo oculare (il soggetto assume particolari posizioni anomale del capo per compensare il deficit muscolare e non avere diplopia), con notevole discomfort per il soggetto.
A seconda della causa e della sua localizzazione, la paresi o la paralisi può colpire uno o più muscoli, con diversi quadri clinici.
In presenza di strabismi a grande angolo, cioè quando il bulbo oculare risulta particolarmente deviato, il paziente può non accusare diplopia, in quanto fisiologicamente viene attuato il fenomeno della soppressione oculare, cioè quel fenomeno di salvaguardia che permette, a livello celebrale, di “spegnere” l’immagine dell’occhio estremamente deviato, consentendo una visione monoculare che elimina il fenomeno della confusione alla base della diplopia.
Il fenomeno della diplopia risulta particolarmente invalidante per il paziente strabico, in quanto si trova sempre a dover cercare di comprendere quale delle due immagini percepite è quella reale e quale è quella gestita dall’occhio deviato.
Diagnosi di strabismo
Va fatta tenendo conto di vari fattori: l’età del paziente, la modalità di insorgenza e i disturbi associati, la presenza di eventuali deficit di refrazione (valutati in cicloplegia), l’acuità visiva, la presenza di eventuali deficit muscolari (singoli o multipli) e la loro entità.
Un test semplice e importante è il cover-test, che permette di capire se si tratta di deviazioni convergenti o divergenti e di distinguere tra forie e tropie; con i prismi (particolari lenti che permettono di deviare la luce verso una particolare direzione) si può eseguire il cover-test prismatico, con cui si può valutare l’entità della deviazione.
Il test della motilità oculare, attraverso la valutazione dell’escursione del bulbo verso le cosiddette “posizioni diagnostiche principali”, permette lo studio dell’attività di ogni singolo muscolo.
Lo schermo di Hess-Lancaster determina l’eventuale presenza di diplopia, l’entità della deviazione e, soprattutto, i muscoli interessati.
Semeiotica dello strabismo distiroideo
La limitazione della motilità oculare è dovuta al coinvolgimento infiammatorio dei muscoli extra-oculari, che aumentano fino ad otto volte rispetto alle dimensioni normali, come si può facilmente valutare sia soggettivamente, che mediante metodiche d’indagine quali ecografia o TC.
Si possono riconoscere tre fasi successive:
- una prima fase definita congestizia, in cui vi è infiltrazione da parte di cellule linfocitarie, proliferazione dei fibroblasti e deposizione di mucopolisaccaridi, con formazione di edema infiammatorio;
- segue una seconda fase, detta degenerativa, durante la quale si verifica la progressiva degenerazione delle fibre muscolari interessate, che perdono elasticità;
- infine, la fase di fibrosi muscolare, che rende il muscolo rigido e inestensibile. In caso di fibrosi marcata, il muscolo si accorcia, trascinando il bulbo oculare nella sua direzione di azione e determinando una deviazione oculare anche in posizione primaria di sguardo.
I muscoli più spesso coinvolti sono i retti mediali e inferiori.
Questa condizione, definita miopatia restrittiva, si manifesta con la paralisi dello sguardo verso l’alto, spesso monolaterale, dovuta alla contrattura fibrosa che impedisce la rotazione dell’occhio nella direzione opposta a quella del muscolo coinvolto, poiché esso non è più in grado di allungarsi (contrattura fibrosa del retto inferiore, che simula una paralisi del retto superiore), e con visione offuscata, diplopia e sensazione di limitazione dei movimenti oculari.
I disturbi oculomotori che si rilevano nell’orbitopatia tiroide-correlata sono comunemente non concomitanti, in quanto l’angolo di strabismo risulta differente nelle varie posizioni di sguardo. La caratteristica di non concomitanza può avere la sua origine o su base paralitica oppure restrittiva: nella forma di tipo paralitico la causa risiede in un'insufficiente contrazione, mentre nelle forme restrittive è presente un ostacolo di natura meccanica, che permette lo scorrimento muscolare all’interno dell’orbita stessa.
Il tessuto muscolare dei muscoli oculomotori affetti da orbitopatia tiroide-correlata è coinvolto quindi da un fenomeno infiammatorio, seguito da fibrosi con conseguente rigidità muscolare, incapacità alla contrazione e ipomobilità del bulbo oculare. In tal caso si assiste a una restrizione della rotazione bulbare in direzione opposta all’azione muscolare del muscolo coinvolto, incapace di contrarsi. Nel caso in cui il muscolo antagonista non presenti alterazioni, a seguito della sua contrazione si determina un enoftalmo, con associato ipertono oculare da compressione esterna.
Nei casi di grave entità, in cui la componente muscolare risulta particolarmente compromessa, il paziente presenta un ampio angolo di deviazione anche in posizione primaria, con diplopia praticamente sempre presente.
Nello strabismo tiroide-correlato è di estrema importanza porre una corretta diagnosi differenziale tra strabismo restrittivo e strabismo paralitico, anche in funzione di una pianificazione del trattamento chirurgico. Il test delle duzioni forzate permette di rilevare una limitazione passiva dei movimenti del globo oculare. Il test si esegue anestetizzando la superficie oculare e muovendo il bulbo oculare con una pinza dentata per valutarne motilità, resistenza ed eventuali limitazioni. Durante tale test, è estremamente importante agire in direzione opposta a quella in cui si sospetta la limitazione meccanica, non premendo sul bulbo; pressioni eccessive o manovre troppo energiche possono rendere difficoltosa l’interpretazione del test, rendendone vana l’esecuzione.
L’orbitopatia di Graves fa parte delle malattie autoimmunitarie e determina edema peri-orbitario, ispessimento marcato dei muscoli extra-oculari, proptosi, retrazione palpebrale, aumento della pressione endo-oculare fino alla neuropatia ottica.
Le alterazioni della motilità oculare di maggiore riscontro si caratterizzano per una limitazione della motilità in uno o in entrambi gli occhi; la limitazione dell’elevazione è di gran lunga fra i più comuni deficit della motilità, seguita dalla limitazione dello sguardo orizzontale. Il muscolo retto laterale è solitamente il meno compromesso.
Una delle principali manifestazioni della patologia tiroide-correlata, è la retrazione della palpebra superiore, di solito causata da iperstimolazione simpatica. Contrariamente alla convinzione comunemente diffusa, la retrazione palpebrale, e non la proptosi, è il segno patognomonico più frequente dell’orbitopatia di Graves. La retrazione palpebrale si presenta con il segno di Dalrympe, una retrazione della palpebra superiore e/o inferiore, con edema e ispessimento delle stesse ed è responsabile di problemi funzionali ed estetici a seconda del suo grado di gravità.
I meccanismi responsabili di tale manifestazione clinica non sono ancora del tutto chiari, ma si suppone che siano rappresentati sia dall’incremento dei livelli circolanti di ormone tiroideo e dall'aumentata stimolazione simpatica del muscolo di Muller, sia dalla fibrosi causata dall’infiltrazione muscolare da parte di linfociti e fibroblasti con conseguenti esiti cicatriziali.
Per la valutazione della retrazione palpebrale si tiene conto della posizione delle palpebre in posizione primaria di sguardo. La posizione di entrambe le palpebre viene misurata in riferimento al limbus sclero-corneale, che in condizioni fisiologiche è coperto dalla palpebra superiore e lambito solo marginalmente da quella inferiore.
La retrazione palpebrale va sempre distinta dalla pseudo-retrazione dovuta alla proptosi bulbare, all’uso di farmaci simpatico-mimetici, alle alterazioni del mesencefalo, come nel caso della sindrome di Parinaud (nota anche come sindrome del mesencefalo dorsale, una malattia neurologica causata da una lesione a carico del tetto del mesencefalo), e ad altre patologie meno frequenti.
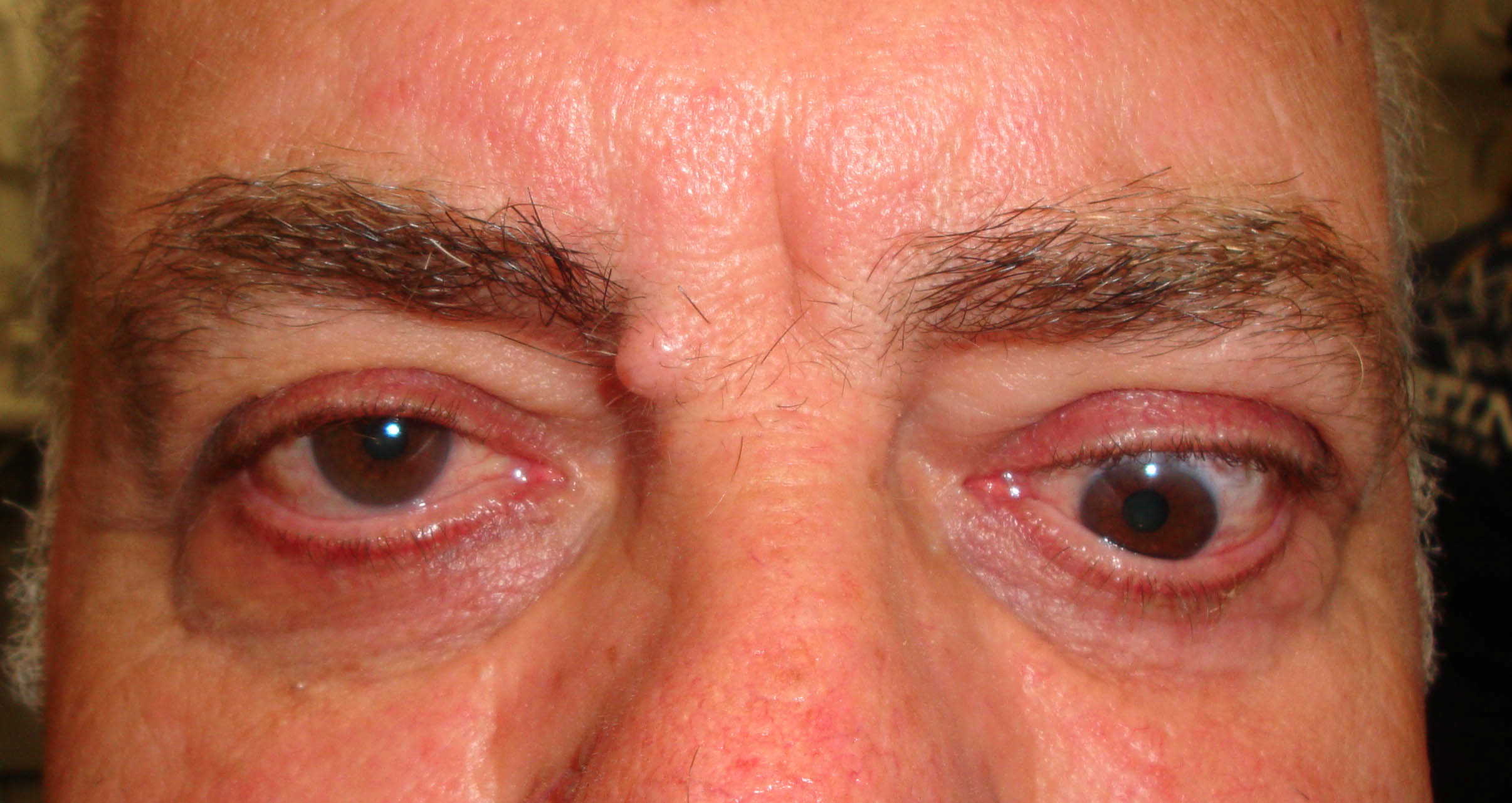
Figura 1
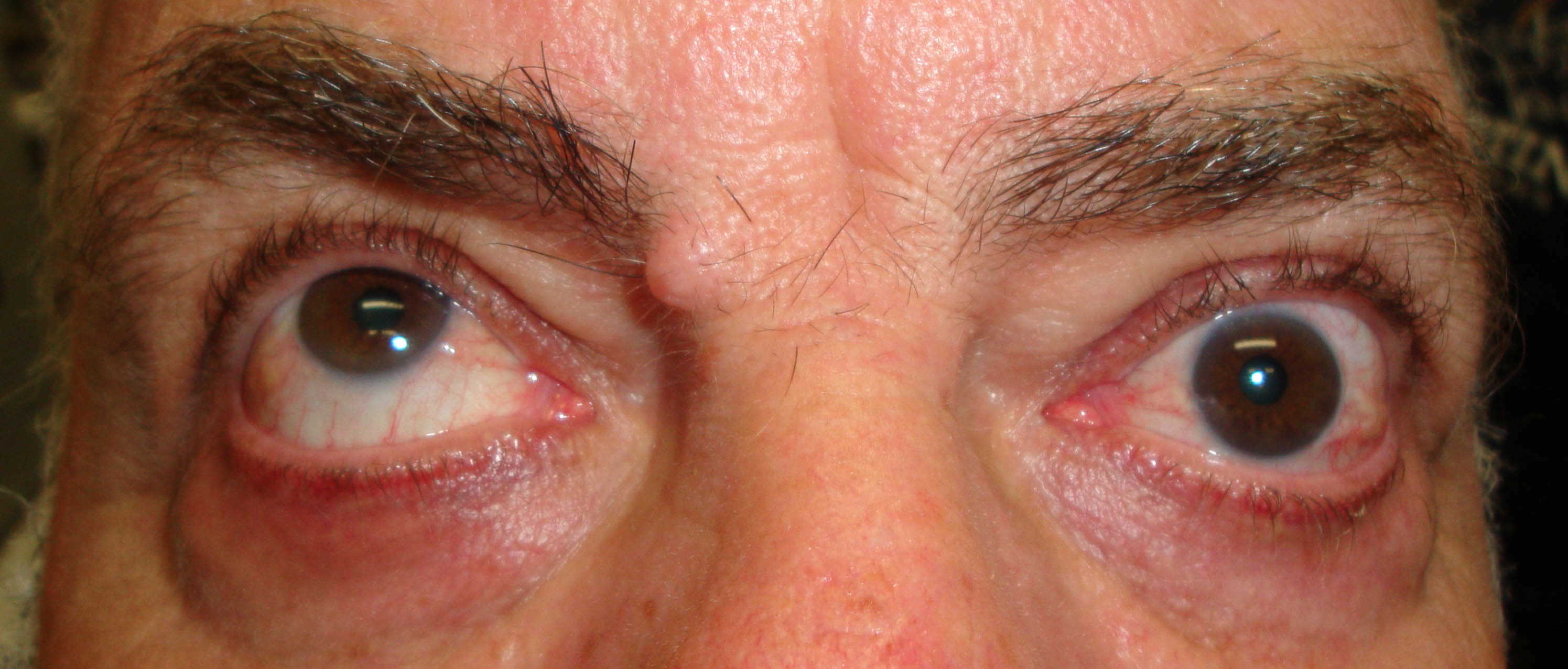
Figura 2
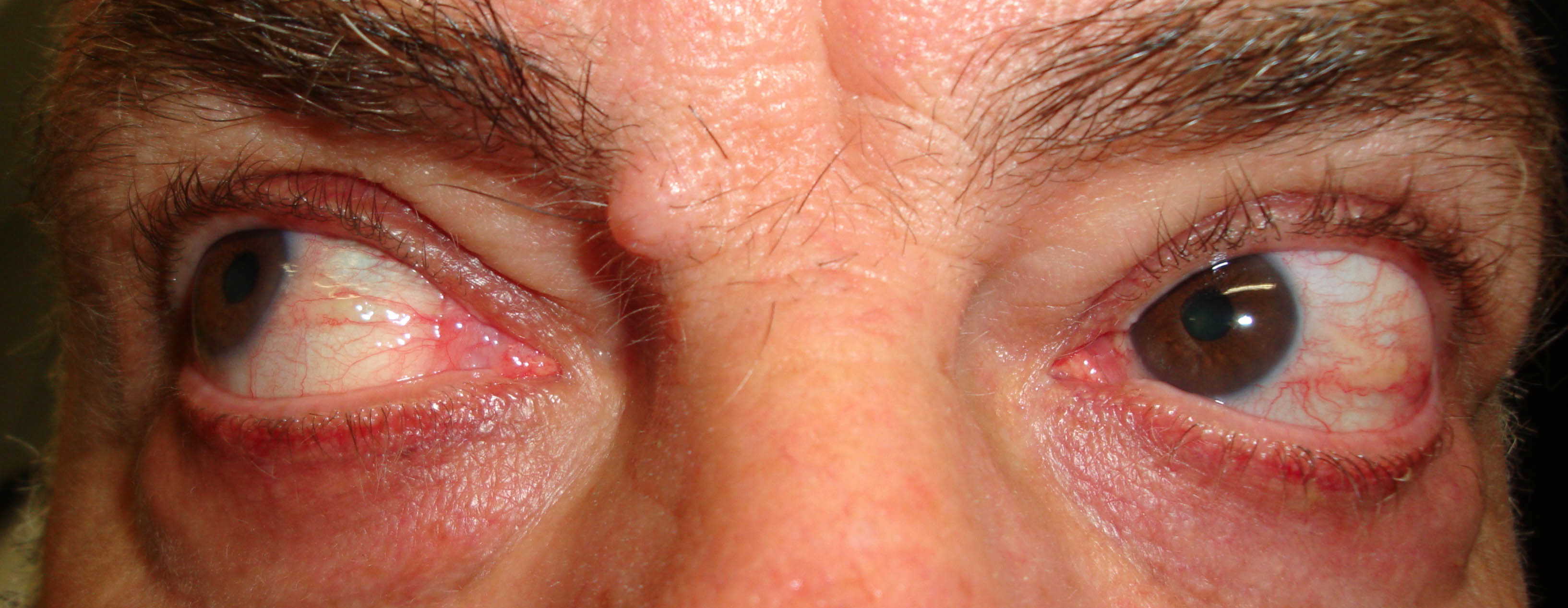
Figura 3
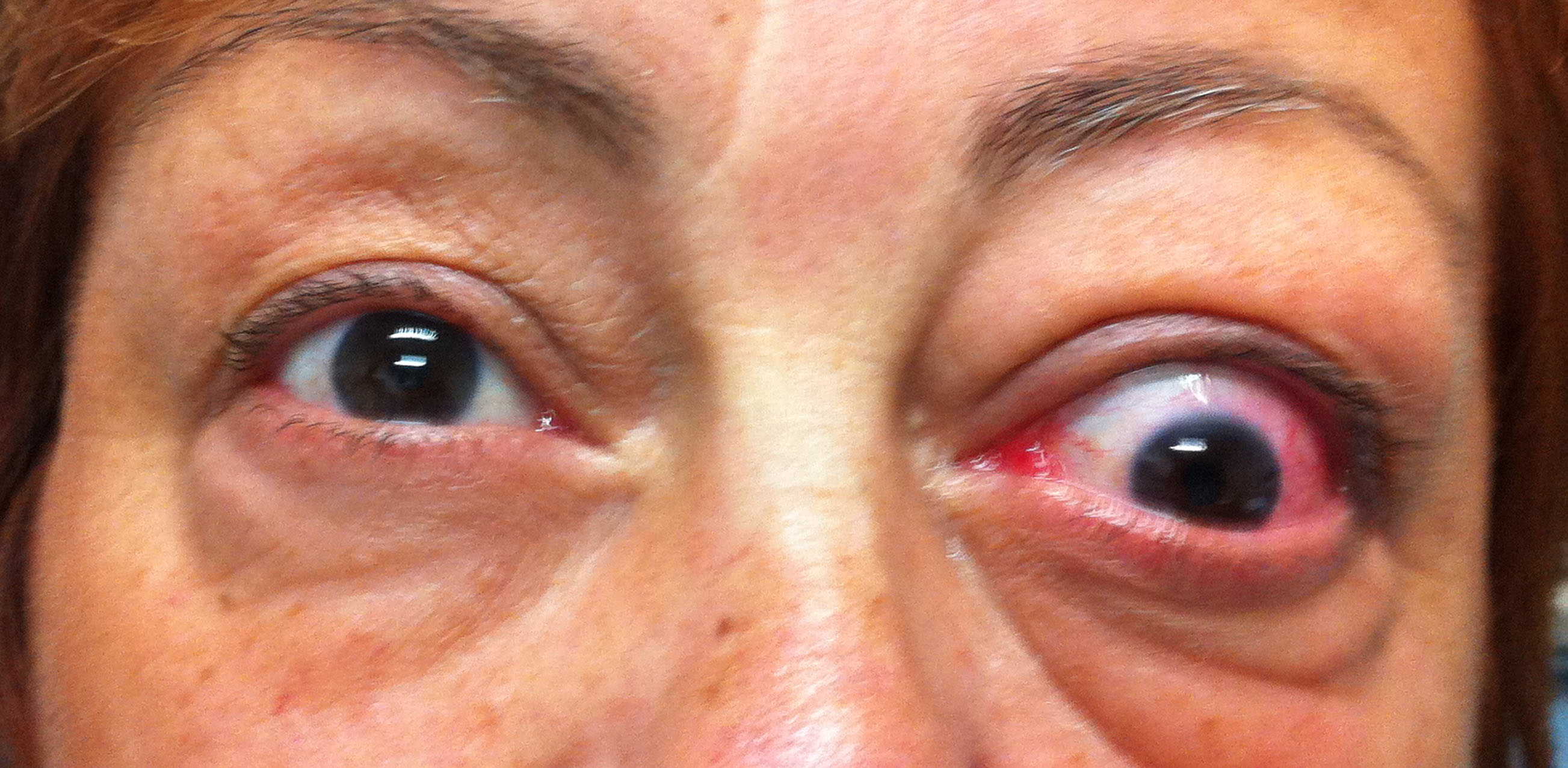
Figura 4
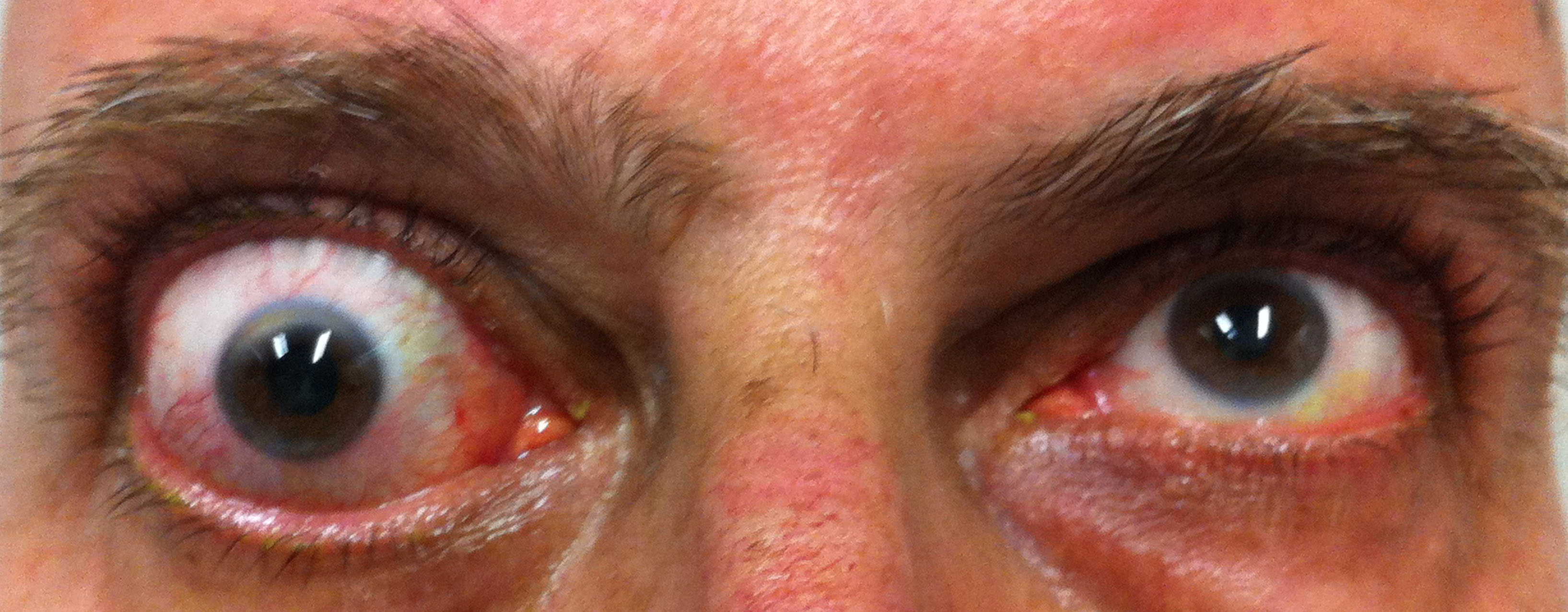
Figura 5
Figure 1-5. Esame della motilità oculare in pazienti affetti da orbitopatia di Graves: evidente l'alterazione della motilità verticale con deficit di elevazione.
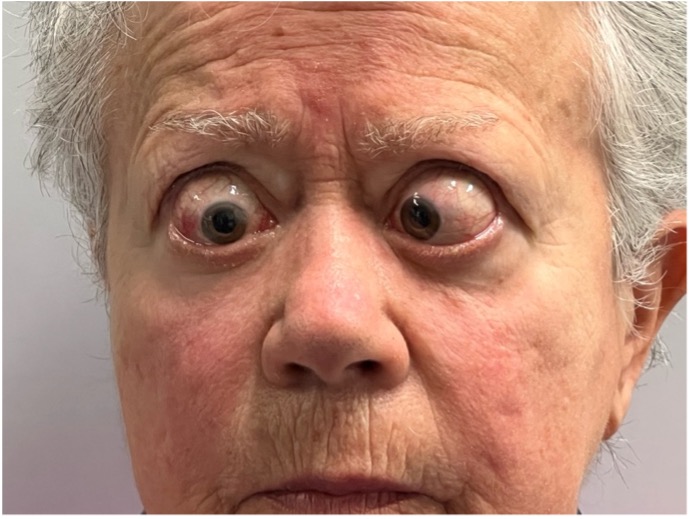
Figura 6
Paziente affetta da importante esoftalmo bilaterale associato a retrazione della palpebra superiore con strabismo convergente
L’ortottica è la scienza che, con le sue regole e con esami specifici, quale lo schermo di Hess, permette di valutare il paziente strabico, rilevando quale è il miglior trattamento medico o chirurgico da mettere in atto. Dopo attenta valutazione ortottica, preceduta talvolta anche da uno studio neuroradiologico dell’orbita, è possibile identificare qual è il muscolo che maggiormente determina la diplopia.
In presenza di piccole compromissioni della muscolatura, il paziente mette in atto alcune posture definite PAC, o anomala posizione del capo, che gli consentono di ridurre o addirittura annullare la visione doppia. Ad esempio, nel caso in cui un bulbo oculare presenta un coinvolgimento del muscolo retto inferiore, con conseguenza impossibilità a elevare l’occhio, il paziente tenderà a elevare il mento e il capo per permettere anche all’altro occhio di posizionarsi verso il basso, annullando in questo modo la diplopia.
Scopo dell’ortottica è cercare di identificare il muscolo compromesso e riuscire a generare un visione singola attraverso lenti particolari definite “prismi”. I prismi sono lenti molto particolari, in grado di spostare l’immagine vista dal paziente a livello del piano retinico. Questo consente di ridurre o addirittura annullare la diplopia nei casi in cui le due immagini percepite dal paziente risultino non particolarmente distanti tra loro. Questo non significa che è sempre possibile utilizzare lenti prismatiche per ridurre la diplopia, in quanto queste particolari lenti non sono sempre tollerate dal paziente.
In presenza di contemporanei strabismi sia verticali che orizzontali, la possibilità di correggere contemporaneamente la visione doppia risulta molto difficile, in quanto i prismi agiscono solamente su un asse di deviazione. Nei casi in cui non è possibile l’utilizzo delle lenti prismatiche l’unica modalità per ridurre la diplopia in questi pazienti risulta l’intervento chirurgico. Scopo dell’intervento è permettere la riunificazione delle immagini dei due occhi, cercando di eliminare la confusione generata dalla diplopia. Dal punto di vista chirurgico, è possibile agire soltanto su due o al massimo tre dei sei muscoli extra-oculari, in quanto attraverso le inserzioni tendinee dei muscoli extra-oculari penetrano all’interno dell’occhio le arterie ciliari, che servono a gestire la vascolarizzazione di tutta la porzione anteriore dell’occhio. Quando si eseguono interventi a livello della muscolatura estrinseca, si interagisce con le inserzioni tendinee dei muscoli, recidendo quindi la componente vascolare. Si comprende quindi che non è possibile agire su molti muscoli, in quanto, a seguito della resezione della componente vascolare associata alle inserzioni tendinee dei muscoli, si possono determinare fenomeni ischemici a livello dell’occhio.
La valutazione ortottica pre-operatoria deve cercare di identificare quale o quali sono i muscoli extra-oculari maggiormente responsabili della diplopia. Solitamente si viene a determinare un fenomeno di tipo restrittivo, quindi il muscolo che non si rilassa non consente la rotazione del bulbo oculare. La valutazione dell’angolo di diplopia, espressa in diottrie prismatiche, consente di concretizzare un piano operatorio, che prevede il distacco del muscolo dalla sua fisiologica inserzione e la sua riapposizione più posteriormente, nel caso il muscolo determini una sindrome restrittiva, o più anteriormente, nel caso in cui sia presente una ipofunzione muscolare.
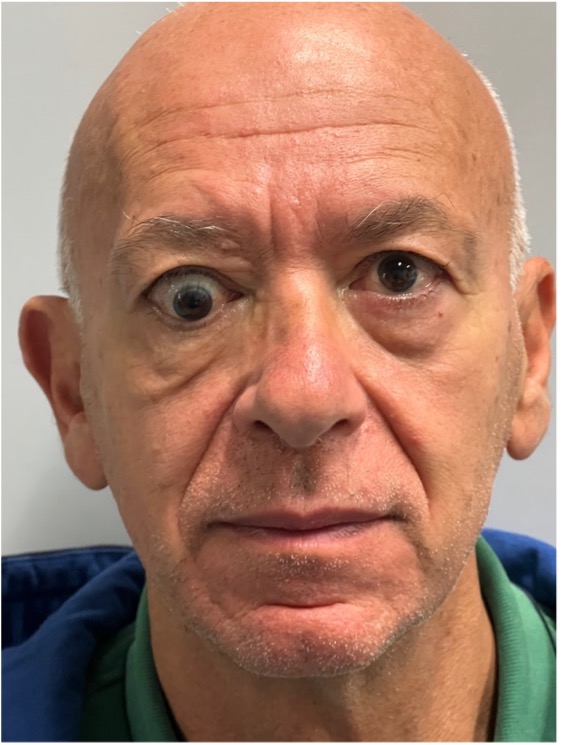
Figura 7
Strabismo verticale insorto dopo chirurgia decompressiva dell’orbita

Figura 8
Strabismo orizzontale insorto dopo chirurgia decompressiva dell’orbita
Trattamento chirurgico dello strabismo
L’intervento chirurgico di strabismo può essere eseguito sia in anestesia locale che in anestesia generale. L’anestesia locale consente la valutazione intra-operatoria degli assi visivi, mentre nel caso di anestesia generale questa valutazione non è eseguibile, non avendo il paziente la fissazione del controlaterale. Non tutti gli interventi chirurgici possono essere eseguiti in anestesia locale, in quanto in presenza di grosse alterazioni della motilità, il bulbo oculare, durante l’intervento chirurgico, viene stirato in vario modo e si potrebbe generare dolore particolarmente forte.
Nel caso in cui venga scelto di eseguire l’intervento chirurgico in anestesia generale, è possibile eseguire il test della duzione forzata, che, mentre il paziente è privo di coscienza, permette di valutare se sono presenti restrizioni ai movimenti oculari determinati da una compressione del bulbo oculare dall’esterno. Questo test permette quindi di differenziare se lo strabismo è determinato da ipofunzione muscolare o da affollamento dell’orbita che causa incapacità rotatorio del bulbo oculare.
Gli obiettivi della chirurgia sono:
- normalizzare lo sguardo in posizione primaria, sia nella fissazione per vicino che per lontano;
- consentire la fusione massima, sia per vicino che per lontano.
Lo scopo del trattamento chirurgico nello strabismo paralitico è essenzialmente funzionale, mirato a ripristinare la visione binoculare, almeno in alcune posizioni di sguardo. Non è possibile in alcun modo riuscire a ristabilire completamente la visione binoculare “in tutte le posizioni di sguardo” e cioè in tutte le posizioni di lateralità o di elevazione che è possibile generare grazie all’uso di tutti e sei i muscoli extra-oculari nella normale fisiologia della visione binoculare.
I principi chirurgici sono:
- rinforzare il muscolo deficitario;
- indebolire l’antagonista omolaterale iperfunzionante;
- rinforzare l’agonista controlaterale;
- eventuali interventi di supplenza del muscolo deficitario da parte degli altri muscoli extra-oculari non coinvolti.
L’entità della correzione chirurgica dei muscoli extra-oculari risulta non del tutto prevedibile in termini di rapporto tra millimetri di recessione o resezione e diottrie prismatiche di strabismo corrette o da correggere.
I risultati chirurgici dipendono da numerosi fattori:
- tipo di tecnica chirurgica;
- tipo di esposizione del muscolo;
- accuratezza dell’isolamento del ventre muscolare con liberazione di eventuali briglie aderenziali o tendini di arresto;
- corretto posizionamento dei punti di sutura, sia a livello del tendine muscolare che apposizione più o meno serrata a livello sclerale.
Fattore di estremo rilievo nella diplopia basedowiana è l'alterata costituzione anatomica muscolare, con fenomeni fibrotici indotti che compromettono definitivamente la contrazione dei vari metameri. È ormai noto che interventi chirurgici di indebolimento (recessione muscolare) risultano più efficaci degli interventi di rafforzamento muscolare; si afferma quindi che sono necessari quantità più grandi di resezione per produrre un effetto pari a quello che si ottiene con la recessione dell’antagonista.
Da quanto esposto si può facilmente dedurre che non è possibile utilizzare un'unica affermazione con la quale si possa ottenere una corretta resezione o recessione in tutti i pazienti. La quantità di correzione deve essere distribuita su tutti i muscoli extra-oculari secondo un determinato programma chirurgico, in modo tale da rendere simmetrica l’azione dei singoli muscoli sinergici e antagonisti, modulando l’ampiezza dell’atto operatorio in modo del tutto soggettivo, in rapporto all’esperienza chirurgica di ciascun operatore.
Gli interventi a livello dei muscoli oculari possono determinare un indebolimento dell’azione del muscolo o eventualmente un suo rafforzamento. Gli interventi di recessione, dove il muscolo viene spostato più posteriormente rispetto alla sua fisiologica inserzione, consentono di ridurre l’azione di un muscolo. Interventi come le retropessie di un muscolo non hanno particolari indicazioni in questo tipo di patologia. Talvolta può essere utile eseguire una miotomia marginale, cioè eseguire delle incisioni a livello del muscolo, diminuendo così la sua forza contrattile e determinandone l’indebolimento per la riduzione del numero degli elementi contrattili, senza modificare il contatto tra il muscolo il globo oculare. Svantaggio di questa tecnica è che le alterazioni determinate da una miotomia a livello del muscolo risultano irreversibili con perdita di forza contrattile, mentre in presenza di una recessione si può sempre riposizionare il muscolo nella sua fisiologica inserzione.
Una tipologia di intervento chirurgico adottato in casi molto limitati è la resezione muscolare aggiustabile, tecnica chirurgica dove è possibile applicare dei fili di sutura con una particolare annodatura sulla superficie esterna del bulbo oculare, che consente eventualmente di allentare o stringere maggiormente le suture per modificare l’azione muscolare nel caso in cui, il giorno dopo l’intervento, si dovesse notare una non adeguata correzione dello strabismo. Tale tecnica chirurgica è stata ultimamente abbandonata e viene riservata solo a casi molto particolari di interventi sul muscolo retto laterale.
In questo tipo di patologia non è possibile eseguire interventi chirurgici quali le supplenze muscolari e le duplicazioni del muscolo, a causa dell’alterazione della componente istologica del muscolo stesso.
Bisogna sempre informare il paziente che gli interventi chirurgici di strabismo hanno il compito di cercare di stabilire il miglior parallelismo nello sguardo in posizione primaria. È necessario far comprendere che talvolta potranno essere necessari anche due interventi, perché, in presenza di quadri particolarmente complessi, la gestione tramite approcci chirurgici successivi permette una miglior calibrazione.
Le sindromi restrittive non sono sempre prevedibili come risultato post-operatorio, in quanto proprio le modifiche strutturali che hanno coinvolto i singoli muscoli non permettono di ipotizzare il risultato chirurgico con assoluta certezza.
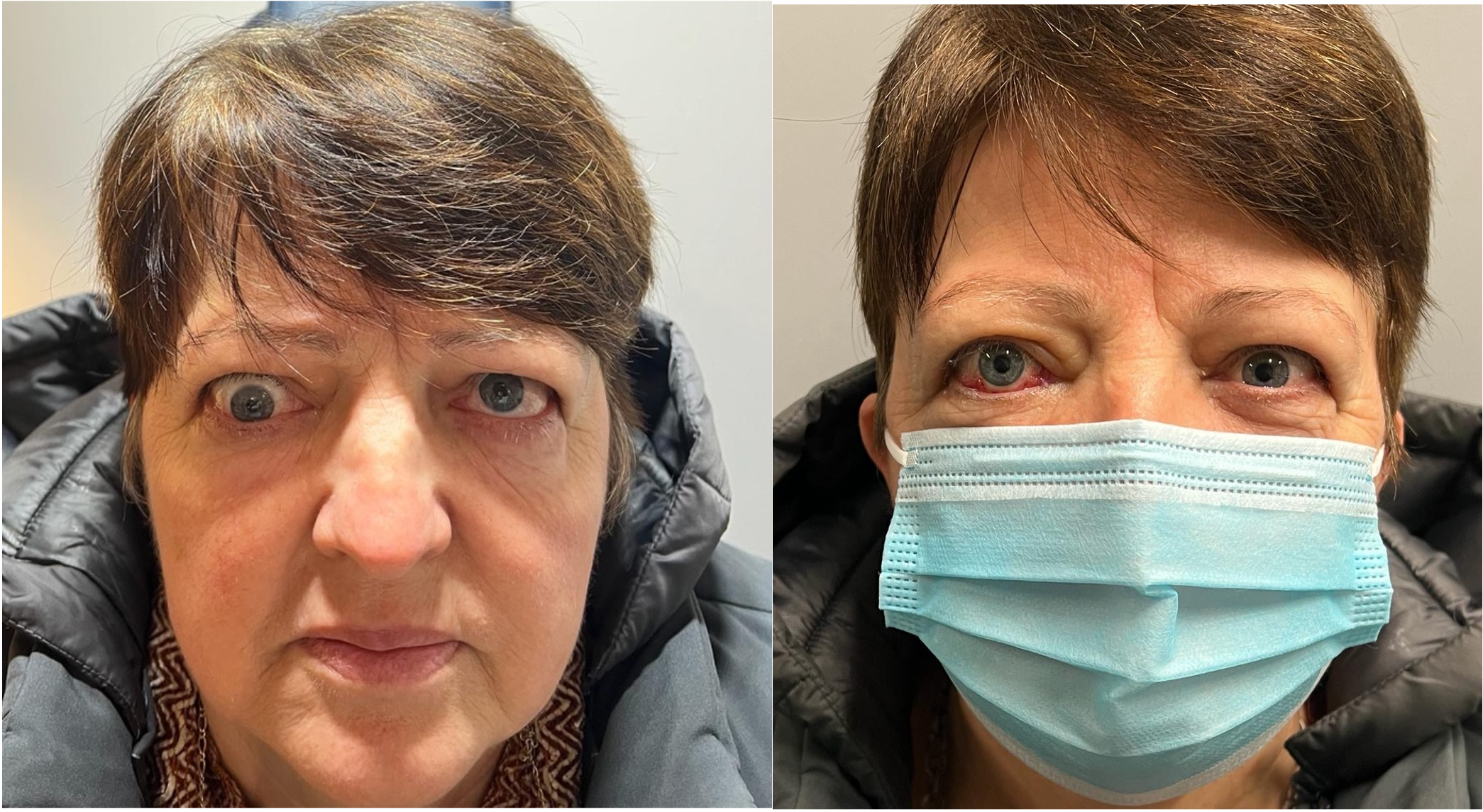
Figura 9
A sinistra strabismo verticale restrittivo con deficit di elevazione dell’occhio destro.
A destra valutazione post-operatoria (eseguita recessione indebolimento del muscolo retto inferiore dell’occhio destro).
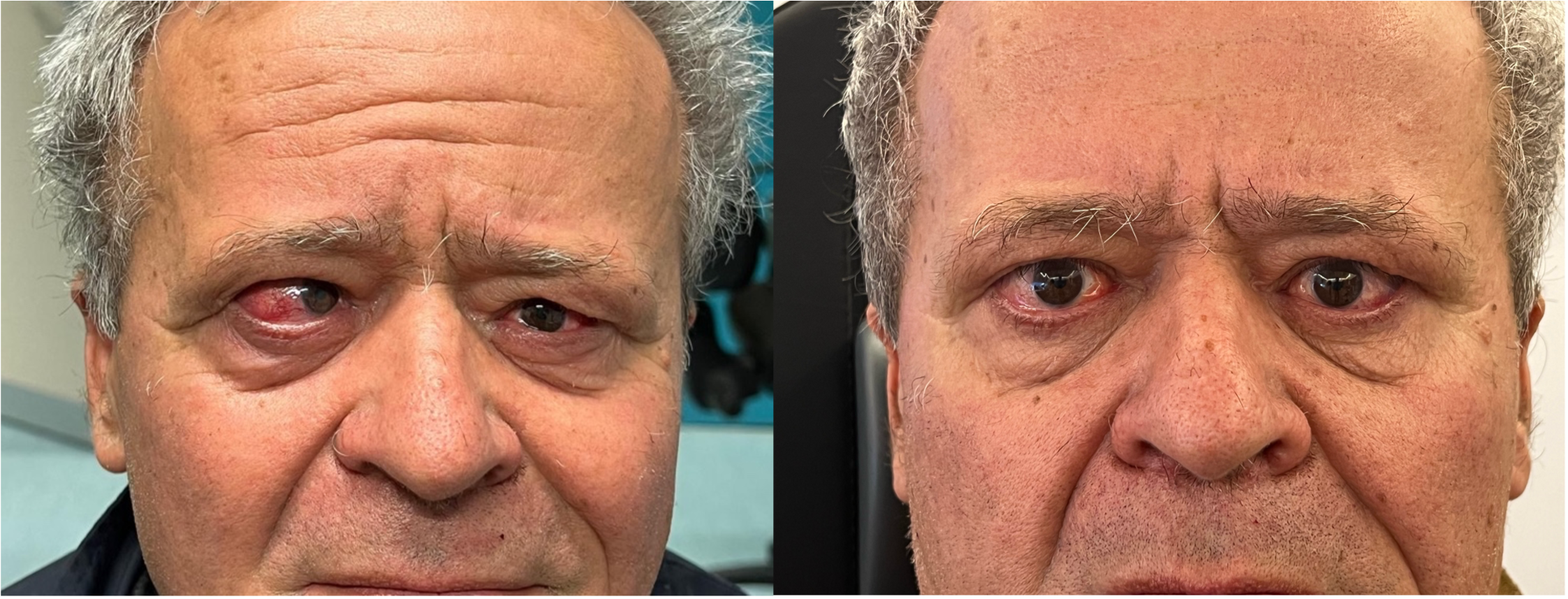
Figura 10
Strabismo orizzontale post decompressione: valutazione pre- e post chirurgia dello strabismo
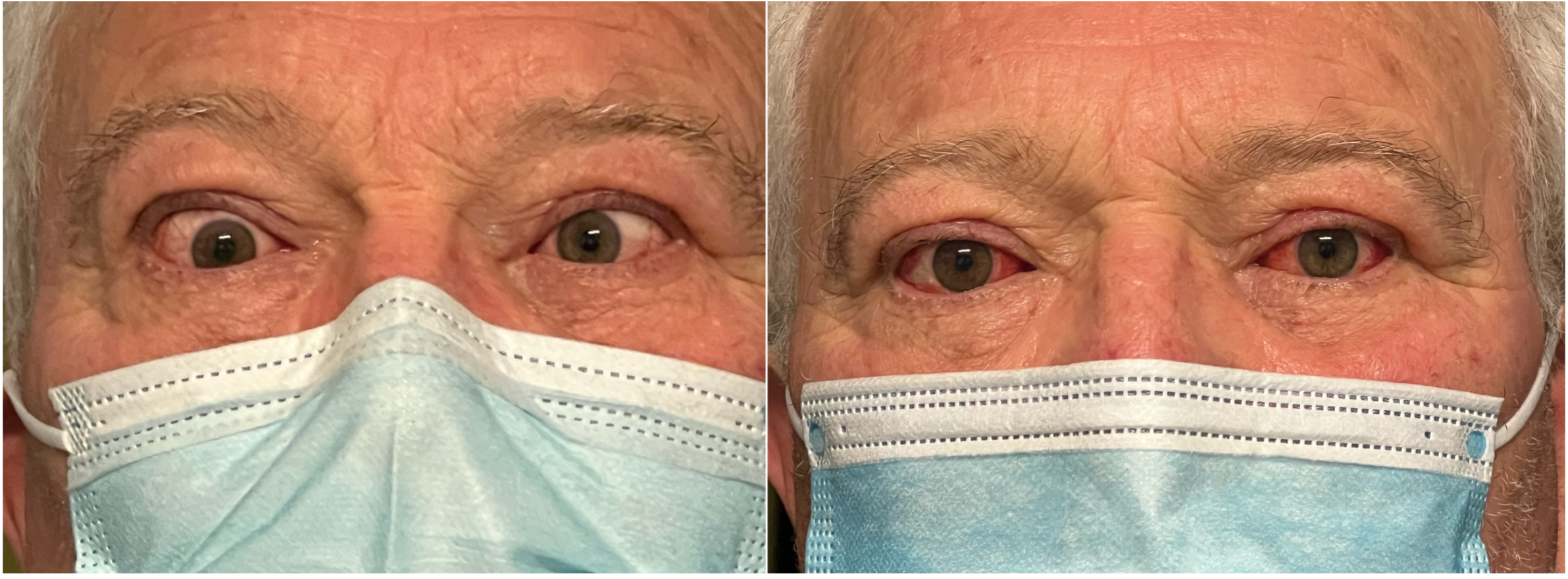
Figura 11.
A sinistra valutazione pre-operatoria dello strabismo post decompressione: strabismo convergente bilaterale.
A destra valutazione post-operatoria dopo intervento di indebolimento (recessione) bilaterale dei muscoli retti mediali.
Bibliografia
- Lyons CJ, Rootman J. Strabismus in Graves' orbitopathy. Pediatr Endocrinol Rev 2010, 7 suppl 2: 227-9.
- Jellema HM, Braaksma-Besselink Y, Limpens J, et al. Proposal of success criteria for strabismus surgery in patients with Graves' orbitopathy based on a systematic literature review. Acta Ophthalmol 2015, 93: 601-9.
- Jellema HM, Eckstein A, Oeverhaus M, et al. Incidence of A pattern strabismus after inferior rectus recession in patients with Graves' orbitopathy: a retrospective multicentre study. Acta Ophthalmol 2023, 101: e106-12.
Chirurgia palpebrale per l'orbitopatia di Graves
Stefano Amodeo, Enrica Fiesoletti, Gianmario Anselmi, Pasquale Plateroti
Facoltà di Medicina e Psicologia UOC di Oftalmologia, Università di Roma Sapienza; Ospedale Sant'Andrea di Roma
(aggiornato al 6 marzo 2018)
La retrazione palpebrale rappresenta una condizione clinica che provoca aumento dell’ampiezza della fessura palpebrale, con conseguente esposizione della sclera. Può presentarsi con uguale frequenza mono o bilateralmente ed è caratterizzata dall'elevazione della palpebra superiore o dall'abbassamento della palpebra inferiore oltre il livello considerato normale (1-2 mm al di sotto del limbus corneale superiore o al di sopra al livello del limbus corneale inferiore, rispettivamente).
Oltre a cause congenite, neurogene o miogene, la retrazione palpebrale tende ad instaurarsi con maggiore frequenza in pazienti con orbitopatia in corso di disfunzioni tiroidee, e soprattutto in caso di m. di Graves. In questo caso può essere associata in modo variabile a un eventuale esoftalmo, che ne aumenta la significatività clinica, determinando ulteriore esposizione sclerale (1). Di notevole importanza clinica è quindi valutare quanto dell’aspetto del paziente è determinato dall’esoftalmo e quanto dalla retrazione palpebrale inferiore o più comunemente superiore.
L’alterazione della motilità palpebrale è determinata da un’alterazione dei muscoli retrattori palpebrali, sia superiori che inferiori. Caratteristico segno da ricercare per porre corretta diagnosi è il segno di Graefe (il cui eponimo è derivante dall’oftalmologo tedesco Albert von Graefe), che si caratterizza per un totale immobilità o ipomobilità della palpebra superiore nello sguardo in basso: chiedendo al paziente di guardare verso il basso seguendo una mira di fissazione si assiste a una parziale o totale assenza dell’abbassamento della palpebra superiore come fisiologicamente dovrebbe verificarsi. Tale fenomeno nelle fasi iniziali della malattia è da attribuirsi ad un’anomala risposta simpatico-mimetica dei muscoli palpebrali. Nelle fasi successive, con il progredire della patologia generale, si rileva una fibrosi del muscolo elevatore della palpebra e degli altri muscoli estrinseci oculari.
Le indagini di primo livello consistono nell’eseguire una visita oculistica, che permetta di escludere eventuali sofferenze corneali (cheratite corneale, ulcere corneali, ascessi corneali), e una visita ortottica, che permetta di valutare correttamente la motilità extra-oculare analizzando statica e dinamica palpebrale, attraverso la misurazione delle aperture corneali nelle varie posizioni di sguardo.
La presenza di sofferenza corneale, determinata dalla retrazione palpebrale in associazione più o meno evidente ad esoftalmo, rappresenta l’indicazione principale all’esecuzione dell’intervento chirurgico, che permette di ristabilire sia una normale dinamica palpebrale che un migliore aspetto del paziente: deve essere eseguito in sala operatoria in anestesia locale, talvolta associata a sedazione cosciente; è molto raro che sia necessaria l’anestesia generale.
Lo scopo dell’intervento è quello di migliorare la posizione della palpebra inferiore e, se possibile, ristabilirne la posizione originaria. Le tecniche proposte per migliorare la funzionalità della palpebra superiore risultano molteplici in funzione di quanto bisogna allungare la palpebra superiore. È possibile eseguire interventi di indebolimento del muscolo elevatore e/o del muscolo di Müller (palpebra superiore) e dei muscoli retrattori inferiori (palpebra inferiore) (2-3). L’escissione del solo muscolo di Müller determina un abbassamento della palpebra superiore di circa 2-3 mm. Per ottenere un abbassamento della palpebra leggermente superiore, si può scegliere di eseguire anche una recessione dell’aponeurosi muscolare. Per correggere la retrazione della palpebra inferiore si possono utilizzare innesti di palato duro o eventualmente innesti di sclera. In quei casi in cui il paziente presenta una retrazione palpebrale di grado severo, si ricorre all'inserimento di particolari spaziatori, costituiti da materiale autologo o non-autologo. Il materiale autologo può essere ricavato dalla mucosa del palato duro (4-6), dalla cartilagine auricolare (7), dalla congiuntiva tarsale (8,9) e dalla mucosa buccale (10). Spaziatori di materiale eterologo (11-14) sono, invece, costituiti da materiali sintetici, quali politetrafluoro-etilene (Gortex) e mesh poliestere (Mersilene), o ottenuti da sclera proveniente da donatore. Quest'ultima procedura riconosce come primo fattore avverso il rischio di trasmissione di HIV ed altri lentivirus, ed è spesso non accettata dal paziente.
In casi gravi di lagoftalmo in presenza di patologia tiroidea attiva si possono impiantare pesi d’oro, ben calibrati in rapporto alla necessità del singolo paziente. Tale metodica, totalmente reversibile in funzione dello stato della patologia generale, può essere utilizzata temporaneamente in previsione di un successivo intervento chirurgico a livello muscolare.
Le diverse opzioni chirurgiche sono in relazione al tipo di retrazione e al grado di funzionalità dei retrattori palpebrali.
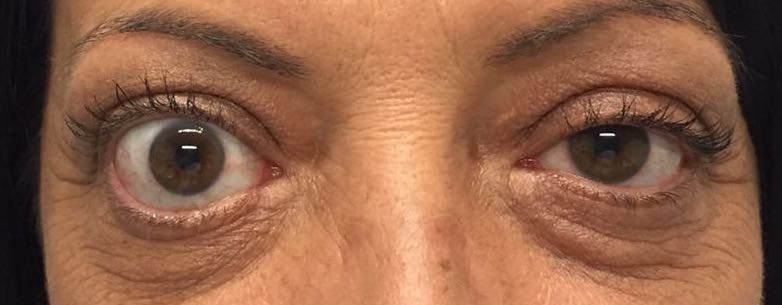
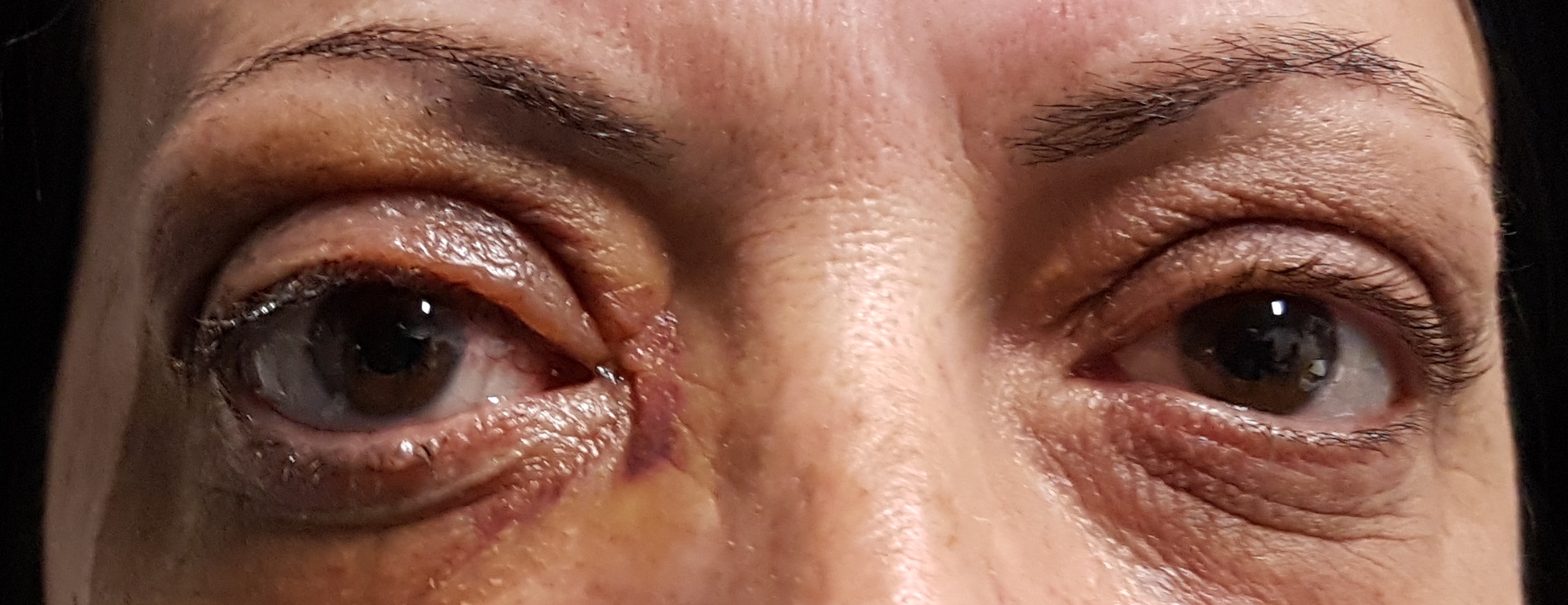
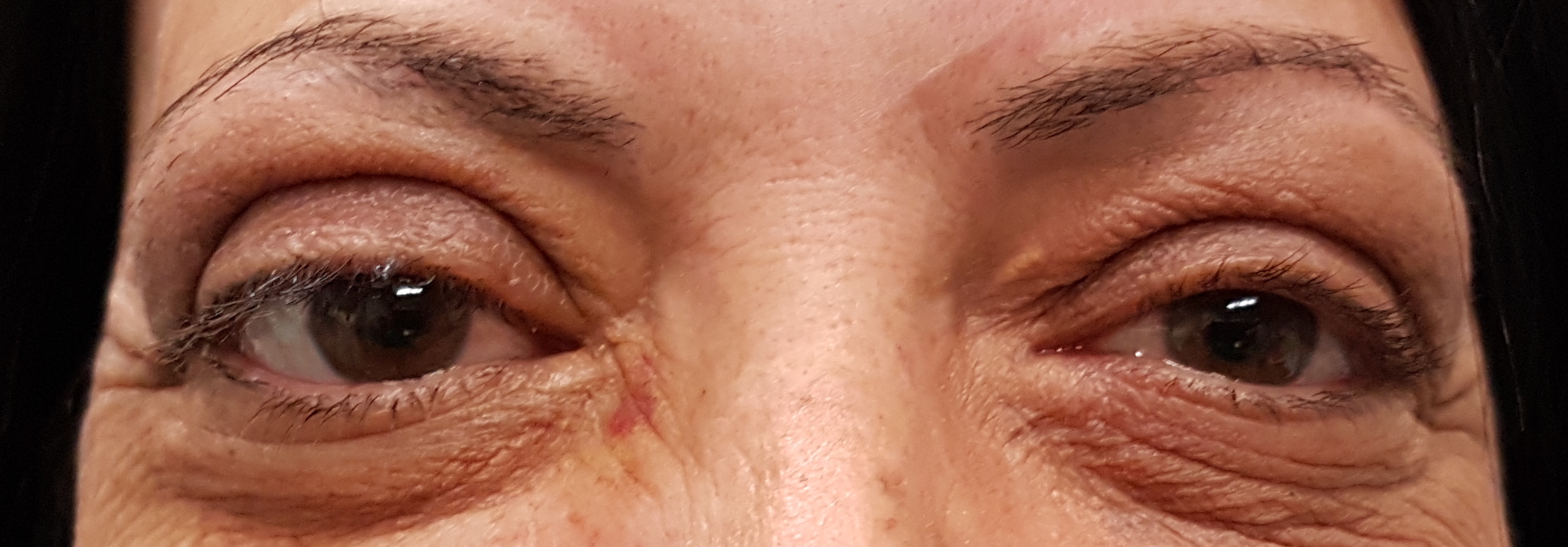
In alto immagine pre-operatoria, in mezzo dopo 24 ore dall'intervento e sotto a una settimana
Bibliografia
- Bartley GB, Fatourechi V, Kadrmas EF, et al. Clinical features of Graves ophthalmopathy in an incidence cohort. Am J Ophthalmol 1996, 121: 284-90.
- Hawes MJ, Dortzbach RK. The microscopic anatomy of the lower eyelid retractors. Arch Ophthalmol 1982, 100: 1313-8.
- Goldberg RA, Lufkin R, Farahani K, et al. Physiology of the lower eyelid retractors: tight linkage of the anterior capsulopalpebral fascia demonstrated using dynamic ultrafine surface coil MRI. Ophthalmic Plast Reconstr Surg 1994, 10: 87-91.
- Bartley GB, Kay PP. Posterior lamellar eyelid reconstruction with a hard palate mucosal graft. Am J Ophthalmol 1989, 107: 609-12.
- Kersten RC, Kulwin DR, Levartovsky S, et al. Management of lower-lid retraction with hard-palate mucosa grafting. Arch Ophthalmol 1990, 108: 1339-43.
- Cohen MS, Shorr N. Eyelid reconstruction with hard palate mucosa grafts. Ophthalmic Plast Reconstr Surg 1992, 8: 183-95.
- Marks MW, Argenta LC, Friedman RJ, Hall JD. Conchal cartilage and composite grafts for correction of lower eyelid retraction. Plast Reconstr Surg 1989, 83: 629-35.
- Gardner TA, Kennerdell JS, Buerger GF. Treatment of dysthyroid lower lid retraction with autogenous tarsus trasplants. Ophthalmic Plast Reconstr Surg 1992, 8: 26-31.
- Shaw GY, Khan J. The management of ectropion using the tarsoconjunctival composite graft. Arch Otolaryngol Head Neck Surg 1996, 122: 51-5.
- Whitehouse GM, Francis IC. Eyelid reconstruction using a monopedicle flap and buccal mucosa: report of 15 cases. Aust NZ J Ophthalmol 1988, 16: 295-301.
- Henderson JW. Relief of eyelid retraction. A surgical procedure. Arch Ophthalmol 1965, 74: 205-16.
- Waller RR. Lower eyelid retraction: management. Ophthalmic Surg 1978, 9: 41-7.
- Waller RR, Samples JR, Yeatts RP. Eyelid malposition in Graves' ophthalmopathy. In: Gorman AL, et al. The eye and orbit in thyroid disease. 1st ed. New York: Raven Press, 1984: 263-300.
- Holds JB, Anderson RL, Thiese SM. Lower eyelid retraction: a minimal incision surgical approach to retractor lysis. Ophthalmic Surg 1990, 21: 767-71.
- Gaddipati RV, Meyer DR. Eyelid retraction, lid lag, lagophthalmos, and von Graefe's sign quantifying the eyelid features of Graves' ophthalmopathy. Ophthalmology 2008, 115: 1083-8.
- Acaroglu G, Cetinkaya E, Ileri D, et al. Lower lid retraction: a valuable finding in juvenile Graves' orbitopathy. J Pediatr Ophthalmol Strabismus 2004, 41: 96-9.
- Meyer DR. Levator excursion and its relationship to lid lag in thyroid eye disease. Ophthal Plast Reconstr Surg 2010, 26: 76.
Tireopatie iatrogene
Luca Piantoni
UOC Malattie Endocrine, Polo Ospedaliero Integrato S. Eugenio e CTO A. Alesini, Azienda USL Roma C
(aggiornato al 30 dicembre 2019)
Numerosi sono i farmaci che sono stati associati nel tempo a quadri di patologia tiroidea. La bassa frequenza di segnalazioni e la reale incidenza di tali quadri ha comportato modeste ricadute cliniche fino all’introduzione in clinica cardiologica di una molecola ad alta efficacia anti-aritmica – l’amiodarone – , ma gravata da significativi effetti sulla funzione tiroidea. Tali quadri rappresentano oggi la prima causa di tiroiditi iatrogene. Per la loro frequenza e per i possibili effetti di ipofunzione o tireotossicosi si è ritenuto di affrontarlo come argomento specifico e separato.
Il campo dei farmaci in campo anti-infiammatorio anti-neoplastico è in continua evoluzione. Alcune molecole hanno un valore storico. Per altre, di recente introduzione, non sempre sono disponibili dati specifici.
ANTI-EPILETTICI
È noto che i farmaci anti-epilettici possono influenzare il metabolismo e l’efficacia di altri farmaci (1), inclusi quelli ormonali, richiedendo talora una modificazione dei dosaggi e una particolare attenzione ai possibili effetti collaterali. A loro volta, i farmaci ormonali possono influenzare l’azione degli anti-epilettici (2,3).
Gli anti-epilettici possono influenzare sia la secrezione degli ormoni tiroidei che la terapia sostitutiva. Nei pazienti in terapia anti-convulsivante è stato descritto un rischio aumentato di disfunzioni tiroidee. I meccanismi principali con cui gli anti-epilettici esercitano un’influenza nei pazienti ipotiroidei in terapia sostitutiva comprendono:
- la competizione tra il farmaco anti-epilettico e l’ormone tiroideo per il legame alle proteine plasmatiche (fenitoina, carbamazepina, oxcarbazepina);
- il metabolismo accelerato degli ormoni tiroidei per induzione degli enzimi epatici CYP3A4 e UGT (fenobarbital, fenitoina, carbamazepina, oxcarbazepina);
- l’aumento della conversione periferica della T4 a T3.
L’aumento del metabolismo epatico degli ormoni tiroidei può portare a una riduzione della T4 plasmatica. Il valproato può precipitare un ipotiroidismo, ma i meccanismi d’azione non sono chiari.
Nessuno studio è stato rivolto specificatamente all’influenza dei farmaci anti-epilettici nei pazienti con ipotiroidismo centrale. Per mantenere nella norma i valori di FT4 nei pazienti con ipotiroidismo secondario che assumono farmaci anti-epilettici con azione di induzione enzimatica, può essere necessario un aumento del dosaggio della terapia con tiroxina. Concentrazioni terapeutiche di fenitonina e carbamazepina possono spiazzare la T4 e la T3 dal legame con le proteine, interferendo col dosaggio. Va anche tenuto presente che la tiroxina riduce la soglia epilettogena, per cui va evitato il sovra-dosaggio ed è importante la valutazione clinica per evidenziare segni di sotto- o sovra-dosaggio. I pazienti ipopituitarici assumono una terapia ormonale sostitutiva multipla, per cui vanno anche tenuti presenti gli effetti delle altre terapie ormonali sulla dose necessaria di ormone tiroideo. Data la scarsità di questi dati, l’invito è sempre quello di controllare la concentrazione della FT4 in terapia (possibilmente con metodiche come la dialisi all’equilibrio, per evitare interferenze) e di valutare clinicamente il paziente.
Nella meta-analisi di Zhang del 2016 (4) i neurologi cinesi hanno ricercato gli effetti dei farmaci anti-epilettici sulla funzionalità tiroidea in pazienti con epilessia. Dei 35 studi presi in esame, 25 erano focalizzati sugli effetti di specifici farmaci anti-epilettici: acido valproico (VPA), carbamazepina (CBZ), fenitoina (PHT). La metanalisi dimostra globalmente un’alterazione del profilo tiroideo in pazienti in trattamento con anti-epilettici rispetto ai controlli sani, in particolare:
- significativa riduzione di T4 (differenza media standardizzata, SMD -1.839) e FT4 (SMD -1.190);
- incremento di TSH (SMD + 0.445);
- non significative variazioni di T3 e FT3.
Questo andamento si conferma anche analizzando separatamente i pazienti in mono-terapia con VPA, PHT o CBZ; nei pazienti in trattamento con CBZ si riscontra anche una riduzione delle concentrazioni di T3.
È noto che gli anti-epilettici possono influenzare trasporto, metabolismo ed eliminazione degli ormoni tiroidei, attraverso diversi meccanismi (5,6), peraltro non del tutto chiariti. Dai dati presenti in letteratura, fenobarbital, PHT e CBZ attivano il sistema degli enzimi epatici microsomiali (P450) e per questa via accelerano il metabolismo degli ormoni tiroidei. Inoltre, è stato anche descritto un aumento dell’enzima glucuronil-transferasi, che interviene anch’esso nel catabolismo degli ormoni tiroidei. Ne consegue una riduzione della T4, per incremento della sua degradazione, che comporta un aumento compensatorio del TSH. Alcuni anti-epilettici sono inoltre in grado di competere con l’ormone tiroideo per il legame alla TBG (PHT e derivati, CBZ) e questo può portare a un artefatto nel dosaggio, con una diminuzione apparente di FT4. PHT influenza anche l’attività desiodasica, incrementando la conversione periferica della T4 a T3. Ecco due esempi:
- paziente di 56 anni (acido valproico + sodio valproato): TSH 1.76 mU/L, FT3 2.76 pg/mL (vn 2-4.4), FT4 7.84 pg/mL (vn 9.3-17);
- paziente di 36 anni (acido valproico + sodio valproato + eslicarbamazepina acetato + zonisamide): TSH 2.94 mU/L, FT3 2.51 pg/mL (vn 2-4.4), FT4 0.34 pg/mL (vn 0.7-1.7).
L’incongruenza dei valori, anche dopo la ripetizione in diverso laboratorio, suggerisce l’utilità di verificare l’assunzione di terapie precedentemente non riferite dal paziente.
Alcuni anti-epilettici potrebbero avere anche effetti diretti sulla secrezione di TSH: ad esempio, VPA, stimolando il sistema GABAergico, può ridurre la secrezione di somatostatina, che è un inibitore della secrezione del TSH. Inoltre, VPA può associarsi a carenza di Zinco e Selenio, che giocano un ruolo nella sintesi degli ormoni tiroidei. Le alterazioni delle concentrazioni degli ormoni tiroidei sembrano essere reversibili dopo la sospensione dell’anti-epilettico. I limiti dello studio, riconosciuti dagli stessi autori, sono dovuti al fatto che tutti gli studi inclusi sono osservazionali e inoltre gli anti-epilettici di nuova generazione non sono stati inclusi nell’analisi. Peraltro, i farmaci tradizionali considerati sono a tutt’oggi ampiamente utilizzati. Non sono inoltre disponibili dati sull’eventuale presenza di segni di autoimmunità tiroidea nei pazienti. Infine, non viene descritto il riscontro di manifestazioni cliniche di ipotiroidismo in questi pazienti e resta incerta la rilevanza clinica delle alterazioni nel profilo ormonale tiroideo riscontrate (7).
Che fare: si sottolinea la necessità di controllare la funzionalità tiroidea nei pazienti in terapia cronica con anti-epilettici. L’indicazione al trattamento delle alterazioni riscontrate andrà valutata da parte dell’endocrinologo, in base alla loro entità, facendo riferimento in particolare al TSH (nel paziente con normale funzionalità ipofisaria) e al contesto clinico. Particolare attenzione andrà posta nei pazienti con pre-esistenti problemi tiroidei e/o già in terapia sostitutiva. Può essere considerato con il neurologo un eventuale passaggio a un farmaco di ultima generazione (leviracetam), che non sarebbe un induttore enzimatico e non avrebbe mostrato tali effetti.
IMMUNO-TERAPIA ONCOLOGICA
L’immuno-terapia oncologica si fonda sul principio del riconoscimento di antigeni tumore-specifici da parte dei linfociti del paziente. Essa può sfruttare sia l’immunità umorale che cellulo-mediata e può prevedere l’uso di citochine, anticorpi monoclonali anti-antigeni tumorali o inibitori dei check-point immunitari, virus oncolitici, trasferimento adottivo di cellule T e vaccini anti-cancro. In tutti questi tipi di terapia si possono avere disfunzioni tiroidee. Un’interessante revisione ha analizzato la letteratura pubblicata sull’argomento fino al marzo 2017 (8).
Interleuchina-2
Uso clinico: melanoma metastatico, carcinoma a cellule renali.
Prevalenza di disfunzione tiroidea: 22% per tireopatie non altrimenti specificate, 15-40% per ipotiroidismo, 19% per ipertiroidismo (anche subclinico transitorio).
Patogenesi: probabilmente multi-fattoriale, si associa alla comparsa di auto-immunità tiroidea.
Interferone gamma
Uso clinico: oltre che in oncologia, è stato utilizzato anche per malattie autoimmuni (ad esempio sclerosi multipla) e infettive (ad esempio epatite virale) (9).
Meccanismo d’azione: immuno-modulazione, proprietà anti-virali e anti-neoplastiche.
Prevalenza di disfunzione tiroidea: variabile dall’1 al 50% per tireopatie in generale, 20% per ipotiroidismo autoimmune, 2-3% per tiroidite distruttiva.
Patogenesi: espressione ectopica sul tireocita di molecole del complesso di isto-compatibilità, con aumento della presentazione di auto-antigeni; linfocitosi con incremento percentuale di linfociti natural killer e B.
Inibitori dei check-point immunitari (vedi anche capitolo specifico)
Sono possibili, e ormai ben noti, effetti collaterali a carico di ipofisi, tiroide e, più raramente, surreni e pancreas endocrino.
Uso clinico: melanoma e la maggior parte dei tumori solidi (in particolare del polmone e del rene).
Meccanismo d’azione: promozione della risposta delle cellule T ai tumori, attraverso l’inibizione dei cosiddetti check-point immunitari, vie metaboliche che regolano in senso inibitorio l’azione dell’immunità cellulo-mediata.
- CTLA-4 (cytotoxic T-lymphocyte-associated antigen-4): tra gli anticorpi anti-CTLA-4, più spesso associati a ipofisite, ricordiamo ipilimumab (Yervoy) e tremelimumab;
- PD-1 (programmed cell death protein-1)/PD-1 ligando: tra gli anticorpi anti-PD-1, pembrolizumab (Keytruda), nivolumab (Opdivo) e pidilizumab; tra gli anti-PD-L1, durvalumab (Imfinzi), atezolizumab (Tecentriq), avelumab (Bavencio).
Prevalenza di disfunzione tiroidea: alto rischio di tireopatie autoimmuni, maggiore per gli anticorpi anti-PD-1 e ancor di più quando si associano diversi farmaci (tabella), come ad esempio per la combinazione di ipilimumab con nivolumab nella terapia del melanoma. Nel caso degli anticorpi anti-PD-1 si possono avere anche tiroiditi distruttive, con una prevalenza del 12%. In particolare, per nivolumab sono stati documentati ipotiroidismo (2-40%, rischio relativo = 12), ipertiroidismo e tiroidite (1-6.5%) e, più in generale, possono verificarsi tireotossicosi transitoria, ipotiroidismo transitorio o definitivo, orbitopatia di Graves, tiroidite silente, peggioramento di pre-esistente tireopatia autoimmune e, raramente, forme gravi come tempesta tireotossica ed encefalopatia responsiva agli steroidi. Più spesso si tratta di forme lievi di tiroidite silente su base autoimmune.
L’ipo e/o ipertiroidismo possono svilupparsi in fase relativamente precoce durante la terapia con questi farmaci (mediana di 9-11 settimane circa dopo l’inizio di nivolumab o dopo 2-3 dosi di ipilimumab) e comunque in qualunque fase del trattamento (10). Raramente la gravità della tireopatia è tale da richiedere la sospensione della terapia o incidere sulla sopravvivenza.
| Prevalenza di disfunzione tiroidea da inibitori dei check-point immunitari | |||
| Tipo di trattamento | Disfunzione tiroidea non specificata | Ipotiroidismo | Ipertiroidismo* |
| Anti-CTLA-4 | 23% | 4-15% | 3% |
| Anti-PD-1 | 39% | 9-40% | 1-13% |
| Anti-PD-L1 | 7-21% | 7-21% | 10% |
| Anti-CTLA-4 + anti-PD-1 o anti-PD-L1 | 50% | 2-27% | 22-30% |
| *comprese forme subcliniche transitorie | |||
Patogenesi: reazione cellulo-mediata contro auto-antigeni in seguito alla down-regolazione dei linfociti T regolatori e alla promozione dei linfociti T effettori, induzione di auto-immunità tiroidea, legame degli anticorpi a PD-L1 e PD-L2 presenti nei tireociti normali; sono stati descritti inoltre anticorpi anti-cellule tireotrope.
Virus oncolitici
Uso clinico: melanoma.
Meccanismo d’azione: infezione di cellule neoplastiche ad opera di un virus Herpes Simplex combinato con un fattore di crescita (GM-CSF), che determina sia un effetto cito-tossico diretto, sia il rilascio di antigeni tumorali in grado di indurre la risposta immunitaria (effetto indiretto).
Prevalenza di disfunzione tiroidea: rara.
Patogenesi: non nota.
Trasferimento adottivo di cellule T
Uso clinico: melanoma, neoplasie ematologiche.
Meccanismo d’azione: auto-trapianto di linfociti infiltranti il tumore.
Prevalenza di disfunzioni tiroidee: finora non sono state descritte disfunzioni endocrine, ma potrebbero essere possibili visto che l’esperienza con questa strategia terapeutica è ancora limitata.
Patogenesi: ipotizzato meccanismo auto-immune.
Vaccini anti-cancro
Uso clinico: carcinoma prostata, pancreas, colon, polmone, melanoma, a cellule renali.
Meccanismo d’azione: vengono iniettate nel paziente cellule cancerose, preventivamente irradiate per prevenirne la replicazione nell’ospite, o antigeni tumorali purificati, con l’obiettivo di indurre e amplificare la risposta immunitaria tumore-specifica. Possono essere utilizzati da soli o in associazione a IL-2, GM-CSF, batteri inattivi, adiuvanti. Il vaccino può essere sia autologo (cellule tumorali del paziente) che allogenico (cellule di un altro paziente con una neoplasia simile). Complessivamente, non ci sono stati finora benefici significativi in termini di sopravvivenza.
Prevalenza di disfunzione tiroidea: 0-25% per tireopatie non altrimenti specificate, 4-11% per ipotiroidismo, 11-24% per ipertiroidismo (anche subclinico transitorio).
Patogenesi: mimetismo molecolare con auto-antigeni tiroidei, induzione di auto-immunità tiroidea.
Che fare. Sono possibili sia forme di ipotiroidismo di marcata entità che forme di tireopatia ad atteggiamento funzionale fluttuante, con rapido passaggio dall'iper all'ipotiroidismo, e l’insorgenza può essere rapida. Sulla base dei dati disponibili, appare utile dosare in tutti i pazienti sottoposti a immuno-terapia oncologica:
- subito prima dell’inizio della terapia: anticorpi anti-TPO e anti-Tg, TSH e FT4;
- in corso di terapia: TSH e FT4, ogni 2-3 mesi in caso di positività degli auto-anticorpi o meno frequentemente in caso di assenza, secondo giudizio clinico.
La presenza di tireopatia pre-esistente non costituisce una controindicazione all’immunoterapia oncologica, ma si raccomanda un monitoraggio più stretto della funzione tiroidea.
In caso di insorgenza de novo di tireopatia, la sospensione dell’immuno-terapia non è generalmente richiesta, data l’efficacia della terapia tiroxinica per l’ipotiroidismo e di tionamidi e ß-bloccanti per l’ipertiroidismo. Sia l’ipotiroidismo che l’ipertiroidismo conclamati vanno trattati secondo le linee guida correnti. L’uso di corticosteroidi è raccomandato solo in caso di concomitante ipofisite o di orbitopatia di Graves, qualora questa sia di grado moderato-severo e non migliori dopo la sospensione dell’immuno-terapia.
Non ci sono evidenze forti per raccomandare o controindicare la terapia delle disfunzioni tiroidee subcliniche nei pazienti oncologici, per cui si rimanda al giudizio clinico; sembra tuttavia ragionevole proporre un iniziale periodo di osservazione, anche alla luce delle possibili interferenze transitorie sulla funzione tiroidea sia della malattia neoplastica che delle terapie oncologiche.
È possibile che gli eventi avversi endocrini siano ancora non correttamente stimati per la presenza di diversi fattori confondenti presenti nei pazienti oncologici: sick euthyroid syndrome, terapia con steroidi e/o altri farmaci con effetto sulla funzione tiroidea (ad esempio inibitori di tirosin-chinasi), radioterapia, esecuzione di TC con mdc iodati, sottovalutazione in favore di sintomi e segni legati alla malattia neoplastica, soprattutto se avanzata.
INIBITORI DELLE TIROSIN-CHINASI (TKI)
In oncologia è nettamente aumentato l’utilizzo di TKI, in mono-terapia o in associazione a chemio- o radioterapia. Esiste quindi una nutrita serie di dati sugli effetti di questi farmaci sul sistema endocrino e sulla funzione tiroidea in particolare (11-15).
La classe di questi farmaci è in continuo ampliamento. Due sono le molecole più consolidate nell’uso e sulle quali è presente quindi il maggiore numero di dati:
- sunitinib (Sutent®) per GIST, carcinoma renale, NET pancreatico;
- sorafenib (Nexavar®) per carcinoma differenziato della tiroide (DTC), carcinoma midollare della tiroide (MTC) e carcinoma renale.
L’ipotiroidismo è l’evento più frequente, a nuova genesi o come peggioramento del profilo ormonale in corso di ipotiroidismo già conosciuto. Le percentuali di incidenza di ipotiroidismo clinico o subclinico, variano in modo ampio nelle statistiche: 7-85% per sunitinib, 6-42% per sorafenib.
È stata riportata una fase transitoria di ipertiroidismo.
I limitati studi su vandetanib (Caprelsa, MTC), motesanib (MTC e DTC) e cabozantinib (Cabometyx, Cometriq, MTC) hanno mostrato dati sovrapponibili, con ampli range statistici. Pazopanib (Votrient, carcinoma renale), se utilizzato in pazienti con DTC sdifferenziato (n = 37), ha aumentato il TSH nel 62% dei casi. Per imatinib (Glivec) il riscontro di aumento del TSH nel 60% dei pazienti già in terapia tiroxinica sostitutiva dopo tiroidectomia, con necessità di adeguamento della terapia e l’assenza di effetti nei soggetti non tiroidectomizzati, inducono a ipotizzare un effetto extra-tiroideo della molecola. Vengono segnalati iper e ipotiroidismo nel 22% dei casi con nilotinib (Tasigna) e nel 50% con dasatinib (Sprycel), utilizzati per la leucemia mieloide cronica. L’uso di axitinib (Inlyta) nei pazienti affetti da carcinoma renale determina ipotiroidismo nel 20% dei trattati.
I meccanismi di interferenza con l’asse ipotalamo-ipofisi-tiroide sarebbero questi:
- azione diretta sulla tiroide e sulla biosintesi degli ormoni tiroidei e possibile sviluppo di positività anticorpale: sunitinib, sorafenib e nilotinib; l’inibizione della captazione dello iodio e dell’attività della tireo-perossidasi può contribuire alla riduzione della biosintesi degli ormoni tiroidei;
- interferenza sul trasporto degli ormoni tiroidei, per inibizione da parte dei TKI sui trasportatori MCT8 e MCT10;
- interferenza sul metabolismo degli ormoni tiroidei per induzione della desiodasi di tipo 3 e sul metabolismo del TSH, che risente meno dell’azione del feed-back negativo di T3 e T4 a livello ipofisario.
Che fare: utile valutare la funzione tiroidea, prima della terapia e 4 settimane dopo il termine del trattamento: sulla base dei livelli di TSH e della sua evoluzione, considerare l’eventuale introduzione di L-tiroxina.
BEXAROTENE
La terapia con bexarotene (Targretin®) è utilizzata nel trattamento delle manifestazioni cutanee nei pazienti con linfoma cutaneo a cellule T di grado avanzato. Il farmaco attiva i 3 recettori intra-cellulari X dei retinoidi, i quali regolano l'espressione di geni che controllano la differenziazione e la crescita delle cellule.
La terapia è associata a ipotiroidismo centrale, per ridotta secrezione ipofisaria di TSH (16,17).
Sono stati anche valutati gli effetti periferici dello bexarotene sul metabolismo degli ormoni tiroidei, con uno studio su pazienti privi di tiroide in terapia tiroxinica sostitutiva. Il bexarotene è risultato aumentare la degradazione periferica degli ormoni tiroidei, attraverso una via non desiodasi–mediata e tale effetto si aggiunge a quello a livello ipofisario. L’anomalia riscontrabile nei dati funzionali della tiroide va segnalata al paziente e ai suoi curanti.
Il paziente dovrà quindi essere trattato con una terapia tiroxinica, monitorata sulla base dei livelli di FT4 e indipendentemente dai bassi livelli di TSH, come d’uso nelle forme di ipotiroidismo centrale.
ANTI-PSICOTICI
Le fenotiazine, anti-psicotici tipici, alterano principalmente la captazione dello iodio, ma riducono anche la risposta del TSH al TRH.
Le non fenotiazine, anti-psicotici tipici, possono indurre la formazione di auto-anticorpi della tiroide e aumentare i livelli di TSH.
Gli anti-psicotici atipici, di cui fanno parte clozapina (Leponex®), risperidone (Risperdal®), olanzapina (Zyprexa®), paliperidone (Invega®), quetiapine (Seroquel®) e aripiprazolo (Abilify®), sono usati per il trattamento della schizofrenia e delle forme maniacali severe nei pazienti bipolari. La dopamina agisce sull’asse ipotalamo-ipofisi-tiroide attivando i recettori D2, ma ha un effetto inverso su ipotalamo e cellule tireotrope. La dopamina può inibire la secrezione del TSH. In considerazione del loro profilo dopamino-agonista, gli anti-psicotici atipici possono parzialmente ridurre la risposta del TSH al TRH, in genere senza indurre ipotiroidismo franco. L’ipotiroidismo nella maggioranza dei casi è dovuto a ridotta sintesi e rilascio di ormoni tiroidei.
In considerazione delle spiccate differenze farmacologiche tra le diverse molecole del gruppo e del numero limitato di casi di ipotiroidismo, al momento non si ritiene che l’effetto sulla funzionalità tiroidea possa essere considerato un effetto di classe farmacologica (18-21).
LITIO
Il litio, in forma di carbonato è tuttora ampiamente usato in clinica psichiatrica nella profilassi e nel trattamento della sindrome bipolare, con una posologia di 1000-1500 mg/die in fase di attacco e 300–400 mg/die come dose di mantenimento. L’indice terapeutico è modesto e richiede periodici dosaggi delle concentrazioni terapeutiche, da mantenere nel range 0.4-1 mM/L.
L'utilizzo a lungo termine è stato associato a disfunzione tiroidea: l’incidenza riportata di ipertiroidismo è molto rara, più frequente è il rischio di ipotiroidismo, fino a 8 volte quello della popolazione generale, con riferita frequenza maggiore per sesso femminile ed età > 50 anni. Non sono ancora chiariti il ruolo della familiarità per tireopatie e della presenza di auto-immunità tiroidea precedente al trattamento con litio.
Che fare: prima dell’inizio della terapia è quindi raccomandato un dosaggio di TSH, FT4, FT3, Ab-TPO e Ab-Tg e in corso di trattamento il controllo periodico di FT4 e TSH.
BIOTINA
La biotina è una vitamina idrosolubile appartenente al gruppo B, utilizzata nel trattamento del deficit di biotina, nel trattamento di alcune malattie della pelle o in nutrizione parenterale come supplemento vitaminico. La biotina è contenuta anche in alcuni integratori alimentari.
Il rischio di ottenere risultati falsati delle indagini di laboratorio a causa della biotina è maggiore nei seguenti gruppi:
- pazienti con insufficienza renale, che possono avere concentrazioni di biotina più elevate nel sangue e tempi di eliminazione più lunghi;
- pazienti affetti da sclerosi multipla esposti ad alte dosi di biotina (fino a 300 mg/die) negli studi clinici;
- bambini con malattie metaboliche rare (deficit di biotinidasi, deficit di olocarbossilasi sintetasi, gangli basali sensibili alla biotina-tiamina), poiché dipendono da alte dosi di biotina.
La biotina può interferire con molti esami di laboratorio, tra i quali: troponina, PTH, cortisolo, FSH e LH, vitamina D. In ambito di diagnostica per tireopatie la biotina può determinare risultati per le indagini di funzionalità della tiroide che mimano la malattia di Graves e comportare quindi un trattamento non necessario con farmaci anti-tiroidei (22).
ACIDO TRI–IODO-TIROACETICO (TRIAC)
Analogo della T3, è presente in alcuni integratori alimentari (dimagranti, acceleratori del metabolismo), in preparazioni galeniche e come farmaco (Triacana, Teatrois). Può indurre ipotiroidismo da inibizione del TSH, bassi livelli di fT4 ed elevati livelli di fT3. Il paziente spesso convive con la sintomatologia clinica per mesi prima di giungere al riscontro della causa. Tipico il quadro sierologico, con elevati livelli di fT3 e quindi TSH nettamente soppresso, e fT4 nettamente inferiore per assenza di stimolo del TSH. Esempio: paziente di 48 anni, TRIAC 1.5 mg, 1 cp x 3; FT3 > 40 pg/mL (v.n. 1.5-4.8), FT4 < 3 pg/mL (v.n. 8.9-17.6), TSH 0.009 μU/mL (v.n. 0.4-4.0).
Su Internet è possibile reperire in diversi siti a libero accesso “istruzioni dettagliate" sull’uso del TRIAC, che si riportano a titolo di esempio ovviamente non condividendone il contenuto! “Nello sport il Triacana viene utilizzato per perdere rapidamente il grasso in eccesso, senza ricorrere a diete estreme che finiscono, inevitabilmente, per favorire il catabolismo muscolare. Per questo motivo, il Triacana è un farmaco particolarmente apprezzato dai body-builder, che lo utilizzano per migliorare la definizione muscolare in vista di una competizione (spesso associandolo a steroidi anabolizzanti non aromatizzabili). Se da un lato il Triacana ha un'azione inferiore rispetto a Cytomel (T3) e Synthroid (tiroxina), dall'altro è considerato più sicuro. Il ciclo inizia normalmente con due pastiglie di Triacana da 0.35 mg da assumere a distanza di 12 ore. Giorno dopo giorno la dose verrà incrementata di due compresse fino ad arrivare alle 10-14 pastiglie al giorno. L'assunzione va distribuita nel corso della giornata in modo da mantenere stabili i livelli plasmatici di tiratricol (questo metabolita ha un'emivita di circa 6 ore). La durata d'assunzione non deve superare i tre mesi ed in ogni caso è importante non sospenderla bruscamente. Similmente alla fase iniziale, la dose andrà infatti diminuita di due pastiglie al giorno fino a sospendere completamente l'assunzione. Tale coda ha lo scopo di riattivare la naturale funzionalità tiroidea, depressa dall'utilizzo cronico di Triacana”.
LEVOTIROXINA + ESCINA EMULSIONE
Il prodotto è in commercio in Italia come crema (Somatoline®) di libera vendita. L’indicazione è quella della pannicolopatia edemato-fibro-sclerotica (conosciuta come “cellulite”). 100 g di emulsione contengono 100 mg di levotiroxina e 300 mg di escina. Nella scheda tecnica, tra le controindicazioni per la tiroide, riportata solo l’intolleranza allo iodio e inoltre si afferma che "nei limiti della posologia indicata, Somatoline non determina effetti collaterali sistemici e non interferisce con i principali parametri di funzionalità tiroidea”.
Il tipo di preparazione e l’estensione della patologia nonché l’auto-medicazione può comportare l’utilizzo su superfici estese e per lungo periodo. Se sono rare le segnalazioni di esordio di patologia Basedowiana, verosimilmente per la slatentizzazione di una predisposizione pre-esistente, molto più frequente (e stagionale) il riscontro di casi di tireotossicosi sierologiche. Tipicamente si riscontrano valori di TSH anche nettamente soppresso, valori inferiori al limite di FT4 ed elevati valori di FT3. I quadri sono abitualmente asintomatici o pauci-sintomatici, e regrediscono con la sospensione del prodotto senza necessità di terapia tireostatica.
FUCUS VESCICOLOSUS (ALGA BRUNA, KELP)
È un'alga appartenente alla famiglia delle fucacee, con habitat naturale sulla costa atlantica del mare del nord Europa. I principali componenti attivi sono: polisaccaridi (acido alginico, fucoidano, laminaria), iodio (0.05-0.2%), vitamine e minerali (soprattutto vitamina C). Si utilizza prevalentemente l'estratto secco titolato, da 500 a 900 mg/die, e l’estratto fluido, in gocce, assunto alla dose di 25-40 gocce x due volte/die. Sono anche numerosi gli integratori dietetici per la linea e per la cellulite che contengono il fucus. Per tale motivo, per una titolazione in principi attivi non necessariamente rigorosa, e spesso per l’assenza di una specifica anamnesi di patologie tiroidee, la sua assunzione può slatentizzare condizioni di ipertiroidismo subclinico o complicare la gestione di una terapia tiroxinica (potenziamento dell'azione).
IODOPOVIDONE
Lo iodopovidone (PVP-I) è un complesso ottenuto dalla combinazione del polimero polivinil-pirrolidone (PVP) con lo iodio sotto forma di ioni triioduro. L'uso più comune di questo principio attivo, in varie forme e associazioni, è quello di disinfettante della cute o delle ferite, per trattamenti anti-settici e per l'igiene orale. Essendo solubile sia in acqua sia in alcol o altri solventi, di solito è presentato come soluzione idro-alcolica (es. per uso esterno al 10%). Il nome del preparato più diffuso in Italia a base di iodopovidone è Betadine, ma è presente anche con altri nomi commerciali e in forma di farmaco generico. Sono stati riportati casi di ipertiroidismo in pazienti in corso di dialisi peritoneale. I tappi di disconnessione dei cateteri dialitici sono pre-trattati con iodopovidone. I casi sono prevalentemente correlati a pazienti in età infantile o comunque con bassi volumi di soluzioni dialitiche e quindi con maggiore concentrazione di iodio nel dialisato. Le segnalazioni hanno determinato un alert dell’Agenzia per il controllo dei farmaci della Gran Bretagna, in accordo con il produttore del dispositivo (23).
RITONAVIR
Questa molecola viene impiegata nei regimi anti-virali per il trattamento dell’HIV e dell’epatite cronica da HCV.
Il ritonavir induce la glucuronidazione della L-T4, con il risultato di una potenziale riduzione dell’esposizione sistemica. Tale effetto, che presenta una variabilità individuale molto ampia, può modificare gli effetti terapeutici della L-T4.
Che fare: nei pazienti trattati con L-T4 viene suggerito il monitoraggio del TSH almeno durante il primo mese dall’inizio e/o dalla fine del trattamento con ritonavir (24,25).
ALEMTUZUMAB
Uso clinico: alemtuzumab (Lemtrada) è un anticorpo monoclonale anti-CD52 utilizzato nei pazienti adulti con sclerosi multipla (SM) recidivante-remittente attiva (26-28) Tale terapia aumenta il rischio di insorgenza di patologie autoimmuni, tra cui anche quelle di pertinenza tiroidea.
Disfunzione tiroidea: una descrizione dettagliata della tipologia di disfunzione tiroidea correlata ad alemtuzumab è stata effettuata nello studio CAMMS223, nel quale 334 pazienti con SM sono stati randomizzati in un rapporto 1:1:1 a interferone ß-1a (44 µg sc x 3/settimana) o ad alemtuzumab a due diversi dosaggi (12 o 24 mg/d in 3-5 giorni consecutivi, una volta all’anno). Gli autori riferiscono che alemtuzumab può produrre alterazione della funzione tiroidea con maggior frequenza rispetto all’interferone ß-1a (34% vs 6.5%), con elevata prevalenza di ipertiroidismo da m. di Basedow (22%) e con tireopatie frequentemente recidivanti. Le tireopatie autoimmuni (sia tireotossicosi che ipotiroidismo) sono comparse nei 48 mesi successivi alla prima esposizione al farmaco. La maggior parte degli eventi è stata classificata di grado lieve-moderato. Nella maggioranza dei pazienti che hanno manifestato tireopatie (circa l'80%), gli Ab anti-TPO non erano presenti in condizioni basali. Vari studi, tra i quali uno molto recente (28), hanno dimostrato che le patologie tiroidee hanno un picco di incidenza dai primi mesi fino al 3° anno post-terapia con alemtuzumab (e poi si osserva un calo, sino al 5° anno).
Che fare: è consigliato il dosaggio del TSH prima di intraprendere il trattamento e successivamente ogni 3 mesi fino a 48 mesi dall’ultima somministrazione. Dopo questo periodo, i test devono essere eseguiti in funzione dei risultati clinici.
BIBLIOGRAFIA
- Zaccara G, Perucca E. Interaction between antiepileptic drugs and other drugs. Epileptic Disord 2014, 16: 409-31.
- Del Monte P. Ipopituitarismo e farmaci anti-epilettici. AME Flash 8/2015.
- Del Monte P. Anti-epilettici e tiroide: risultato di una recente meta-analisi. AME News 39/2016.
- Zhang YX, Shen CH, Lai QL, et al. Effects of antiepileptic drug on thyroid hormones in patients with epilepsy: a meta-analysis. Seizure 2016, 35: 72-9.
- Dorizzi R. Effetti dei farmaci sugli esami tiroidei. Endowiki.
- Sarne D. Effects of the environment, chemicals and drugs on thyroid function. Endotext (updated 9/27/2016).
- Hamed SA. The effect of antiepileptic drugs on thyroid hormonal function: causes and implications. Expert Rev Clin Pharmacol 2015, 8: 741-50.
- Di Donna V, Corsello S. Tireopatie da immuno-terapia oncologica. AME Flash 25/2018.
- Zuppi P. HCV, interferone e tiroide. AME Flash maggio 2010.
- Paragliola R, Corsello S. Effetto degli inibitori delle tirosin-chinasi sulla funzione tiroidea. AME News 72/2014.
- Caputo M. Farmaci biologici e danno tiroideo. AME News Farmaci 41/2014.
- Illouz F, Braun D, Briet C, et al. Endocrine side-effects of anti-cancer drugs: thyroid effects of tyrosine kinase inhibitors. Eur J Endocrinol 2014, 171: R91-9.
- Torino F, Corsello SM, Longo R, et al. Hypothyroidism related to tyrosine kinase inhibitors: an emerging toxic effect of targeted therapy. Nat Rev Clin Oncol 2009, 6: 219-28.
- Maynard MA, Marino-Enriquez A, Fletcher JA, et al. Thyroid hormone inactivation in gastrointestinal stromal tumors. N Engl J Med 2014, 370: 1327-34.
- Baxi S, Yang A, et al. Immune-related adverse events for anti-PD-1 and anti-PD-L1 drugs: systematic review and meta-analysis. BMJ 2018, 360: k793.
- Smit JWA, Stokkel MPM, Pereira AM, et al. Bexarotene-induced hypothyroidism: bexarotene stimulates the peripheral metabolism of thyroid hormones. J Clin Endocrinol Metab 2007, 92: 2496-9.
- Haugen BR. Drugs that suppress TSH or cause central hypothyroidism. Best Pract Res Clin Endocrinol Metab 2009, 23: 793-800.
- Church CO, Callen EC. Myxedema coma associated with combination aripiprazole and sertraline therapy. Ann Pharmacother 2009, 43: 2113-6.
- Bou KR, Richa S. Thyroid adverse effects of psychotropic drugs: a review. Clin Neuropharmacol 2011, 34: 248-55.
- Wetzel H, Wiesner J, Hiemke C, Benkert O. Acute antagonism of dopamine D2-like receptors by amisulpride: effects on hormone secretion in healthy volunteers. J Psychiatr Res 1994, 28: 461-73.
- Kelly DL, Conley RR. Thyroid function in treatment-resistant schizophrenia patients treated with quetiapine, risperidone, or fluphenazine. J Clin Psychiatry 2005, 66: 80-4.
- Biotina: come influenza i risultati di laboratorio? Luglio 2019.
- Medicines and Healthcare products Regulatory Agency. MiniCap peritoneal dialysis disconnect cap with povidone-iodine - monitor thyroid function in patients with small fill volumes. 17 December 2014.
- Pirali B. Rischio di interazione tra ritonavir e levotiroxina. AME News Farmaci 22/2018.
- Pirali B. Alemtuzumab e tiroide. AME News Farmaci 43/2017.
- Daniels GH, et al. Alemtuzumab-related thyroid dysfunction in a phase 2 trial of patients with relapsing-remitting multiple sclerosis. J Clin Endocrinol Metab 2014, 99: 80-9.
- Mahzari M, Arnaout A, Freedman MS. Alemtuzumab induced thyroid disease in multiple sclerosis: a review and approach to management. Can J Neurol Sci 2015, 42: 284-91.
- Coles AJ, et al. Alemtuzumab CARE-MS II 5-year follow-up: efficacy and safety findings. Neurology 2017, 89: 1117-26.
Tireopatia da amiodarone
Luca Piantoni
UOC Malattie Endocrine, Polo Ospedaliero Integrato S. Eugenio e CTO A. Alesini, Azienda USL Roma C
(aggiornato al 25 novembre 2015)
INTRODUZIONE
L’amiodarone è una molecola introdotta in Italia nel 1985, particolarmente efficace per una serie di patologie di elevata frequenza: tachicardie sopra-ventricolari (parossistiche e non parossistiche), extra-sistoli atriali, flutter e fibrillazione atriale, extra-sistoli e tachicardie ventricolari, trattamento profilattico delle crisi di angina pectoris. Una compressa contiene amiodarone cloridrato 200 mg e una fiala 100 mg. Il dosaggio medio iniziale consigliato è di 600 mg/die; successivamente la dose di mantenimento è compresa tra 100-400 mg/die. Gli effetti collaterali che interessano l’endocrinologo si verificano a carico della tiroide.
Farmacologia dell’amiodarone
Il 37% della molecola di amiodarone è costituita da iodio. Pertanto, con una posologia di 200-600 mg/die, vengono introdotti 74-222 mg/die di iodio, a fronte di una dose LARN di 150 µg/die.
il farmaco e i suoi metaboliti vengono accumulati nel tessuto adiposo e rilasciati molto lentamente. Dopo la sospensione del farmaco, i livelli plasmatici dell’amiodarone e dei suoi metaboliti rimangono elevati per un lungo periodo di tempo, anche > 60 giorni. La ioduria può rimanere elevata anche per 90 giorni.
Amiodarone e tiroide
Una delle azioni dell’amiodarone sul metabolismo tiroideo consiste nel ridurre l’attività della 5’-desiodasi (5’-D) di tipo 1, riducendo la trasformazione di T4 in T3. Ne risulta un aumento della concentrazione plasmatica di T4 e una riduzione di T3.
L’amiodarone e i suoi metaboliti hanno anche un effetto cito-tossico sulla tiroide, sia con un’azione diretta sulle cellule tiroidee, sia per l’eccesso di iodio farmaco-indotto. Sembra confermato che l’amiodarone possa esacerbare e precipitare una pre-esistente condizione di autoimmunità organo-specifica.
Nonostante tali dati, la maggioranza dei pazienti in terapia con amiodarone resta eutiroidea e solo una frazione sviluppa una disfunzione tiroidea, in forma di tireotossicosi (incidenza 1-23%, più frequente nelle aree con bassa disponibilità di iodio) o di ipotiroidismo (incidenza 1-32%, più diffuso nelle aree dove l’apporto di iodio è sufficiente).
TIREOTOSSICOSI INDOTTA DA AMIODARONE (AIT)
Introduzione
La tireotossicosi può insorgere all’inizio della terapia con amiodarone, ma anche dopo molti mesi. Il farmaco è depositato nei tessuti periferici e rilasciato molto lentamente, e questo spiega la non infrequente comparsa di tireotossicosi anche dopo la sospensione dell’amiodarone. La dose di amiodarone non sembra essere importante nel determinare lo sviluppo della tireotossicosi.
Patogenesi
La tireotossicosi può insorgere sia in una tiroide normale sia in una ghiandola con una patologia pre-esistente. L’auto-immunità umorale non ha alcun ruolo nello sviluppo della AIT. È possibile riscontrare anticorpi anti-tiroide (Ab anti-TPO, Ab anti-Tg) solo nei pazienti con AIT che avevano già una nota precedente disfunzione tiroidea (soprattutto il gozzo diffuso). I meccanismi coinvolti sono due:
- AIT tipo 1: tireotossicosi legata all’eccessiva sintesi di ormoni tiroidei indotta dal carico di iodio, in pazienti con pregresse tireopatie spesso presenti in forma latente (gozzo o Graves in fase pre-tossica, tiroidite di Hashimoto);
- AIT tipo 2: in una ghiandola tiroidea apparentemente normale, il meccanismo patogenetico sembra legato a un processo tiroiditico distruttivo indotto dall’amiodarone, che determina il rilascio in circolo degli ormoni tiroidei precedentemente sintetizzati, come avviene nelle tiroiditi subacute.
La distinzione tra le due forme di tireotossicosi, però, non è netta e spesso le forme che si osservano nella clinica sono "miste".
Clinica e diagnosi
Le classiche manifestazioni cliniche dell’ipertiroidismo possono anche mancare nella AIT, a causa dell’azione anti-adrenergica dell’amiodarone e della ridotta conversione di T4 in T3, l'ormone tiroideo attivo. Spesso esordisce con un peggioramento delle condizioni cardiache. È importante distinguere tra AIT di tipo 1 e di tipo 2, ma i criteri sono largamente imperfetti:
- nel tipo 1 è spesso presente una patologia tiroidea sottostante all’anamnesi, i valori plasmatici di tireoglobulina sono sostanzialmente nella norma e il pattern vascolare all’ecocolor-Doppler è di tipo I-III, corrispondenti ad una discreta o decisamente aumentata vascolarizzazione;
- nel tipo 2, invece, non è presente una patologia tiroidea sottostante, i valori plasmatici di tireoglobulina possono essere notevolmente aumentati, mentre il pattern vascolare all’ecocolor-Doppler è di tipo 0, corrispondente a una vascolarizzazione ridotta o assente.
L’esame scintigrafico è spesso impraticabile per l’elevata interferenza iodica, ma può essere utile nella diagnosi differenziale delle due forme, poichè la captazione ghiandolare è:
- normale (o elevata) nella forma ipertiroidea;
- classicamente assente o molto bassa nella forma distruttiva.
Terapia
AIT di tipo 1. In primo luogo bisogna, quando possibile, sospendere l’amiodarone. In letteratura sono segnalati solo pochi casi di AIT trattati con successo con tionamidi senza sospendere l’anti-aritmico. Infatti, l’elevato contenuto intra-tiroideo di iodio rende difficile l’utilizzo delle sole tionamidi e, anche l’utilizzo del radioiodio è reso spesso inutile dal fatto che la captazione tiroidea è ridotta.
Obiettivi terapeutici sono:
- bloccare l’organificazione dello iodio e quindi l’ulteriore sintesi degli ormoni tiroidei;
- ridurre l’ingresso di altro iodio all’interno della tiroide.
Il primo obiettivo viene perseguito con le tionamidi: per l’elevata concentrazione intra-tiroidea di iodio, è necessario un dosaggio più elevato del normale (metimazolo 40-60 mg/die; propiltiouracile 600-800 mg/die).
Per il secondo obiettivo, si può eventualmente utilizzare perclorato di potassio (1 g/die) per non oltre 30-40 giorni: un periodo inferiore sembra gravato da maggiore frequenza di recidive, mentre un periodo maggiore aumenta il rischio di gravi effetti collaterali, quali agranulocitosi, anemia aplastica e sindrome nefrosica.
Nelle prime settimane utile controllare più volte l’esame emocromocitometrico.
L’intervento chirurgico di tiroidectomia totale è uno strumento terapeutico che va valutato con l’equipe cardiologica e il paziente, considerando una serie di variabili e l’aumentato rischio operatorio e anestesiologico legato a un intervento in corso di tireotossicosi.
Si può prendere in considerazione anche la plasmaferesi per una rapida rimozione degli ormoni tiroidei dal circolo, anche se la sua azione è transitoria e spesso seguita da un’esacerbazione della tireotossicosi.
AIT di tipo 2. Anche in questa forma di tireotossicosi da amiodarone è raccomandata la sospensione del farmaco. L’approccio terapeutico più adeguato è rappresentato dagli steroidi, sia per la loro azione membrano-stabilizzante e sia per l’effetto anti-infiammatorio.
Il dosaggio e lo schema terapeutico variano a seconda del tipo di steroide utilizzato (15-80 mg/die di prednisone o 3-6 mg/die di desametasone). Lo schema più utilizzato prevede l’utilizzo di prednisone a partire da 80 mg/die a scalare, ogni due settimane, per circa tre mesi. La prematura sospensione della terapia può determinare la comparsa di recidive.
Nei pazienti con le forme miste di AIT e nella frequente difficoltà pratica di distinguere le 2 forme, il trattamento più appropriato prevede il contemporaneo utilizzo di metimazolo, perclorato di potassio e prednisone.
IPOTIROIDISMO INDOTTO DA AMIODARONE (AIH)
Introduzione
Si riscontra più frequentemente nelle aree dove l’apporto iodico è sufficiente.
Si instaura più lentamente e si può riscontrare sia in pazienti con pre-esistente patologia tiroidea, sia in soggetti senza alcuna patologia tiroidea sottostante.
La presenza di anticorpi anti-TPO e il sesso femminile sono da considerare fattori di rischio per lo sviluppo di AIH.
Patogenesi
L’effetto Wolff-Chaikoff consiste nel blocco della sintesi degli ormoni tiroidei indotto da un eccesso di concentrazione di iodio all’interno della tiroide. La tiroide normale riesce a sfuggire a questo meccanismo (escape). Nell’AIH una tiroide, già danneggiata da un processo infiammatorio cronico, in presenza di eccesso di iodio è incapace di superare l’effetto Wolff-Chaikoff e non è più in grado di sintetizzare gli ormoni tiroidei.
Inoltre, l’eccesso di iodio causa un danno organico non specifico a livello dei follicoli tiroidei, che si somma a quello già presente dovuto al processo tiroiditico, accelerando l’evoluzione della tiroidite di Hashimoto verso l’ipotiroidismo.
Clinica e diagnosi
I sintomi sono simili a quelli dell’ipotiroidismo spontaneo.
Terapia
La necessità di sospendere l’amiodarone non è stringente. Se può essere sospeso, la remissione dell’ipotiroidismo è possibile nei pazienti che non avevano una patologia tiroidea sottostante, ma molto più rara nei pazienti con pregressa tiroidite di Hashimoto. La dose di levotiroxina per normalizzare i valori di TSH è spesso maggiore di quanto previsto, a causa dell’effetto inibitorio che l’amiodarone ha sulla conversione del T4 in T3.
RACCOMANDAZIONI NEL FOLLOW-UP DEL PAZIENTE CHE ASSUME AMIODARONE
È utile studiare la funzionalità tiroidea e dosare gli anticorpi anti-tiroide sia prima che durante l’assunzione della terapia con amiodarone.
Sarebbe opportuna anche un’indagine ecografica, per individuare la presenza di gozzo nodulare o semplice che possa predisporre allo sviluppo di AIT.
L’amiodarone è un farmaco bradicardizzante molto efficace: la ricomparsa di frequenza cardiaca normo/elevata deve far porre il sospetto di AIT.
In un paziente che sta assumendo amiodarone (e che rimane eutiroideo) i valori di T4 sono lievemente elevati, mentre quelli di T3 sono ai limiti bassi di norma.
Ringrazio il dott. Massimiliano Andrioli, che mi ha consentito di utilizzare parte della sua estesa trattazione sull’amiodarone, rintracciabile al link http://www.endocrinologiaoggi.it
BIBLIOGRAFIA
- Martino E, Bartalena L, Bogazzi F, et al. The effects of amiodarone on the thyroid. Endocr Rev 2001, 22: 240-54.
- Basaria S, et al. Amiodarone and the thyroid. Am J Med 2005, 118: 706-14.
- Diehl LA, et al. Management of amiodarone-induced thyrotoxicosis in Latin America: an electronic survey. Clin Endocrinol 2006, 65: 433–8.
- Batcher EL, et al. Thyroid function abnormalities during amiodarone therapy for persistent atrial fibrillation. Am J Med 2007, 120: 880–5.
- Eskes SA, et al. Amiodarone and thyroid. Best Pract Res Clin Endocrinol Metab 2009, 23, 735–51.
- Bogazzi F, Bartalena L, Martino E. Approach to the patient with amiodarone-induced thyrotoxicosis. J Clin Endocrinol Metab 2010, 95: 2529-35.
- Hughes PJ, et al. Dronedarone: an alternative to amiodarone? Consult Pharm 2010, 25: 555-69.
Tireopatie da inibitori dei check-point immunitari
Andrea Corsello
Unità di Chirurgia Endocrina, Ospedale Isola Tiberina–Gemelli Isola, Roma
Dipartimento di Medicina e Chirurgia Traslazionale, Università Cattolica del Sacro Cuore, Roma
(aggiornato al 30 giugno 2025)
Introduzione ed epidemiologia
Negli ultimi anni gli inibitori dei check-point immunitari (ICI) hanno rivoluzionato il trattamento di diversi tipi di carcinomi, introducendo anche una nuova gamma di effetti collaterali, classificati come eventi avversi immuno-correlati (EAIC), principalmente dovuti all’attivazione generalizzata del sistema immunitario. Tra questi, quelli endocrini sono particolarmente rilevanti, poiché possono causare danni permanenti e influenzare in modo significativo la qualità di vita e la sopravvivenza. Gli EAIC endocrini colpiscono più frequentemente la tiroide (tiroidite), l’ipofisi (ipofisite), le surrenali (adrenalite) e il pancreas (diabete insulino-dipendente).
Le tireopatie sono il più frequente EAIC endocrino correlato a ICI, con incidenza variabile a seconda del regime utilizzato e dell’inclusione o meno dei disturbi subclinici. In generale, il range di incidenza di tireopatie conclamate correlate a ICI è 8.9-22.2%, con frequenza maggiore in corso di terapia combinata ipilimumab-nivolumab (anti-CTLA-4 + anti-PD-1) o mono-terapia con anti-PD-1 rispetto a mono-terapia con anti-PD-L1 o anti-CTLA-4 (figura 1) (1,2).
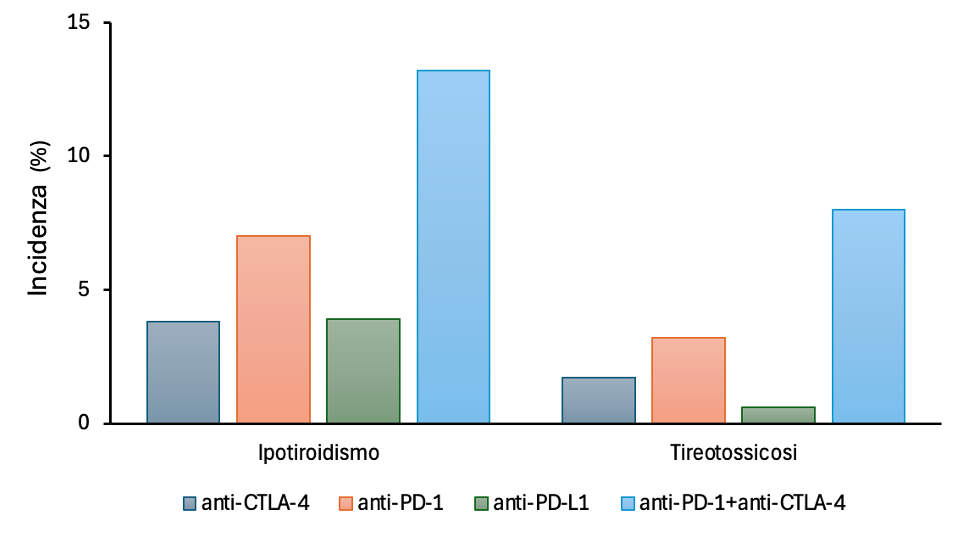
Figura 1. Incidenza delle disfunzioni tiroidee indotte dai diversi regimi di ICI (dati tratti da 2).
Presentazione clinica
La disfunzione tiroidea indotta da ICI sembra il risultato di una tiroidite distruttiva. In accordo con questa ipotesi, è stato osservato un tipico andamento bifasico: una prima fase transitoria di tireotossicosi che compare precocemente (entro 2-6 settimane dall’inizio della terapia), seguita da una fase di ipotiroidismo persistente, che insorge tra la 8° e la 12° settimana.
Sono state riportate anche altre presentazioni cliniche, come l’insorgenza di ipotiroidismo isolato, persistente o transitorio, non preceduto dalla fase di tireotossicosi, oppure la tireotossicosi isolata seguita dal ripristino spontaneo dell’eutiroidismo.
Nonostante gli esami di funzione tiroidea (FT3, FT4, TSH) risultino spesso marcatamente alterati, la maggior parte dei pazienti presenta sintomi lievi. È quindi ipotizzabile che durante questi cambiamenti marcati ma repentini dei livelli di ormoni tiroidei i pazienti possano rimanere clinicamente eutiroidei e i sintomi gravi tenderebbero a manifestarsi solo nei casi di tireotossicosi prolungata o di ipotiroidismo non prontamente riconosciuto e trattato. In particolare, la fase di tireotossicosi può essere talmente precoce e transitoria da non essere diagnosticata e quindi riportata negli studi. Questo spiegherebbe sia la mancata insorgenza di sintomi severi che la maggior frequenza di ipotiroidismo “isolato” riportata dagli studi.
Riuscire a prevedere l’evoluzione verso l’ipotiroidismo è utile, perché permette di prevenire l’insorgenza di sintomi e quindi di evitare dilazioni nella somministrazione degli ICI. Analisi condotte su una coorte di 50 pazienti con tireopatia correlata ad anti-PD-1 hanno dimostrato che una tireotossicosi grave a insorgenza rapida è fortemente associata a maggiore probabilità di evoluzione verso l’ipotiroidismo. Inoltre, la presenza di anticorpi anti-tireoglobulina (TgAb) durante la fase tireotossica rappresenta un ulteriore fattore predittivo per lo sviluppo di ipotiroidismo (3).
Il quadro ecografico tipico della tireotossicosi da ICI consiste nella presenza di aree ipoecogene, disomogeneità parenchimale, vascolarizzazione globalmente ridotta, e progressiva atrofia.
Lo sviluppo di morbo di Basedow-Graves e di orbitopatia tiroidea sono stati descritti solo in rari casi, sia con anti-CTLA-4 che con anti-PD-1. In alcuni di questi pazienti, i TRAb sono risultati negativi e la diagnosi è stata possibile solo attraverso l’attenta valutazione del contesto clinico, ecografico e scintigrafico (4,5).
Fattori di rischio
Diversi studi hanno cercato di identificare possibili fattori di rischio per l’insorgenza di tireopatie durante la terapia con ICI. I principali fattori per cui è stato ipotizzato un ruolo predittivo sono:
- positività degli auto-anticorpi tiroidei (TgAb e TPOAb);
- livelli “elevati” di TSH (> 4.9 mU/L);
- aumentata captazione tiroidea di 18F-FDG alla PET;
- elevato indice di massa corporea (BMI);
- precedente terapia con inibitori della tirosin-chinasi (TKI).
Tra questi, quello maggiormente studiato è lo stato anticorpale in pazienti che hanno ricevuto terapia con anti-PD-(L)1. Diversi autori hanno, infatti, riportato come la positività anticorpale (in particolare TgAb) prima di iniziare la terapia con anti-PD-(L)1 si associ ad maggior rischio di sviluppare tireopatie conclamate (6,7). Anche lo sviluppo di una positività di TgAb durante il trattamento con pembrolizumab (anti-PD-1), in pazienti con negatività anticorpale allo stato basale, sembra correlato a rischio aumentato di tireopatia da ICI (8).
Nel complesso però, non ci sono ancora evidenze definitive che supportino un ruolo causale degli auto-anticorpi nella patogenesi delle tireopatie da ICI e che la positività allo stato basale o lo sviluppo di positività anticorpale durante il trattamento aumentino il rischio di questa complicanza. Infine, poiché è indispensabile il monitoraggio routinario di TSH ed FT4 durante la terapia con ICI, la misurazione ad ogni ciclo degli auto-anticorpi tiroidei probabilmente non faciliterebbe la diagnosi di disfunzioni tiroidee, ma comporterebbe un aumento dei costi.
Associazione con la prognosi
In linea teorica, lo sviluppo di EAIC potrebbe riflettere una risposta immunitaria più significativa ed essere quindi associato a miglioramento della sopravvivenza. Numerosi studi hanno approfondito questo aspetto, indagando l’associazione tra vari EAIC e gli esiti clinici in diversi tipi di tumore, con risultati non sempre concordanti. Anche per quanto riguarda le tireopatie, i dati sul possibile miglioramento della prognosi non sono conclusivi. In particolare, la maggior parte degli studi in pazienti con carcinoma polmonare non a piccole cellule trattati con anti-PD-1 hanno evidenziato una correlazione positiva tra lo sviluppo di tireopatie e miglior sopravvivenza (sia libera da progressione che co9mplessiva), ma questo risultato non è stato confermato in altri studi e non è stato osservato in pazienti con altri tipi di tumore (in particolare il melanoma) (9).
Sulla base dell’osservazione che lo stesso EAIC può essere correlato o meno alla prognosi a seconda della primitività del tumore, è emersa l’ipotesi che antigeni comuni sia al sito primitivo del tumore sia al tessuto danneggiato possano contribuire agli effetti prognostici degli EAIC (9). Uno studio pilota ha identificato auto-anticorpi tiroidei specifici, diversi da TgAb e TPOAb, in pazienti con EAIC tiroidei sottoposti a terapia con anti-PD-1, suggerendo la possibile presenza di antigeni comuni coinvolti nella risposta immunitaria (10).
Gestione clinica (figura 2)
Prima dell’inizio della terapia con ICI è utile eseguire uno screening della funzione tiroidea tramite dosaggio di FT4 e TSH. Questo è utile non solo perché permette la diagnosi e il trattamento di eventuali tireopatie già presenti e non note, ma soprattutto perché la presenza di una disfunzione tiroidea pre-esistente può complicare la diagnosi di EAIC tiroidei, quando ci si basa su una singola misurazione eseguita in corso di trattamento.
Successivamente, come raccomandato dalla maggior parte delle linee guida (ASCO, ESMO, ESE), è utile un monitoraggio di FT4 e TSH ogni 4-6 settimane (11). In particolare, il monitoraggio dopo quattro settimane dall’inizio dalla terapia è utile al fine di poter identificare la fase transitoria di tireotossicosi. È indubbia l’utilità del dosaggio dell’FT4, e non solo del TSH, sia per valutare il grado di tireotossicosi che perché affidarsi esclusivamente al TSH può portare ad errori interpretativi (in particolare in casi in cui sono utilizzati in concomitanza anti-CTLA-4). L’ipotiroidismo centrale dovuto a EAIC ipofisari è infatti relativamente frequente con gli anti-CTLA-4 e può presentarsi con valori bassi di TSH, simulando una tireotossicosi.
Durante la fase di tireotossicosi, il dosaggio degli anticorpi anti-recettore del TSH (TRAb) è utile per la diagnosi differenziale con i rari casi di morbo di Basedow-Graves associati a ICI.
Come precedentemente accennato, il dosaggio dei TgAb e TPOAb ad ogni ciclo di trattamento non è necessario, ma può essere utile al momento della diagnosi di tireopatia da ICI (sia tireotossicosi che ipotiroidismo) per un inquadramento completo del paziente.
Generalmente alla diagnosi di tireopatia da ICI eseguiamo sempre anche l’ecocolordoppler della tiroide, che aiuta nel distinguere la tireotossicosi dal morbo di Basedow-Graves e può fornire informazioni sulla probabilità che l’ipotiroidismo sia persistente (es. tiroide atrofica).
In caso di sospensione degli ICI è raccomandato proseguire il monitoraggio della funzione tiroidea (TSH e FT4), poiché le disfunzioni possono manifestarsi anche a distanza di tempo. Il controllo può essere effettuato con cadenza meno frequente (ad esempio ogni 6–12 mesi o in presenza di sintomi o segni clinici suggestivi) per almeno due anni.
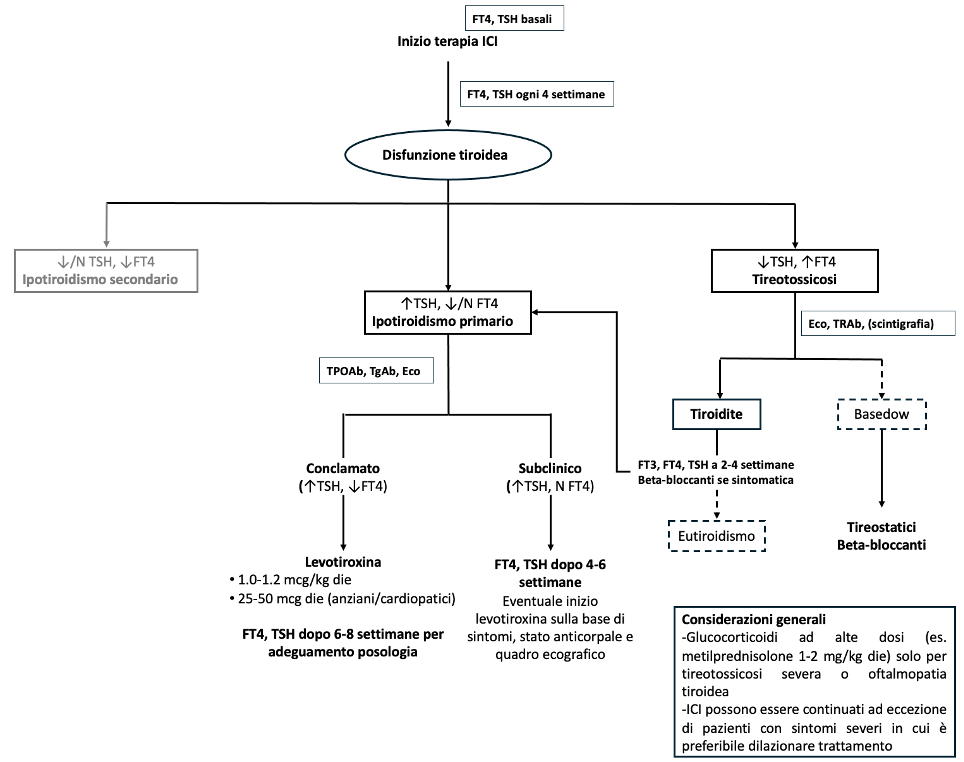
Figura 2. Flow-chart della gestione clinica delle tireopatie da inibitori dei checkpoint immunitari (ICI).
Le linee tratteggiate indicano uno scenario meno frequente rispetto alle linee continue. ↑: aumentato; N: normale; ↓: ridotto
Per quanto riguarda il trattamento, i casi di tireotossicosi sono per la maggior parte pauci-sintomatici e di breve durata ed è quindi sufficiente la semplice osservazione. Nella pratica clinica, monitoriamo FT4 e TSH ogni 2-3 settimane al fine di verificare la risoluzione spontanea e l’eventuale transizione verso l’ipotiroidismo.
Nei pazienti con tireotossicosi sintomatica è raccomandato l’uso dei ß-bloccanti (es. propranololo 40-80 mg/die come dose iniziale). L’utilizzo di glucocorticoidi ad alte dosi è sconsigliato, eccetto nei casi di tireotossicosi grave e sintomatica e nei rari casi di orbitopatia tiroidea. Non esistono infatti evidenze a supporto dell’efficacia terapeutica dei glucocorticoidi nel ridurre il rischio di danno tiroideo e di successivo ipotiroidismo. Tuttavia, nei casi di tireotossicosi severa, possono essere impiegati per ridurre la conversione periferica di T4 in T3. Anche i tireostatici sono impiegati raramente, considerato che la maggior parte dei casi è dovuta a ressi follicolare e non a ipersecrezione ormonale.
Nei pazienti che sviluppano ipotiroidismo conclamato, il trattamento consiste nella somministrazione di levotiroxina (LT4). Spesso, dopo la fase di tireotossicosi, si assiste ad una riduzione netta e repentina dei valori di FT4 (ed FT3) con valori di TSH anche marcatamente elevati (> 50-100 mIU/L). Pertanto, il dosaggio iniziale di LT4 deve essere quasi sostitutivo (circa 1.0-1.2 µg/kg die). In pazienti anziani con comorbilità cardiologiche si preferisce maggior cautela, utilizzando dosaggi iniziali di 25-50 µg/die di LT4. Il monitoraggio degli esami di funzione tiroidea dopo 6-8 settimane permette l’adeguamento della posologia.
Nei pazienti che invece sviluppano ipotiroidismo subclinico o comunque con valori di TSH < 10 mUI/L, si può proseguire con la semplice osservazione e rivalutare la necessità della terapia sostitutiva dopo 4-6 settimane. Analogamente, nei pazienti che sono ben compensati con un basso dosaggio di levotiroxina (< 1.0 µg/kg die) andrebbe considerata la possibile ripresa della funzione tiroidea e tentata la riduzione/sospensione della terapia.
Una considerazione importante riguarda l’eventuale sospensione degli ICI. Non esiste alcuna evidenza che tale sospensione aumenti le probabilità di recupero della funzione endocrina. Salvo in pazienti particolarmente sintomatici, la terapia con ICI può essere continuata senza dilazioni. In particolare, come anticipato precedentemente, spesso si osservano valori di FT4 e TSH marcatamente alterati (sia in casi di tireotossicosi che di ipotiroidismo) ma i pazienti sono pauci-sintomatici ed è sufficiente l’inizio di una terapia con ß-bloccanti o sostitutiva con LT4 senza dover dilazionare il trattamento oncologico (11). In caso di pazienti sintomatici con compromissione del benessere generale, può essere considerato un breve rinvio della somministrazione degli ICI (1-2 settimane), per consentire il recupero clinico ed evitare che eventuali eventi avversi di nuova insorgenza possano aggravare ulteriormente la situazione.
Bibliografia
- Chang LS, Barroso-Sousa R, Tolaney SM, et al. Endocrine toxicity of cancer immunotherapy targeting immune checkpoints. Endocr Rev 2019, 40: 17-65.
- Barroso-Sousa R, Barry WT, Garrido-Castro AC, et al. Incidence of endocrine dysfunction following the use of different immune checkpoint inhibitor regimens: a systematic review and meta-analysis. JAMA Oncology 2018, 4: 173-82.
- Yamauchi I, Hakata T, Sugawa T, et al. Prediction-based prompt levothyroxine replacement to prevent a hypothyroid state after immune-related adverse events involving the thyroid gland. Endocr J 2023, 70: 987-98.
- Brancatella A, Viola N, Brogioni S, et al. Graves’ disease induced by immune checkpoint inhibitors: a case report and review of the literature. Eur Thyroid J 2019, 8: 192-5.
- Sagiv O, Kandl TJ, Thakar SD, et al. Extraocular muscle enlargement and thyroid eye disease-like orbital inflammation associated with immune checkpoint inhibitor therapy in cancer patients. Ophthalmic Plast Reconstr Surg 2019, 35: 50-2.
- Zhou X, Iwama S, Kobayashi T, et al. Risk of thyroid dysfunction in PD-1 blockade is stratified by the pattern of TgAb and TPOAb positivity at baseline. J Clin Endocrinol Metab 2023, 108: e1056-62.
- Kobayashi T, Iwama S, Yamagami A, et al. Elevated TSH level, TgAb, and prior use of ramucirumab or TKIs as risk factors for thyroid dysfunction in PD-L1 blockade. J Clin Endocrinol Metab 2022, 107: e4115-23.
- Osorio JC, Ni A, Chaft JE, et al. Antibody-mediated thyroid dysfunction during T-cell checkpoint blockade in patients with non-small-cell lung cancer. Ann Oncol 2017, 28: 583-9.
- Yamauchi I, Yabe D. Best practices in the management of thyroid dysfunction induced by immune checkpoint inhibitors. Eur Thyroid J 2025, 14: e240328.
- Yamauchi I, Yasoda A, Hakata T, et al. Novel thyroid-specific autoantibodies in patients with immune-related adverse events involving the thyroid gland. Thyroid Sci 2024, 1: 100009.
- Husebye ES, Castinetti F, Criseno S, et al. Endocrine-related adverse conditions in patients receiving immune checkpoint inhibition: an ESE clinical practice guideline. Eur J Endocrinol 2022, 187: G1-21.
Resistenza agli ormoni tiroidei
Paolo Beck-Peccoz1 e Luca Persani2
Dipartimento di Scienze Cliniche e di Comunità, Università degli Studi di Milano; 1Fondazione IRCCS Cà Granda Policlinico e 2IRCCS Istituto Auxologico Italiano, Milano
Definizione e classificazione
Meccanismi diversi possono determinare una insensibilità tissutale all’azione degli ormoni tiroidei, che si traduce in un quadro biochimico caratterizzato da livelli elevati di uno o di entrambi gli ormoni tiroidei circolanti liberi (FT4 ed FT3), in presenza di concentrazioni misurabili di TSH. Alterazioni genetiche lungo le vie d’azione degli ormoni tiroidei, quali il trasporto attraverso la membrana cellulare, la desiodazione intra-cellulare e l’azione nucleare attraverso i recettori per gli ormoni tiroidei alfa e beta (TRalfa e TRbeta), possono creare resistenza all’azione ormonale (RTH) (1-5).
La forma “classica” di RTH è quella in cui mutazioni del gene che codifica per il TRbeta impediscono il normale legame dell’ormone al recettore, o interferiscono con la complessa interazione tra il recettore e i suoi cofattori, principalmente i corepressori (6). La mutazione è generalmente in eterozigosi ed il fenomeno della “dominanza negativa” spiega perché il recettore mutato impedisca la piena attività del recettore normale.
Forme più recenti di insensibilità all’azione degli ormoni tiroidei sono quelle legate ad altre mutazioni.
- Nella mutazione del trasportatore della T3 attraverso la membrana cellulare (MCT8: monocarboxylate transporter 8) (7), la T3 non è in grado di penetrare nelle cellule neuronali del sistema nervoso centrale (ricchissime di MCT8), così causando un gravissimo danno psicomotorio ai pazienti maschi affetti (il gene MCT8 è sul cromosoma X).
- Nella mutazioni di una particolare proteina, la SECISBP2 (selenocysteine insertion sequence-binding protein 2) (8), parte del complesso di proteine coinvolte nell’incorporazione del selenio in vari enzimi (tra cui le desiodasi), viene impedita l’incorporazione della selenocisteina nelle desiodasi, così che il normale metabolismo intra-cellulare degli ormoni tiroidei viene più o meno completamente alterato.
Quadro biochimico
In ogni forma di RTH, il dato saliente è la presenza di livelli di TSH dosabili o anche modestamente elevati in fronte a concentrazioni di ormone tiroideo circolante libero elevati: nella RTH classica sia la FT4 che la FT3 sono elevate, mentre nel caso di mutazioni dell’MCT8 solo la FT3 è elevata e nel caso delle mutazioni di SECISBP2 è elevata solo l’FT4 (tab. 1).
| Tabella 1 Cause di insensibilità all’azione degli ormoni tiroidei e geni responsabili |
||||||
| Forma | Gene | FT4 | FT3 | TSH | rT3 | SHBG |
| RTH “classica” | THRbeta | ↑ | ↑ | N o poco ↑ | ↑ | N |
| Difetto del trasporto intracellulare di T3 (s. di Allan-Herndon-Dudley) | MCT8 | N o al limite basso | ↑ | N o poco ↑ | ↓ | ↑ |
| Alterazioni del metabolismo degli ormoni tiroidei (deficit di SECISBP2) | SBP2 | ↑ | N o al limite basso | N o poco ↑ | ↑ | N |
Di fondamentale importanza è escludere l’interferenza di possibili fattori circolanti nel dosaggio degli ormoni tiroidei liberi (tab. 2). Tecniche basate sul dosaggio “two-step” sono le più appropriate, mentre dosaggi “one-step” o basati sull’utilizzo del cosiddetto “analogo” risultano molto sovente in risultati falsamente elevati (9, 10). Meno interferito al momento attuale è il dosaggio del TSH eseguito con metodi ultrasensibili basati sul metodo non competitivo cosiddetto a “sandwich”. Nel sospetto di una interferenza nel dosaggio del TSH, le misurazioni del TSH dopo diluizione del campione e dopo test di recupero (siero + vari punti della curva standard) possono confermarlo o escluderlo.
| Tabella 2 Situazioni cliniche in cui si possono osservare elevati livelli di ormoni tiroidei (totali o liberi) e concentrazioni misurabili di TSH |
||||||
| Situazione | TT4 | TT3 | FT4 | FT3 | rT3 | TSH |
| Aumento delle proteine di trasporto | ↑ | ↑ | N | N | N | N |
| Familial dysalbuminemic hyperthyroxinemia | ↑ | N/↑ | N* | N* | ↑ | N |
| Anticorpi anti-T3 e/o anti-T4 | ↑ | N | N | ↑ | N | N |
| Anticorpi anti-TSH (paziente ipertiroideo) | ↑ | ↑ | ↑ | ↑ | N | N |
| Malattie non tiroidee (NTI) | ↓ | ↓ | N/↓ | ↓ | ↑ | N/↓ |
| Disordini psichiatrici acuti | ↑ | N | ↑ | N | N | N/↑ |
| Terapia con L-T4 (compresa la mancata aderenza alla terapia) | N | N | ↑ | N | N | N |
| Adenomi ipofisari TSH-secernenti | ↑ | ↑ | ↑ | ↑ | ↑ | N |
| Resistenza all’azione degli ormoni tiroidei | ↑ | ↑ | ↑ | ↑ | ↑ | N |
| Difetto del trasporto intracellulare della T3 | N o poco ↓ | ↑ | N | ↑ | ↓ | N o poco ↑ |
| Alterazioni del metabolismo degli ormoni tiroidei | ↑ | N/↓ | ↑ | N/↓ | ↑ | N/↑ |
* Misurati con metodi diretti di dialisi all’equilibrio o metodi “two-step”. Interferenze metodologiche risultanti in valori di FT3 e/o FT4 falsamente elevati possono essere reperiti con metodi differenti da quelli suddetti.
Quadro clinico
Nella forma “classica” da mutazioni del gene codificante il TRbeta, il quadro clinico della RTH si presenta in due forme diverse (11, 12):
- quella di resistenza generalizzata (GRTH), in cui è costante la presenza di gozzo e, raramente, si può assistere ad un rallentamento della crescita corporea, con raggiungimento comunque dell’altezza target familiare;
- quella presente prevalentemente a livello ipofisario (PRTH), in cui, oltre al gozzo, sono presenti segni e sintomi di ipertiroidismo, pur incostanti e variabili nel tempo. Tra questi si rilevano tachicardia, deficit di attenzione con iperattività, difficoltà a concentrarsi, insonnia e nervosismo. Si ritiene che la PRTH sia dovuta a mancanza di effetto dominante negativo del gene mutato sui recettori normali in tessuti che esprimono prevalentemente il TRalfa, che, essendo normale, risponde in maniera appropriata agli alti livelli circolanti di ormone tiroideo.
Gravissimo è invece il quadro clinico dei pazienti maschi con mutazioni del trasportatore MCT8 (7). Pur normali alla nascita, presentano nei primi anni di vita ipotonia, che via via progredisce in spasticità della muscolatura distale e difficoltà nel controllo della posizione del capo. Il peso corporeo è estremamente ridotto, sia per l’atrofia muscolare che per la difficoltà ad alimentarsi, dato che non riescono a deglutire normalmente. In età adulta non sono in grado né di stare seduti, né di tenere la posizione eretta o di camminare. Il quoziente intellettivo è molto basso (< 40). Il rilievo di elevati livelli di SHBG e di ridotti livelli di colesterolo, indica che a livello epatico è presente un grave quadro di ipertiroidismo, contrastante con il quadro neurologico di grave ipotiroidismo.
Meno grave è il quadro clinico dei pazienti affetti da disordini del metabolismo degli ormoni tiroidei dovuto a mutazione della SECISBP2: è molto variabile da soggetto a soggetto, con ritardo di crescita in periodo prepubere, lieve perdita di udito, possibile distrofia muscolare assiale, ipotonia, colite ed aumento della massa grassa con insulino-resistenza. In un giovane maschio è stata documentata infertilità per azoospermia (8).
Diagnosi differenziale
Particolarmente nei pazienti con PRTH, il reperto di un TSH dosabile in presenza di elevati livelli di FT4 ed FT3 permette di escludere ogni altra forma di ipertiroidismo. La diagnosi differenziale, quindi, si pone sostanzialmente tra RTH ed adenoma ipofisario TSH-secernente (TSHoma) (tab. 3). Non sono dimostrate differenze nei livelli ormonali circolanti, né significative differenze nei segni e sintomi clinici di ipertiroidismo. La misurazione dell’alfa-subunità degli ormoni glicoproteici (a-GSU) ed il calcolo del suo rapporto molare con il TSH (a-GSU/TSH m.r.) possono essere utili, ma nei microadenomi sono entrambi sovente normali. La valutazione di alcuni parametri periferici dell’azione degli ormoni tiroidei (SHBG: sex homone-bindin globulin, ACE: angiotensin converting enzyme, ICTP: carboxy terminal telopeptide of type 1 collagen, osteocalcin and sIL-2R: soluble interleukin-2 receptor) è molto utile, risultando solitamente nel range dell’ipertiroidismo nei TSHomi e normale nella RTH, particolarmente nella PRTH (13, 14).
La risposta del TSH al TRH è sempre normale nella RTH, mentre nei TSHomi è assente o ridotta, ma eccezioni con normale risposta sono state riportate da vari autori.
Il test di inibizione del TSH con T3 (80-100 µg/die per 8-10 giorni) è forse il test più sensibile in questa diagnostica differenziale: i pazienti con TSHoma non sopprimono mai i loro livelli di TSH, mentre quelli con RTH hanno una risposta qualitativamente simile a quella dei soggetti normali con totale inibizione del TSH alla fine del test. Contrariamente a quanto osservato nei normali, nei pazienti con RTH alla fine del test di soppressione con T3 è presente la risposta al TRH, a volte in maniera decisamente consistente.
Molto utile appare un semplice dosaggio di TSH, FT4 ed FT3 nei parenti stretti del paziente: il reperto di genitori, fratelli o figli con lo stesso quadro biochimico indica sempre la presenza di RTH.
La RM o la TC sono utili nell’indicare la presenza di un TSHoma, ma attenzione deve essere posta ai cosiddetti “incidentalomi” ipofisari, frequentemente reperiti in pazienti con RTH.
Infine, il trattamento con analoghi a lunga durata di azione della somatostatina (lanreotide o octreotide), somministrati ogni 28 giorni per 2-3 mesi, dimostra che solo i TSHomi riducono i livelli di TSH e degli ormoni circolanti liberi e che ciò non accade nei pazienti con RTH. Purtroppo, anche questo test non è patognomonico, in quanto circa il 5% dei soggeti con TSHoma non risponde agli analoghi della somatostatina.
Infine, il reperto di mutazioni del gene che codifica per il TRbeta indica con certezza la presenza di una RTH.
| Tabella 3 Parametri utili nella diagnosi differenziale tra RTH e TSHoma |
||
| Parametro | RTH | TSHoma |
| SHBG, a-GSU, a-GSU/TSH m.r.a | N | ↑ |
| Risposta del TSH al TRH | N | Assente |
| Inibizione del TSH dopo T3 | Qualitativamente, ma non quantitativamente N | Assente |
| Risposta del TSH al TRH dopo inibizione con T3 | Presente | Assente |
| RM o TC regione ipofisaria | Negativa | Positiva |
| Test con analoghi della somatostatinab | Negativo | Positivo |
| Parenti affetti | Sì | No |
| Mutazioni del gene TRbeta | Sì | No |
a SHBG: Sex Hormone-Binding Globulin; a-GSU: alfa subunità degli ormoni glicoproteici; a-GSU/TSH m.r.: rapporto molare tra alfa-subunità e TSH.
b Lanreotide o octreotide somministrati ogni 28 giorni per 2-3 mesi.
Terapia
Non esistono al giorno d’oggi trattamenti che possano correggere i difetti molecolari responsabili delle varie forme di resistenza all’azione degli ormoni tiroidei.
Nei pazienti con la forma classica di RTH e segni e/o sintomi di ipertiroidismo, soprattutto tachicardia, la somministrazione di ß-bloccanti cardioselettivi (atenololo o altri) è in grado di essere risolutiva nella maggioranza dei casi. Non è indicato il propranololo che, bloccando la trasformazione della T4 a T3, potrebbe aggravare uno stato di ipotiroidismo a livello di determinati organi. Assolutamente controindicati sono i farmaci anti-tiroidei (metimazolo o propiltiouracile) che, riducendo la sintesi degli ormoni tiroidei, attivano il meccanismo di feed-back negativo con conseguente ipersecrezione di TSH e conseguente aumento del volume del gozzo, possibile formazione di noduli (anche maligni) ed induzione di iperplasia ipofisaria.
Nei bambini e negli adulti con PRTH si è dimostrata utile la terapia con acido triiodo-tiroacetico (TRIAC: 1.4-2.8 mg/die, in almeno 3 diverse somministrazioni). Il TRIAC non è disponibile in Italia, ma molte farmacie lo possono preparare come galenico (in compresse da 0.35 mg). Infatti, il TRIAC riduce i livelli di TSH (e la sua attività biologica che è aumentata nei pazienti con RTH) e possiede una ridotta attività ormonale a livello dei vari tessuti. Si assiste così ad una lieve riduzione dei livelli circolanti di FT4 (non utilizzabili quelli di FT3 data la reazione crociata del TRIAC nei metodi di misurazione della T3), con beneficio soprattutto a livello cardiaco in caso di tachicardia o di fibrillazione atriale, per fortuna rara nei pazienti con RTH. Poco successo hanno avuto altri farmaci, quali la dopamina e gli analoghi della somatostatina. In caso di grave resistenza all’azione ormonale, con ritardo di crescita o altri segni di ipotiroidismo tissutale, è certamente indicato l’impiego di dosi sovrafisiologiche di LT4 (fino a 500 µg/die o anche più). Nei soggetti giovani, il parametro da seguire è essenzialmente clinico: ripresa della crescita, riduzione del deficit di attenzione e dell’iperattività, miglioramento della resa scolastica e del riposo notturno, attenuazione dei sintomi di nervosismo. Nessuna informazione utile pare venire dalla misurazione dei livelli ormonali o dei parametri dell’attività periferica degli ormoni tiroidei.
L’esperienza terapeutica nelle altre forme di insensibilità all’azione degli ormoni tiroidei è limitatissima, vista la rarità di tali malattie. Nel caso delle mutazioni del trasportatore MCT8, si sta tentando di somministrare durante la gravidanza analoghi dell’ormone tiroideo che passino la barriera placentare e possano entrare nelle cellule neuronali per mezzo di trasportatori diversi dall’MCT8. Nei soggetti adulti, alcuni risultati positivi sono stati raggiunti bloccando la sintesi ormonale con gli anti-tiroidei e somministrando dosi sostitutive di L-T4.
Nei soggetti con mutazioni della SECIBP2, sono stati fatti tentativi con somministrazione di selenio (i livelli di selenio in questi pazienti sono molto ridotti), ma senza successo. La somministrazione di agenti ossidanti, tocoferoli e licopene ha avuto successo nell’animale da esperimento, ma mancano dati nell’uomo.
Bibliografia
- Refetoff S, Weiss RE, Usala SJ. The syndromes of resistance to thyroid hormone. Endocr Rev 1993, 14: 348-99.
- Refetoff S, Dumitrescu AM. Syndromes of reduced sensitivity to thyroid hormone: genetic defects in hormone receptors, cell transporters and deiodination. Best Pract Res Clin Endocrinol Metab 2007, 21: 277-305.
- Agrawal NK, Goyal R, Rastogi A, et al. Thyroid hormone resistance. Postgrad Med J 2008, 84: 473-7.
- Gurnell M, Visser TJ, Beck-Peccoz P, et al. Resistance to Thyroid Hormone. In: Endocrinology, Adult and Pediatric (6th Edition, vol. II), edited by Jameson LJ and DeGroot LJ. Saunders Elsevier, Philadelphia, PA, 2010: pp. 1745-59.
- Refetoff S., Dumitrescu AM. Resistance to thyroid hormone. In Thyroid Disease Manager, 2010 Chapter 16D.
- Cheng SY, Leonard JL, Davis PJ. Molecular aspects of thyroid hormone actions. Endocr Rev 2010, 31: 139-70.
- Visser WE, Friesema EC, Visser TJ. Minireview: thyroid hormone transporters: the knowns and the unknowns. Mol Endocrinol 2011, 25: 1-14.
- Schoenmakers E, Agostini M, Mitchell C, et al. Mutations in the selenocysteine insertion sequence-binding protein 2 gene lead to a multisystem selenoprotein deficiency disorder in humans. J Clin Invest 2010, 120: 4220-35.
- Beck-Peccoz P, Persani L. TSH-producing adenomas. In: Endocrinology, Adult and Pediatric (6th Edition, vol. II), edited by Jameson LJ and DeGroot LJ. Saunders Elsevier, Philadelphia, PA, 2010: pp. 324-32.
- Gurnell M, Halsall DJ, Chatterjee VK. What should be done when thyroid function tests do not make sense? Clin Endocrinol (Oxf) 2011, 74: 673-8.
- Beck-Peccoz P, Chatterjee VKK. The variable clinical phenotype in thyroid hormone resistance syndrome. Thyroid 1994, 4: 225-31.
- Beck-Peccoz P, Persani L, Calebiro D, et al. Syndromes of hormone resistance in the hypothalamic-pituitary-thyroid axis. Best Pract Res Clin Endocrinol Metab 2006, 20: 529-46.
- Beck-Peccoz P, Roncoroni R, Mariotti S, et al. Sex hormone-binding globulin measurement in patients with inappropriate secretion of thyrotropin (IST): evidence against selective pituitary thyroid hormone resistance in nonneoplastic IST. J Clin Endocrinol Metab 1990, 71: 19-25.
- Beck-Peccoz P, Piscitelli G, Cattaneo MG, et al. Successful treatment of hyperthyroidism due to nonneoplastic pituitary TSH hypersecretion with 3,5,3'-triiodothyroacetic acid (TRIAC). J Endocrinol Invest 1983, 6: 217-23.
I farmaci nella diagnostica e nella terapia delle tireopatie
Farmaci utilizzati nella terapia dell’ipertiroidismo
Farmaci utilizzati nella terapia dell’ipotiroidismo
Altri farmaci correlati alle patologie tiroidee
Altri farmaci correlati alle patologie tiroidee
Gregorio Reda
Endocrinologia, Ospedale Pertini, Roma
BETA-BLOCCANTI
Meccanismo d’azione
Bloccanti dei recettori ß-adrenergici (atenololo è ß1-selettivo). Alleviano i sintomi e segni dell’iperattività adrenergica caratteristica dell’ipertiroidismo, pur avendo scarso effetto sul processo fondamentale della malattia.
Il propranololo riduce anche significativamente la conversione del T4 in T3, permettendo un rapido miglioramento dei sintomi.
Proprietà farmacocinetiche
Il propranololo è assorbito rapidamente e quasi completamente (~90%). Il picco dei livelli plasmatici è raggiunto circa dopo 1-3 ore dall'assunzione per via orale.
L'aatenololo ha più lenta azione e più lunga emivita (circa 6 ore).
Preparazioni, via di somministrazione, posologia
Propranololo (Inderal): compresse da 40 mg o capsule rigide da 80 mg a rilascio prolungato
Atenololo:
- cp da 50 mg: Atenololo generico (EG, Hexal)
- cp 100 mg: Atenol, Seles beta, Tenomax, Tenormin, Tensiblock, Atenololo generico (ABC, Actavis, Almus, Alter, Aurobindo, DOC, EG, FG, Germed, Hexal, Mylan, Pensa, Ratiopharm)
Indicazioni
Vista la rapidità d’azione, è utile nel trattamento sintomatico dell’ipertiroidismo in associazione iniziale con i farmaci anti-tiroidei o con 131-I, nell’attesa del loro completo effetto terapeutico.
Contro-indicazioni
Asma bronchiale.
Effetti collaterali
Dispnea, bradicardia, ipotensione, sensazione di freddo agli arti, cianosi periferica.
Precauzioni d’uso
Da evitare nei pazienti con asma bronchiale o broncospasmo, scompenso cardiocircolatorio, ipotensione, bradicardia, blocco atrio-ventricolare di 2° e 3° grado, malattia del nodo del seno, blocco di branca, gravi disturbi della circolazione arteriosa periferica, feocromocitoma non pretrattato con alfa-bloccanti. Non associare a verapamil e diltiazem.
Uso in gravidanza
Non è controindicato in gravidanza, ma deve essere impiegato per brevi periodi ed al minimo dosaggio efficace. Nella fase tireotossica aiuta a ridurre tremori, tachicardia, ansia. La somministrazione nel terzo trimestre di gravidanza può provocare ritardo di crescita fetale, placenta piccola, bradicardia fetale, ipoglicemia neonatale, inadeguato adattamento all’ipossia.
Uso durante l’allattamento
Può essere usato poiché è secreto nel latte materno in bassissime quantità, al minimo dosaggio efficace.
Limitazioni prescrittive
No
Farmaci contenenti iodio
Gregorio Reda
Endocrinologia, Ospedale Pertini, Roma
| Nome commerciale | Gruppo terapeutico | Composizione | Preparati | Contenuto iodio |
| Cordarone, Amiodarone, Amiodar | cardiovascolari anti-aritmici | amiodarone cloridrato | cp 200 mg | 75 mg/cp |
| fl 150 mg | 56.2 mg/fl = 18.7 mg/mL | |||
| Antoral | antisettici del cavo orale | tibenzonio ioduro | colluttorio | 0.1 mg/mL |
| gomma da masticare | 1.03 mg per gomma | |||
| gel dentifricio | 0.54 mg/mL | |||
| pastiglie | 1.03 mg per pastiglia | |||
| soluzione spray | 0.1 mg/mL | |||
| Betadine | disinfettanti per uso topico | iodopovidone | soluzione cutanea 10%, 125 ml | 1.0 gr per 100 mL |
| spray cutaneo soluzione 5% | 0.5 g per 100 mL | |||
| colluttorio 1% | 0.1 g per 100 mL | |||
| gel 10% | 1.0 g per 100 grammi | |||
| garze impregnate 10% | 0.025 g per garza | |||
| soluzione cutanea 10% ginecologica, per genitali esterni | 1.0 g per 100 mL | |||
| Cinetic | sostanze ormonali | tiroide secca microgranuli | compresse | 0.150 mg iodio organico/cp |
| Diagran minerale rafforzato | vitamine e minerali | confetti | 0.2 mg potassio ioduro/confetto | |
| Soluzione di Lugol | vitamine e minerali | 5% di iodio molecolare e 10% di ioduro di potassio | soluzione | 130 mg/mL = 6.5 mg/goccia |
| Soluzione satura di ioduro di potassio | vitamine e minerali | ione ioduro | soluzione | 1000 mg/mL = 36 mg di ioduro per goccia |
| Gastrografin | mezzi di contrasto radiologici | sodio aminotrizoato e meglumina amidotrizoato | 370 mg/mL | |
| Thirodium | integratore alimentare a base di iodio | iodio | capsule molli | 50-100-225 µg |
| Tintura di iodio | disinfettanti per uso topico | 7% di iodio e 5% ioduro di potassio | soluzione | 40 mg/mL |

