Terapia chirurgica tradizionale per la patologia tiroidea benigna
Corrado Pedroni, Verter Barbieri
Divisione ORL, Arcispedale S. Maria Nuova Reggio Emilia
La patologia benigna della tiroide suscettibile di trattamento chirurgico può essere diffusa o nodulare. La patologia diffusa comprende il gozzo multinodulare o diffuso, la malattia di Graves-Basedow, le tiroiditi autoimmuni.
In presenza di gozzo diffuso o multinodulare, le indicazioni chirurgiche sono rappresentate da disturbi compressivi, alterazioni funzionali o sospetta neoplasia.
La malattia di Graves-Basedow ha in prima istanza indicazione al trattamento medico o, in alternativa, radiometabolico con radioiodio. L’intervento chirurgico trova indicazione solo nelle forme con gozzo esteso, in quelle resistenti alla terapia medica o qualora il paziente rifiuti la terapia con radioiodio.
Le tiroiditi autoimmuni non hanno in genere indicazione chirurgica, che viene presa in considerazione solo quando si associa a voluminoso gozzo o si pone la diagnosi differenziale con il linfoma tiroideo o con altre neoplasie.
Gli interventi chirurgici previsiti per la patologia diffusa o multinodulare della tiroide sono:
- la tiroidectomia subtotale, in cui si lascia una striscia di tessuto tiroideo di 2-4 g nella porzione supero-laterale del lobo tiroideo, per evitare di dissecare il nervo ricorrente a livello del legamento di Berry e di devascolarizzare la paratiroide superiore;
- la tiroidectomia quasi-totale (near-total thyroidectomy), in cui si lascia meno di 1 g di tessuto tiroideo sulla faccia posteriore del lobo tiroideo, sempre a ridosso del legamento di Berry; questa tecnica offre qualche protezione al ricorrente ma i benefici in termini di preservazione vascolare della paratiroide superiore sono minimi;
- la tiroidectomia totale, in cui si deve fare ogni sforzo per asportare tutto il tessuto tiroideo senza residui grossolani o macroscopici, anche se in alcuni casi la dissezione accurata del nervo profondamente al legamento di Berry può risultare estremamente complicata, rendendo spesso impossibile la realizzazione di una vera tiroidectomia totale. Quindi, talora, la distinzione tra tiroidectomia totale e quasi-totale non dipende solo dall’intenzione del chirurgo ma anche e soprattutto dalla particolare situazione anatomica della tiroide di quel dato paziente.
L’indicazione alla tiroidectomia totale, già controversa nel carcinoma differenziato della tiroide, lo è ancor di più nella patologia tiroidea benigna (12,19,23-25). Se la tiroidectomia totale è unanimente considerata l’indicazione elettiva nella malattia di Graves-Basedow complicata da oftalmopatia progressiva (4,14,25), per il rischio concreto di un'ipertrofia secondaria del residuo, tale da riproporre nel tempo i problemi funzionali precedenti l‘intervento, la maggior parte dei chirurghi (2,3,11,12,15,19) non la considera un trattamento necessario nella restante patologia tiroidea benigna (gozzo multinodulare e diffuso, tiroiditi), e preferisce utilizzare tiroidectomia subtotale anche se deve lasciare un residuo macroscopico di tessuto tiroideo patologico. Altri (1,5,7,16,22), sono invece favorevoli all’indicazione alla tiroidectomia totale nel gozzo diffuso o multinodulare, perchè consente di prevenire il rischio di recidiva che un residuo di parenchima tiroideo patologico può comportare, anche in considerazione del fatto che una eventuale terapia ormonale soppressiva con L-tiroxina dopo tiroidectomia parziale spesso risulta inefficace nella prevenzione della recidiva (19,24) e, soprattutto, del fatto che un re-intervento aumenterebbe significativamente il rischio di danno paratiroideo e ricorrenziale.
Prima dell’intervento chirurgico tutti i pazienti devono essere sottoposti ad indagine ecografica e agoaspirazione ecoguidata dei noduli ecograficamente più sospetti. Nei gozzi voluminosi ad estensione mediastinica, in cui l’ecografia è spesso inadeguata per la valutazione del volume e dei rapporti del gozzo con le strutture circostanti, si deve utilizzare anche la TC o, meno spesso, la RMN. Il gozzo mediastinico può essere classificato sulla base delle immagini tomodensimetriche tridimensionali, graduando l’estensione del gozzo:
- in senso cranio-caudale:
- grado 1: sopra la convessità aortica
- grado 2: compreso tra convessità e concavità aortica
- grado 3: al di sotto della concavità aortica
- in senso antero-posteriore:
- tipo A: prevascolare
- tipo B: retro-vascolare e para-tracheale
- tipo C: retro-tracheale.
La probabilità di un approccio chirurgico extra-cervicale risulterà maggiore nel grado 3 e nel tipo C, sia mono (M) che bilaterale (B) (figura 1-6).
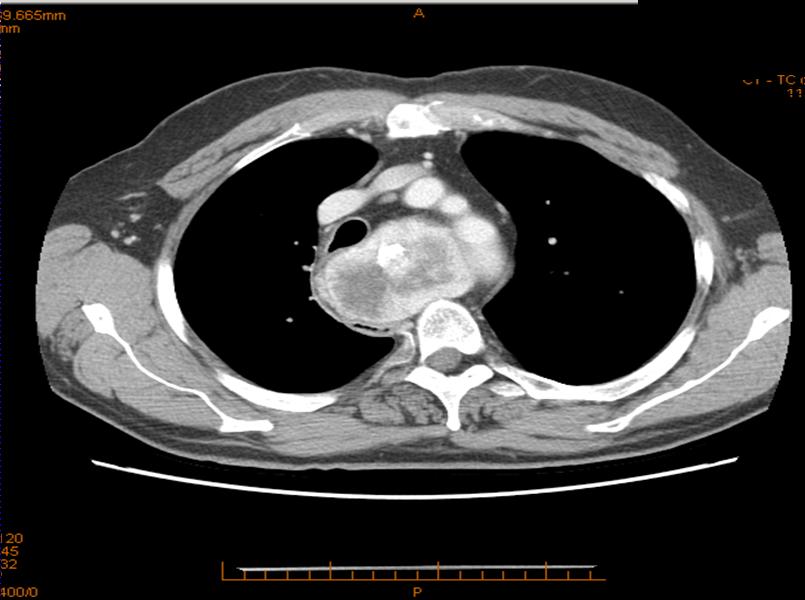
Figura 1. Sezione assiale di un caso di gozzo cervico-mediastinico grado 3 tipo C monolaterale
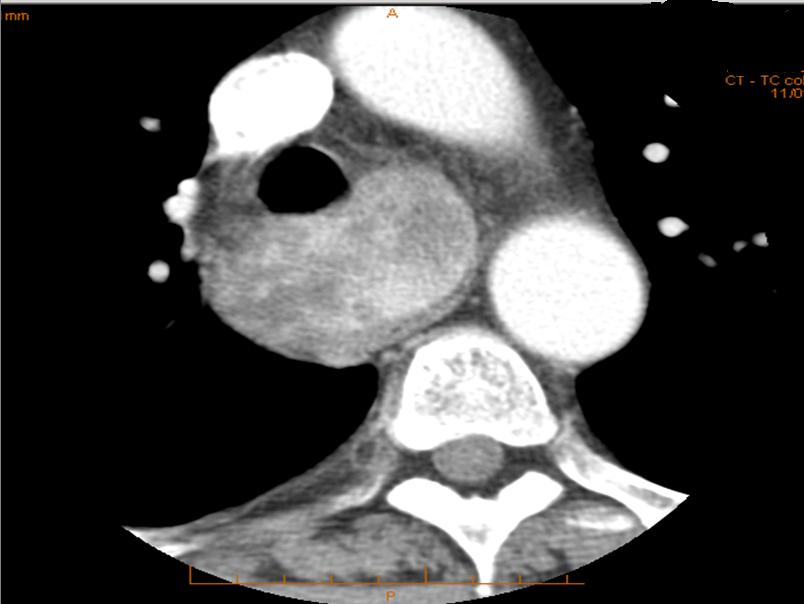
Figura 2. Gozzo cervico-mediastinico grado 3 tipo C (lo struma si estende al di sotto della concavità aortica e in sede retro-tracheale)
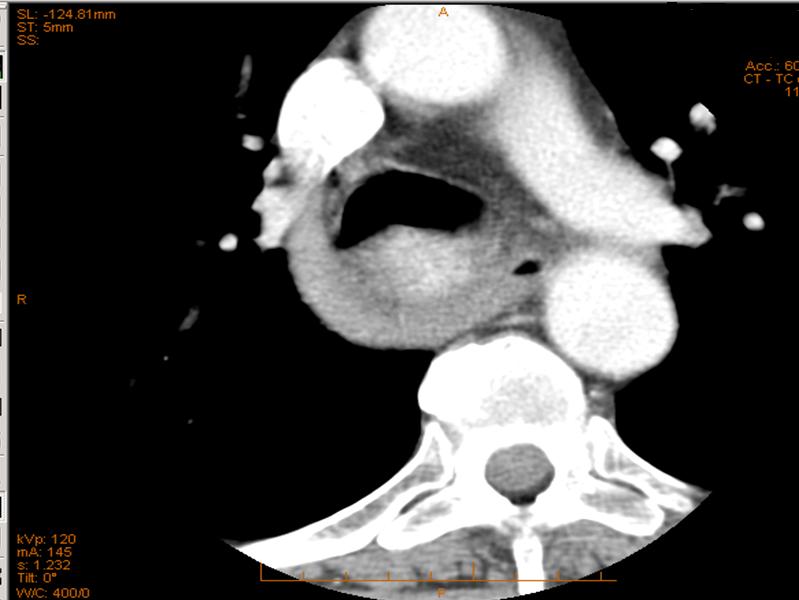
Figura 3. Dettaglio di un caso di gozzo cervico-mediastinico grado 3 tipo C monolaterale
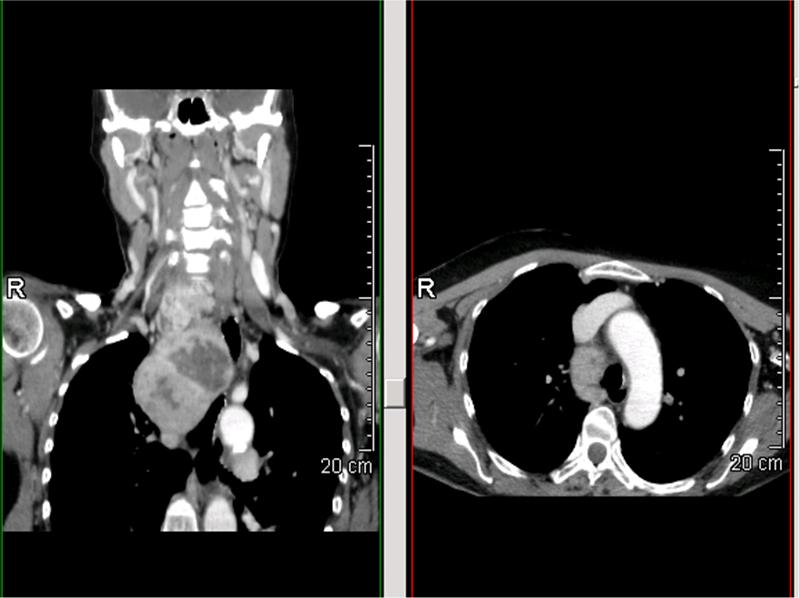
Figura 4. Sezione coronale e assiale di un caso di gozzo cervico-mediastinico grado 2 (compreso tra convessità e concavità aortica), tipo B (retro-vascolare e para-tracheale) monolaterale
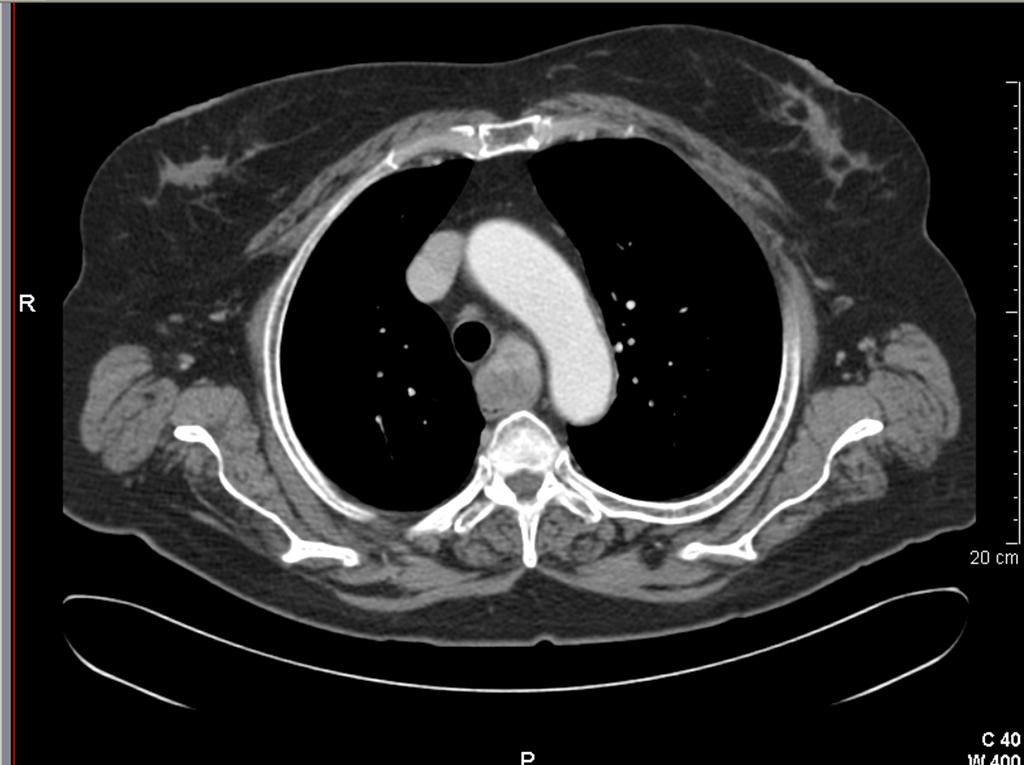
Figura 5. Sezione assiale di un gozzo cervico-mediastinico grado 2 tipo C monolaterale
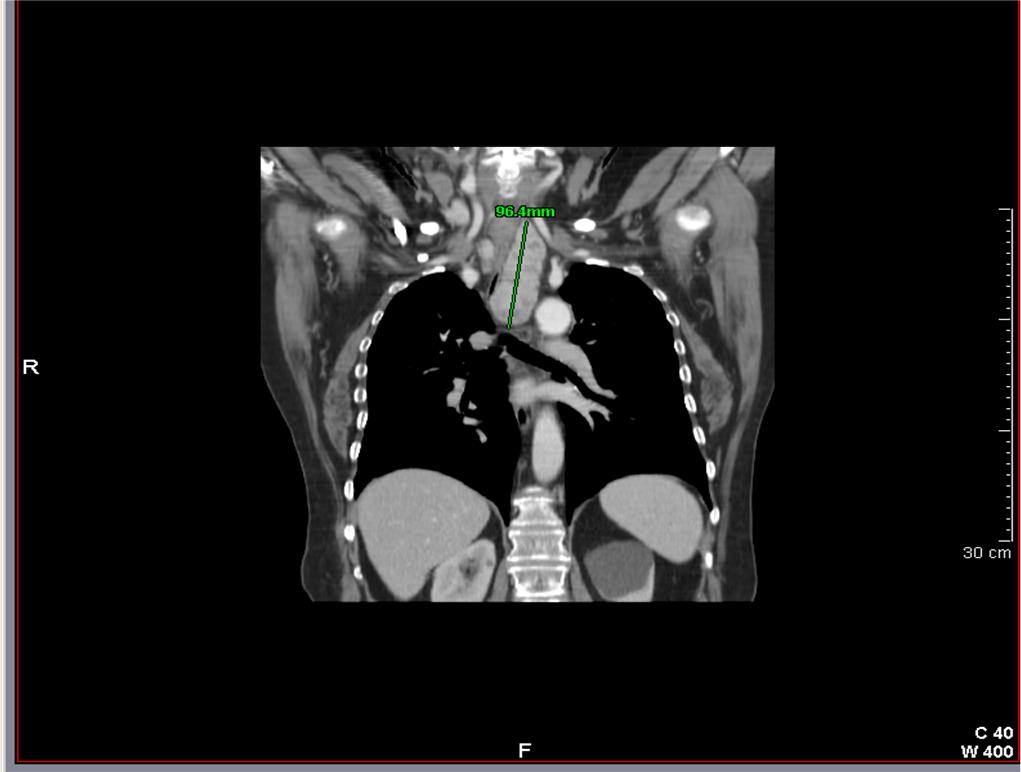
Figura 6. Sezione coronale di un caso di gozzo cervico-mediastinico grado 2 tipo A (prevascolare) monolaterale
I criteri di selezione dei pazienti da candidare alll’intervento chirurgico sono:
- gozzo multinodulare con presenza di sintomi di compressione della via aero-digestiva e/o problemi cosmetici
- gozzo affondato in mediastino
- ipertiroidismo non ulteriormente trattabile con mezzi non chirurgici (farmaci anti-tiroidei, radio-iodio)
Tecnica chirurgica
L'incisione della cute e del platisma, trasversa, leggermente arcuata, viene condotta 3-4 cm sopra il giugulo. I lembi cutanei vengono sollevati dalla fascia cervicale comune, in alto sino alla cartilagine tiroide ed in basso sino al giugulo (figura 7). I muscoli retti anteriori (sternojoideo e sternotiroideo) vengono separati sulla linea mediana e dissecati dal parenchima tiroideo (figura 8). La retrazione laterale selettiva dei muscoli retti è generalmente sufficiente a garantire una buona esposizione. Si ricorre alla loro sezione trasversale in caso di struma particolarmente voluminoso, di sviluppo posteriore di uno o di entrambi i lobi o, in generale, di condizioni anatomiche sfavorevoli.
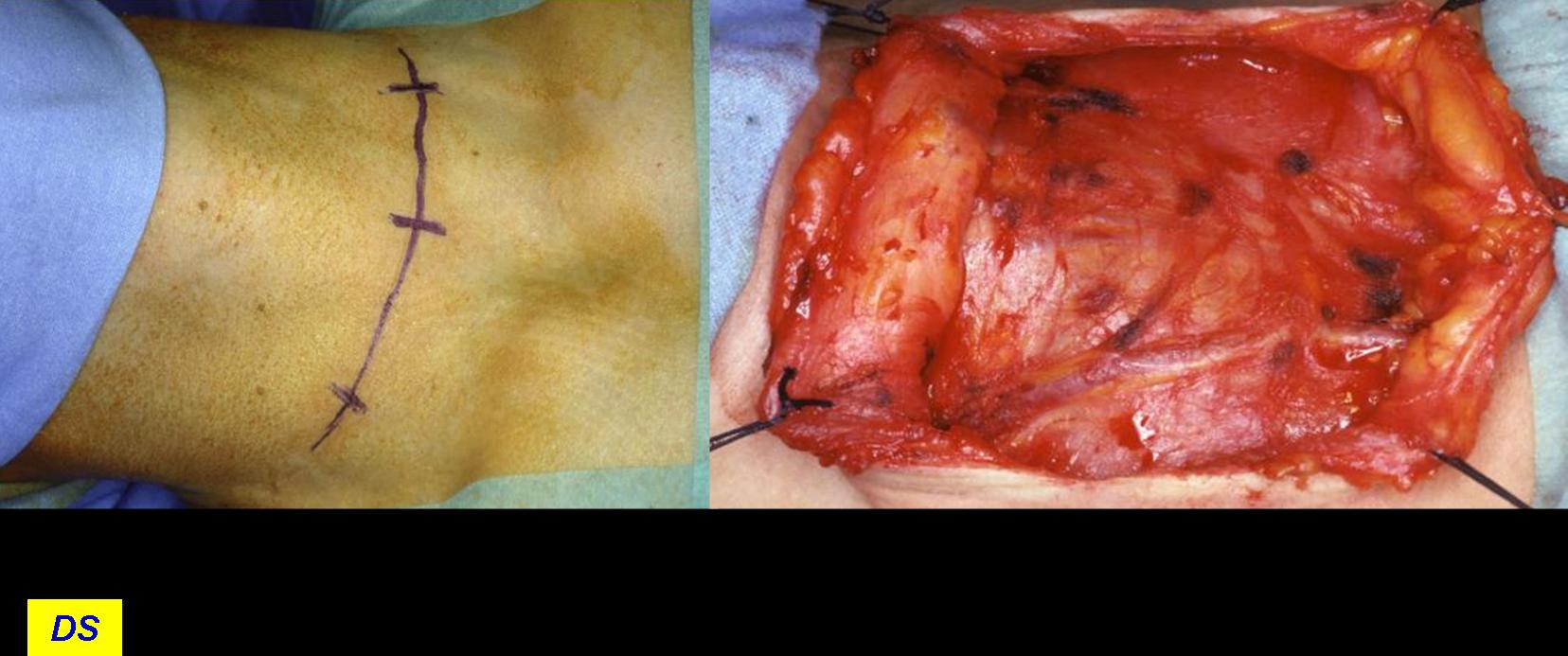
Figura 7. Tecnica chirurgica: incisione e sollevamento dei lembi cutanei
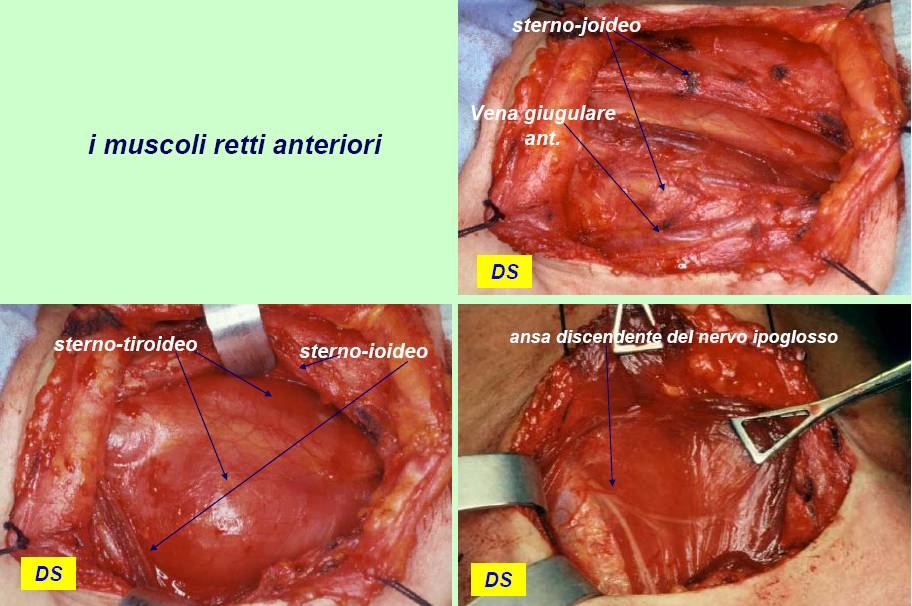
Figura 8. Tecnica chirurgica: dissezione dei muscoli retti anteriori (sterno-joideo e sterno-tiroideo) con evidenza dell’ansa discendente del nervo ipoglosso lateralmente al muscolo sterno-tiroideo.
Il clivaggio nello spazio chirurgico peri-tiroideo, all'interno della fascia peri-tiroidea (figura 9), conduce alla vena tiroidea media (figura 10) e, dopo la sua legatura, è possibile lussare medialmente il lobo e valutare preliminarmente il decorso e i rapporti dell’arteria tiroidea inferiore con l’ilo ghiandolare, il nervo ricorrente e le ghiandole paratiroidi.
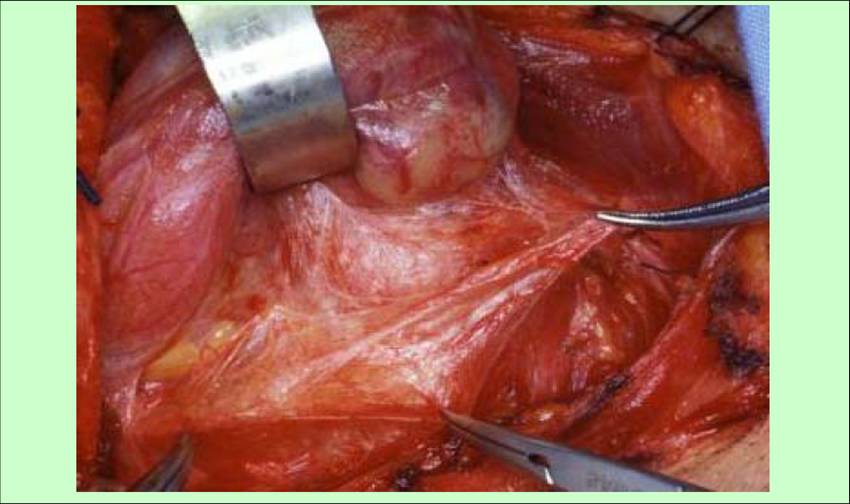
Figura 9. Tecnica chirurgica: dissezione dello spazio cellulare peri-tiroideo
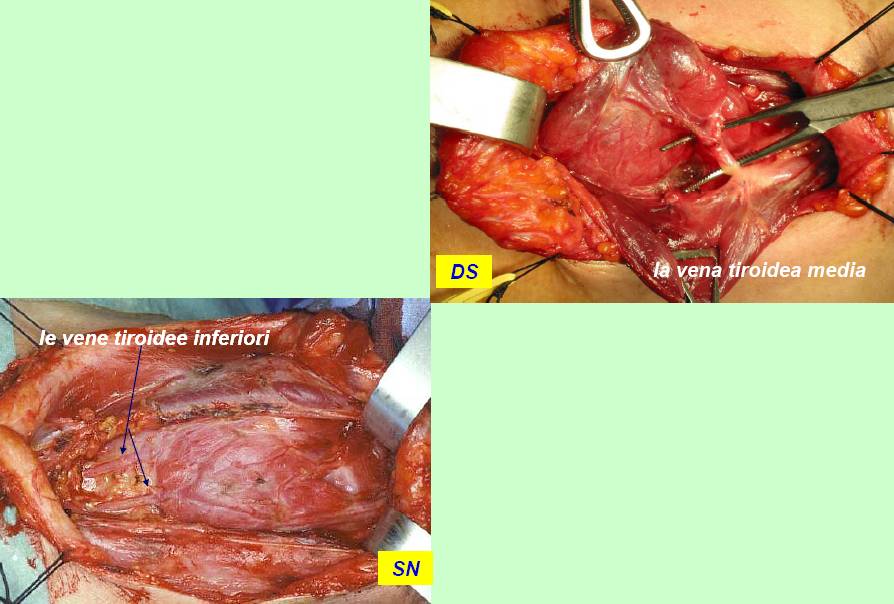
Figura 10. Tecnica chirurgica: identificazione della vena tiroidea media e delle vene tiroidee inferiori
Si procede poi alla divisione del peduncolo vascolare superiore, realizzata legando individualmente i singoli rami arteriosi e venosi del peduncolo a ridosso del polo ghiandolare, per evitare l’allacciatura accidentale del ramo esterno del nervo laringeo superiore (figura 11). In tal modo, la ricerca sistematica di questo nervo può essere superflua.
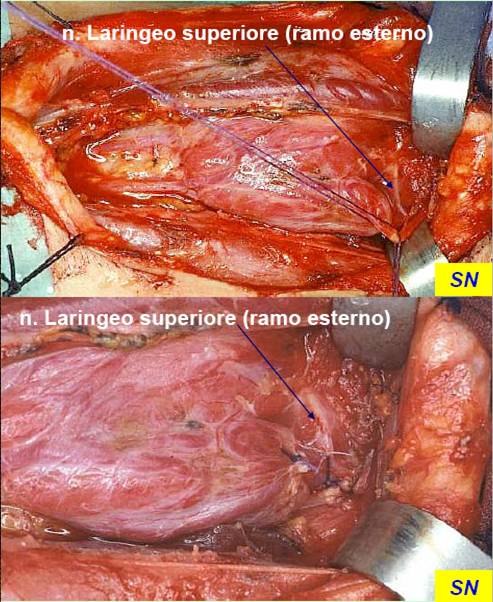
Figura 11. Tecnica chirurgica: legatura del peduncolo vascolare superiore, previa identificazione del ramo esterno del nervo laringeo superiore
Il nervo ricorrente viene generalmente identificato nel triangolo di Loré, delimitato da carotide, trachea e lobo tiroideo, appena sopra lo stretto toracico superiore e seguito per tutto il suo decorso cervicale sino al suo ingresso nella laringe (figura 12). L’arteria tiroidea inferiore, per la sua grande variabilità di rapporti, non rappresenta un punto di repere sempre affidabile per l’identificazione del nervo (figura 13). Il nervo ricorrente viene poi a sua volta utilizzato come repere per l’identificazione delle ghiandole paratiroidi (figura 14).
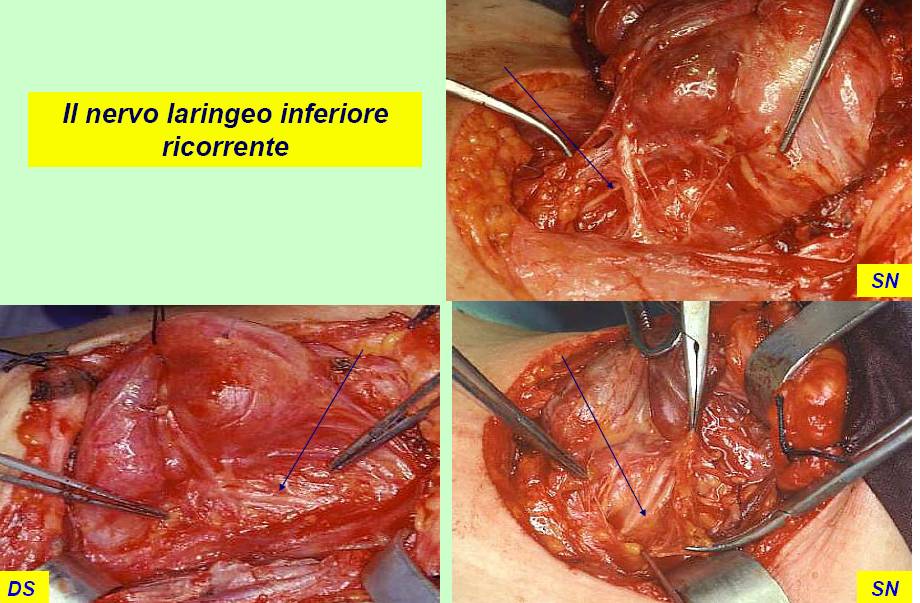
Figura 12. Tecnica chirurgica: identificazione e dissezione del nervo laringeo inferiore (ricorrente) sino al suo ingresso nella laringe
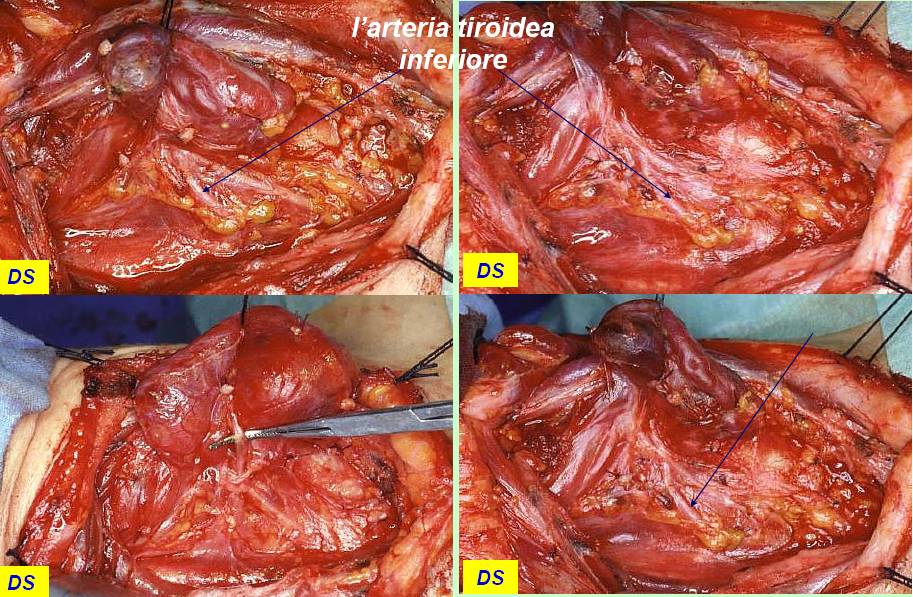
Figura 13. Tecnica chirurgica: rapporti dell’arteria tiroidea inferiore con il nervo laringeo inferiore
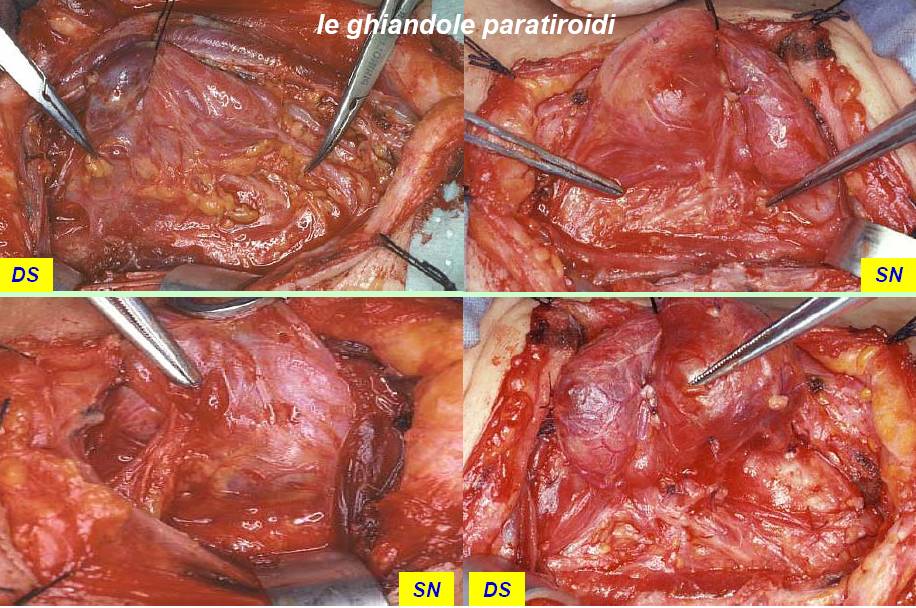
Figura 14. Tecnica chirurgica: rapporti delle ghiandole paratiroidi con il nervo laringeo inferiore.
Nella grande maggioranza dei casi, la paratiroide inferiore si trova in un'area anteriore e quella superiore in un'area posteriore rispetto al nervo. La paratiroide inferiore è generalmente separata dalla capsula tiroidea, talvolta inglobata nel residuo del timo. Per tale motivo non è sempre necessario identificarla, ma solo porre attenzione a non comprenderla nella lobectomia. La paratiroide superiore si trova più frequentemente adagiata sulla capsula tiroidea al confine posteriore del lobo e viene quasi sempre identificata dopo la legatura del peduncolo vascolare superiore. Quando la dissezione delle paratiroidi risulta problematica e la loro vascolarizzazione risulta compromessa o quando si verifica il distacco accidentale completo di una o più paratiroidi, si deve procedere all’espianto e all’immediato reimpianto delle paratiroidi in una tasca del muscolo sterno-cleido-mastoideo, previa sezione accurata del parenchima ghiandolare in piccoli frammenti per renderne più facile l’attecchimento (18) (figura 15).
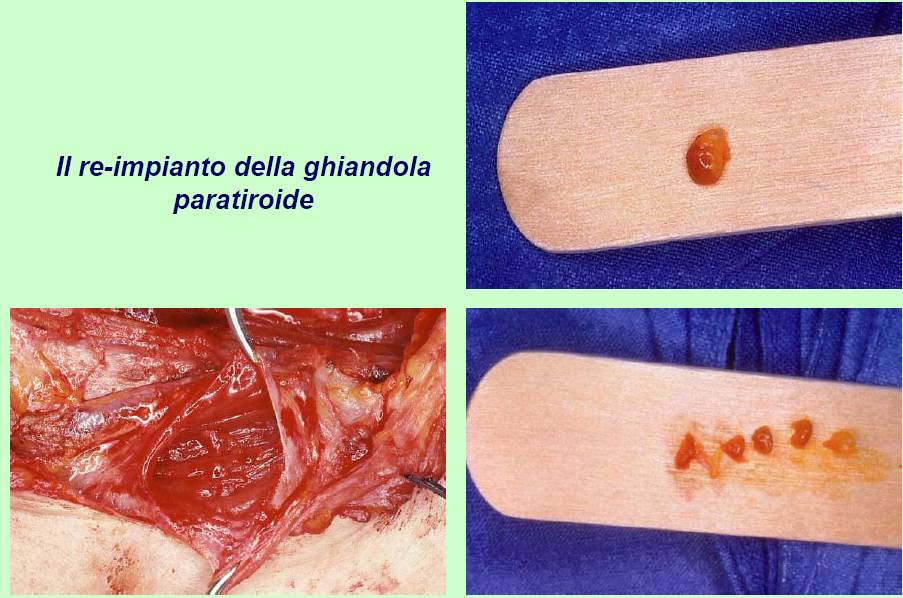
Figura 15. Tecnica chirurgica: reimpianto di frammenti di paratiroide espianta in una tasca del muscolo sterno-cleido-mastoideo
Si procede poi alla legatura e alla divisione delle vene tiroidee inferiori e dei rami terminali dell’arteria tiroidea inferiore a ridosso del parenchima ghiandolare, possibilmente dopo aver separato le paratiroidi con il loro peduncolo vascolare. La sezione del legamento sospensore posteriore di Berry, che rappresenta la ‘zona aderente’ della superficie mediale del lobo con l’asse laringo-tracheale, viene eseguita con il nervo ricorrente sotto costante controllo e rispettando tutti i suoi eventuali rami di divisione (figura 16). In questo tempo, poniamo particolare attenzione all’allacciatura dell’arteria laringea inferiore, che compare medialmente e tende a retrarsi sotto il nervo. Preferiamo eseguire la dissezione del legamento sospensore posteriore di Berry in senso latero-mediale, lussando medialmente il lobo ghiandolare e mantenendo il nervo ricorrente sotto costante controllo diretto. La dissezione del lobo piramidale e la sezione dell’istmo al confine con il lobo controlaterale concludono l’intervento di lobectomia tiroidea. Nella tiroidectomia totale eseguiamo l’intervento controlaterale con la medesima tecnica.
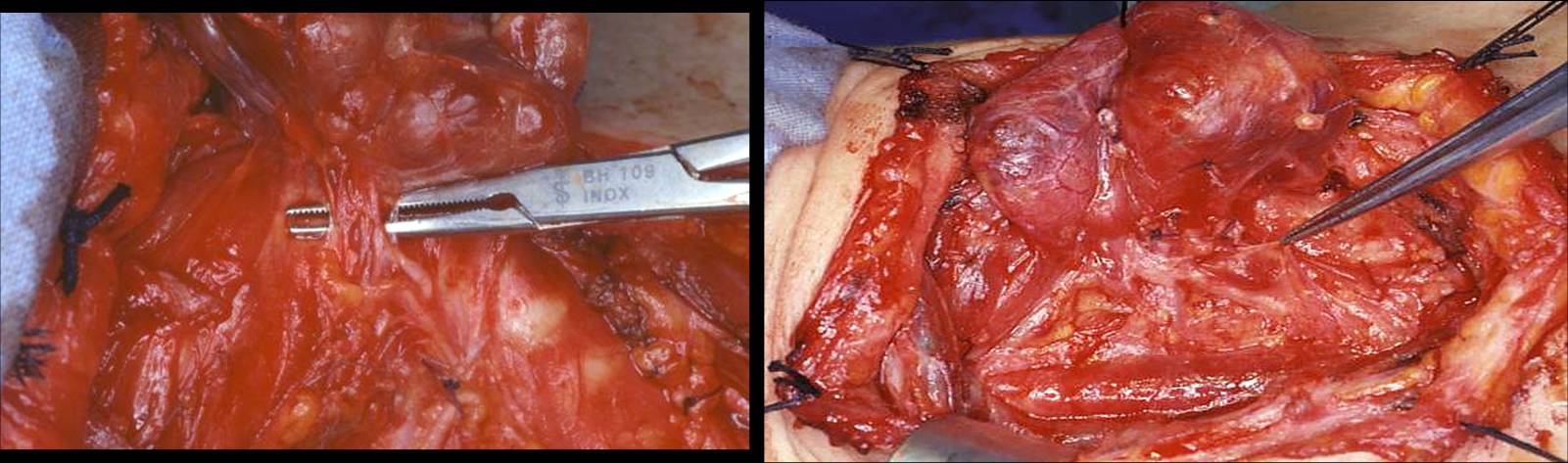
Figura 16. Tecnica chirurgica: sezione del legamento sospensore posteriore di Berry
Per l’asportazione dei gozzi cervico-mediastinici abbiamo generalmente utilizzato la via d’accesso cervicale sopra-sternale. In alcuni casi, tale accesso è stato allargato agevolmente e senza reliquati iatrogeni attraverso la sezione e disarticolazione del terzo mediale della clavicola dal lato più critico (figura 17). Raramente, in casi particolarmente affondati nel mediastino anteriore, siamo dovuti ricorrere alla sternotomia mediana più o meno completa (figura 18).
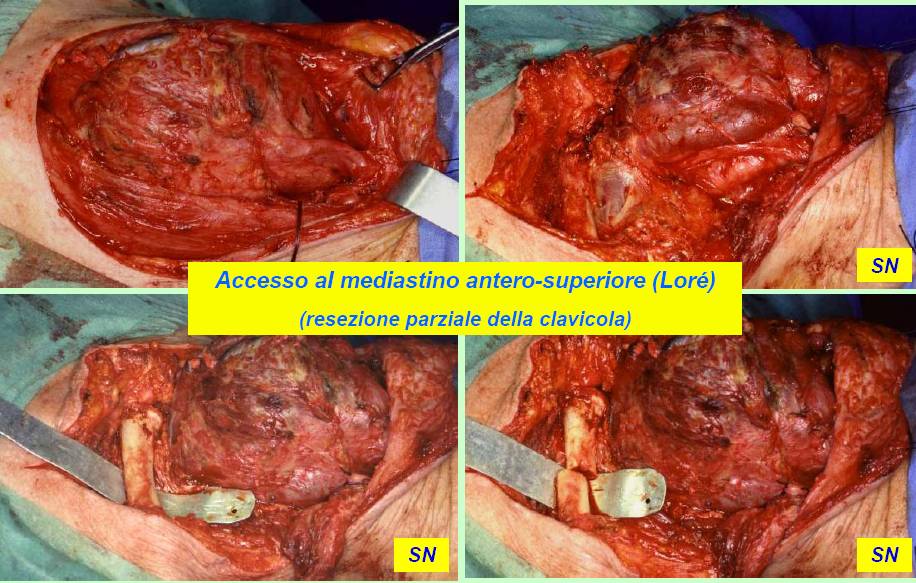
Figura 17. Tecnica chirurgica: accesso al mediastino antero-superiore attraverso sezione e disarticolazione del 1/3 mediale della clavicola
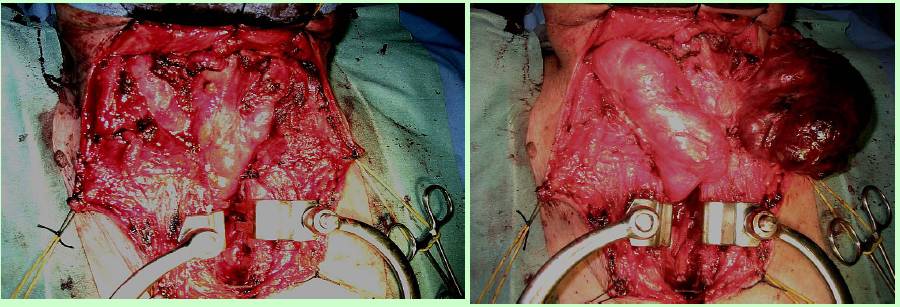
Figura 18. Tecnica chirurgica: accesso al mediastino anteriore attraverso sternotomia mediana
Complicanze
La tecnica chirurgica negli interventi sulla ghiandola tiroide grazie sia a protocolli chirurgici standardizzati, frutto dell’evoluzione di precedenti esperienze, sia all’utilizzo di nuovi strumenti operativi, ed in particolare del microscopio e delle loupes operatorie con ingrandimento, ha raggiunto oggigiorno una sofisticazione tale che le complicanze sono da considerarsi percentualmente molto ridotte rispetto a quelle di qualche decennio addietro. Tenendo ben presenti quelli che sono i principi basilari di questa chirurgia, ossia risoluzione della patologia e salvaguardia delle strutture “nobili” della loggia tiroidea (nervi laringei e ghiandole paratiroidi), è pur vero che il chirurgo spesso si trova di fronte a condizioni anatomiche profondamente sovvertite rispetto alle sue aspettative (sovvertimento dei rapporti topografici tra la ghiandola e le strutture da ricercare ad opera di gozzi voluminosi o per gli esiti di precedenti interventi chirurgici parziali), per cui, oltre ad un adeguato bagaglio tecnico e di esperienza, deve necessariamente conoscere le possibili complicanze dell’atto che sta compiendo e la loro incidenza statistica.
Le complicanze principali sono la paralisi del nervo laringeo ricorrente, transitoria e permanente, e l’ipoparatiroidismo, transitorio e permanente.
La paralisi del nervo laringeo ricorrente può verificarsi per una iatrogenicità peroperatoria o può insorgere dopo l’intervento. Durante l’intervento il nervo laringeo inferiore deve essere sempre identificato per tutto il suo decorso cervicale sino al punto di ingresso nella laringe. Le cause principali che possono ledere il tronco nervoso sono la sezione accidentale, la sua causticazione per mancato riconoscimento, l’eccessiva trazione durante la lussazione della ghiandola e il suo schiacciamento strumentale. L’isolamento del nervo deve essere condotto per via smussa e l’emostasi dei numerosi vasi perinervosi deve essere assicurata, vaso per vaso, con lacci riassorbibili di piccolo calibro, evitando accuratamente l’uso dell’elettro-coagulatore. Anche se si è certi dell’integrità del nervo, il deficit funzionale può manifestarsi lo stesso con paralisi della corda vocale o con una sua ridotta motilità. Tali eventi, generalmente temporanei, possono riconoscere la causa eziologica nello stiramento del nervo o in un indiretto schiacciamento con conseguente edema. Altre rare volte può succedere una paralisi o paresi cordale tardiva, probabilmente da imputarsi ad un piccolo ematoma comprimente il nervo, oppure al decubito di un drenaggio malposizionato; anche queste evenienze sono fortunatamente sempre temporanee.
In letteratura l’incidenza di paralisi ricorrenziale permanente, per interventi di tiroidectomia effettuati su casi non neoplastici, varia dallo 0% al 5.9% (1,6,8,9,13,17,20,21,24). In casi di reintervento, tale incidenza può raggiungere il 20% (19). Nella nostra casistica abbiamo osservato una paralisi ricorrenziale temporanea nell’1.7% dei nervi esposti a rischio e una paralisi ricorrenziale permanente nello 0.6%. Non si è verificato nessun caso di paralisi ricorrenziale bilaterale transitoria o permanente (tabella 1).
| Tabella 1 Prevalenza del deficit del nervo laringeo ricorrente dopo chirurgia tiroidea |
|||
| Autore | N° complessivo di nervi ricorrenti isolati | Deficit (%) | |
| temporaneo | permanente | ||
| Herran–Gonzales (13) | 513 | 2.1 | 2.3 |
| Debry (6) | 835 | 1.9 | 0.3 |
| De Roy (8) | 489 | 3 | |
| Moulton-Barrett (20) | 334 | 2.1 | |
| Osmolsky (21) | 847 | 7.8 | 5.9 |
| Ku (17) | 98 | 2.6 | 0 |
| Duclos (9) | 134 | 2.2 | |
| Vaiman (25) | 7668 | 2.8 | 1.4 |
| Bellantone (1) | 1052 | 1.4 | 0.4 |
| ORL ASMN RE | 3541 | 1.7 | 0.6 |
L'ipoparatiroidismo permanente è una delle complicanze clinicamente più rilevanti della tiroidectomia totale. L’incidenza, in letteratura, varia dallo 0% al 24.2% (1,6,8,9,13,19,20,14,24). E’ sicuramente meno grave l’ipoparatiroidismo temporaneo, la cui incidenza, secondo diverse casistiche, può arrivare tuttavia fino al 45% (14). Nella nostra casistica abbiamo riscontrato un ipoparatiroidismo temporaneo nel 14.8% e permanente nel 4.2% dei pazienti sottoposti a tiroidectomia totale (tabella 2).
| Tabella 2 Prevalenza dell'ipoparatiroidismo dopo tiroidectomia totale |
|||
| Autore | N° complessivo di casi | Ipoparatiroidismo (%) | |
| temporaneo | permanente | ||
| Herran–Gonzales (13) | 185 | 10 | 8 |
| Debry (6) | 247 | 14 | 3.2 |
| De Roy (8) | 341 | 6 | |
| Robert (24) | 94 | 45 | 24.2 |
| Liu (19) | 106 | 8.5 | 0 |
| Moulton-Barrett (20) | 34 | 3.2 | |
| Duclos (9) | 134 | 7.4 | |
| Vaiman (25) | 3834 | 24.2 | 3.5 |
| Bellantone (1) | 526 | 7.8 | 3.4 |
| ORL ASMN RE | 1001 | 14.8 | 4.2 |
Il più delle volte, il danno permanente è secondario alla mancata conservazione dei peduncoli vascolari delle paratiroidi o alla loro asportazione accidentale. Per prevenire questa complicanza, clinicamente caratterizzata da crisi tetaniche particolarmente dolorose e spiacevoli per i pazienti, è fondamentale la ricerca sistematica di tutte e quattro le paratiroidi e l’accurata legatura dei loro peduncoli vascolari in prossimità del parenchima tiroideo per ridurre al minimo il danno ischemico. Anche se alcuni autori (2,11,12,15,19,23) riportano una maggiore incidenza di ipoparatiroidismo e di paralisi ricorrenziale nella tiroidectomia totale rispetto alla tiroidectomia subtotale, negli anni più recenti sono sempre più gli autori (1,6,7,14,16,22,26) che preferiscono la tiroidectomia totale alla subtotale nel trattamento della patologia tiroidea benigna, per il fatto che l’incidenza di complicanze nelle due metodiche ultimamente si equivale mentre la percentuale di recidive di gozzo o di ipertiroidismo dopo tiroidectomia subtotale è mediamente del 15-30%, ma può raggiungere il 60% (19). Di conseguenza, la relativamente alta percentuale di tiroidectomia di completamento, che comporta un alto tasso di complicanze, rappresenta un ulteriore argomento a favore della tiroidectomia totale primaria. Anche l’emostasi viene realizzata meglio nella tiroidectomia totale, dove tutti i vasi sono identificati e legati, che nella tiroidectomia subtotale che lascia un residuo di tessuto tiroideo vascolarizzato.
Vaiman e coll. (24) hanno fatto una revisione della letteratura analizzando più di 3000 articoli e monografie che confrontano gli intervento di tiroidectomia totale, subtotale e quasi totale con particolare attenzione all’incidenza di complicanze. Essi concludono, anche da una revisione della loro casistica, che non vi sono differenze statisticamente significative tra i tre tipi di intervento nell’incidenza di complicanze e che la tiroidectomia totale rappresenta l’intervento più appropriato per il gozzo multinodulare per l’assenza di recidive di malattia.
Conclusioni
A nostro avviso, la tiroidectomia totale rappresenta il trattamento di scelta nel gozzo multinodulare e diffuso e nella malattia di Graves-Basedow perché, non lasciando tessuto tiroideo in sede, non espone al rischio di recidiva di gozzo o di ipertiroidismo e, di conseguenza, al rischio di reintervento che, dopo una tiroidectomia subtotale o quasi-totale, è gravato da un’incidenza di complicanze significativamente più alta della tiroidectomia totale primaria (25). Inoltre, il tasso di complicanze è sostanzialmente uguale a quello delle tiroidectomie subtotale e quasi totale quando è eseguita da chirurghi esperti, con una corretta tecnica operatoria che prevede l’individuazione del nervo ricorrente per tutto il suo decorso cervicale e la conservazione accurata della vascolarizzazione delle paratiroidi.
Come sostiene Flynn (10), “virtually all experienced surgeons should be able to perform total thyroidectomies with less than 1% recurrent nerve injuries, with the long-term risk of hypoparathyroidism of 2% to 9%.”.
Bibliografia
- Bellantone R, et al. Total Thyroidectomy for Management of Benign Thyroid Disease: Review of 526 Cases. World J Surg 2002, 26, 1468-71.
- Berchtold R, Studer H, Teuscher J. Modern surgery for goiter. Chirurg 1983, 109: 187–99.
- Cady B. Invited commentary. World J Surg 1986, 10: 786-7.
- Catz B, Perzik SL. Total thyroidectomy in the management of thyrotoxic and euthyroid Grave's disease. Am Surg 1969, 118, 434-9.
- Colak T, Akca T, Kanik A, et al. Total versus subtotal thyroidectomy for the management of benign multinodular goiter in an endemic region. Aust N Z J Surg 2004, 74: 974–8.
- Debry C, Schmitt E, Senechal G, e al. Analyse des complications de la chirurgie thyroidienne: paralysie recurrentielle et hypoparathyroidie. Ann Otolaryngol Chir Cervicofac 1995, 112: 211-7.
- Dener C. Complication rates after operations for benign thyroid disease. Acta Otolaryngol 2002, 122: 679–83.
- de Roy van Zuidewijn DB, Songun I, Kievit J, van de Velde CJ. Complications of thyroid surgery. Ann Surg Oncol 1995, 2: 56-60.
- Duclos JY, Rebufy M. Thyroid surgery: risks and complications. Apropos of 134 cases. Rev Laryngol Otol Rhinol 1995, 116: 199-207.
- Flynn MB, Lyons KJ, Tarter JW, Ragsdale TL. Local Complication after surgical resection for thyroid diseases. Am J Surg 1994, 168: 404-7.
- Foster Jr RS. Morbidity and mortality after thyroidectomy. Surg Gynecol Obstet 1978, 146: 413–29.
- Harness JK, Fung L, Thompson NW, et al. Total thyroidectomy: complications and technique. World J Surg 1986, 10: 781-6.
- Herranz-Gonzalez J, Gavilan J, Martinez-Vidal J. Complications following thyroid surgery.Arch Otolaryngol Head Neck Surg 1991, 117: 516-8.
- Robert J, Mariethoz S, Pache JC, et al. Short- and long-term results of total vs subtotal thyroidectomies in the surgical treatment of Graves’ disease. Swiss Surg 2001, 7: 20–4.
- Khadra M, Delbridge L, Reeve TS, et al. Total thyroidectomy: its role in management of thyroid disease. Aust NZ J Surg 1992, 62: 91-5.
- Koyuncu A, Dokmetas HS, Turan M, et al. Comparison of different thyroidectomy techniques for benign thyroid disease. Endocrine J 2003, 50: 723–7.
- Ku CF, Lo CY, Chan WF, et al. Total thyroidectomy replaces subtotal thyroidectomy as the preferred surgical treatment for Graves’ disease. Aust N Z J Surg 2005, 75: 528–31.
- Lennquist S. Thyroidectomy. In Clark OH, Duh QY, editors, Textbook of Endocrine Surgery, 1st edition, Philadelphia, Saunders, 1997: 151.
- Liu Q, Djuricin G, Prinz RA. Total thyroidectomy for benign thyroid disease. Surgery 1998, 123: 2–7.
- Moulton-Barret R, Crumley R, Jalilie S. Complications of thyroid surgery. Int Surg 1997, 82: 63-6.
- Osmolski A, Frenkiel Z, Osmolski R. Complications in surgical treatment of thyroid diseases. Otolaryngol Pol 2006, 60: 165-71.
- Ozbas S, Kocak S, Aydintug S, et al. Comparison of the complications of subtotal, near total and total thyroidectomy in the surgical management of multinodular goitre. Endocrine J 2005, 52: 199–205.
- Reeve TS, Delbridge L, Cohen A, et al. Total thyroidectomy: the preferred option for multinodular goiter. Ann Surg 1987, 206: 782-6.
- Vaiman M, Nagibin A, Hagag P, et al. Subtotal and Near Total Versus Total Thyroidectomy for the Management of Multinodular Goiter. World J Surg 2008, 32: 1546–51.
- Wheeler MH. Total thyroidectomy for benign thyroid disease. Lancet 1998, 35: 1526-7.
- Winsa B, Rastad J, Akerstrom G, et al. Retrospective evaluation of subtotal and total thyroidectomy in Graves' disease with and without endocrine ophthalmopathy. Eur J Endocrinol 1995, 132: 406-12.
Terapia citoriduttiva medico-nucleare del gozzo nodulare normofunzionante
Marco Chianelli
UOC Endocrinologia, Ospedale Regina Apostolorum, Albano Laziale, Roma
Il gozzo multinodulare normofunzionante è una condizione frequente dell’età avanzata, che può determinare segni e sintomi compressivi cervicali con vario grado di disfagia e/o dispnea, anche severi. La terapia di elezione in questa patologia è la tiroidectomia, che consente la risoluzione immediata della compressione, in modo definitivo, e anche la diagnosi di eventuali focolai di carcinoma tiroideo. A causa delle dimensioni aumentate e del prolungato tempo operatorio, tuttavia, l’intervento può essere gravato da una maggiore frequenza di complicanze locali. I pazienti portatori di questa patologia, inoltre, sono frequentemente affetti da comorbilità, che sconsigliano o controindicano l’intervento chirurgico.
Una possibile alternativa è la terapia medico-nucleare, basata sull’uso dello iodio-131 (131I). La terapia citoriduttiva medico-nucleare è molto ben tollerata, non determina effetti sistemici. È semplice ed economica e può essere effettuata in regime ambulatoriale, compatibilmente con i limiti imposti dalla normativa radioprotezionistica. Può essere ripetuta se necessario. Evita i possibili effetti collaterali della terapia chirurgica (1,2).
MODALITÀ STANDARD
Note metodologiche
Per questa indicazione lo 131I viene utilizzato a bassa attività/grammo di tessuto tiroideo (dose assorbita di radiazioni: 100 Gy), allo scopo di ridurre la possibilità di effetti collaterali locali, particolarmente importante in questo gruppo di pazienti in cui esistono già effetti compressivi (3).
Secondo la normativa vigente in Italia, la terapia può essere effettuata in regime ambulatoriale se l'attività da somministrare non supera i 600 MBq (16.2 mCi) (4).
I pazienti non necessitano di preparazione, tranne una dieta povera di iodio nei 10 giorni precedenti la terapia e l'evitare l'assunzione di farmaci contenenti iodio e mezzi di contrasto organo-iodato per un tempo idoneo, variabile in base al composto (vedi tutto sul radioiodio).
Risultati attesi
Nei pazienti con gozzo di medie dimensioni (fino a 100 cc), la terapia citoriduttiva con radioiodio determina una riduzione di volume della tiroide pari a circa il 25% dopo 3-6 mesi, per raggiungere il 50% dopo un anno e arrivare fino al 60% dopo 3-5 anni. Una seconda dose di 131I, se necessaria, determina un effetto aggiuntivo. Per gozzi di elevate dimensioni (> 100 cc), l’effetto citoriduttivo atteso è minore (circa 30-40% a un anno) e si riduce all’aumentare delle dimensioni iniziali. Nel gozzo semplice l’effetto citoriduttivo è maggiore rispetto a quello osservato nel gozzo nodulare. In oltre il 75% dei pazienti si ottiene un significativo miglioramento dei sintomi compressivi e della funzionalità respiratoria (5).
Effetti indesiderati
Raramente il paziente lamenta nausea, ma nei pazienti a rischio è indicata l’assunzione di gastro-protettori (ranitidina 150 1 cp x 2/die per una settimana, iniziando il giorno precedente la terapia con 131I).
Si può verificare ipertiroidismo transitorio da tiroidite attinica (nel 3-5% dei casi), a causa della immissione in circolo degli ormoni tiroidei preformati in seguito al danno cellulare; più raramente ipertiroidismo autoimmune (5%) di lunga durata.
Non è descritto in letteratura un significativo aumento del volume tiroideo conseguente alla terapia con 131I, molto temuto in questi pazienti: uno studio del 1995 ha riportato a 7 giorni dalla terapia un aumento di volume massimo pari al 4% (3,6).
Raramente può insorgere lieve dolenzia cervicale, tipicamente qualche giorno dopo il trattamento, responsiva ai comuni farmaci anti-infiammatori.
L'ipotiroidismo può insorgere dopo circa un anno nel 20% dei pazienti ed entro 6-8 anni nel 30-40% dei pazienti trattati (7).
Monitoraggio dopo la terapia
I pazienti dovranno essere monitorati per la verifica del successo terapeutico e per l’insorgenza di possibili effetti collaterali.
Nelle prime settimane dovrà essere monitorata la comparsa di effetti collaterali precoci (dolore ed ipertiroidismo).
Si consiglia una frequente valutazione dello stato funzionale tiroideo nei primi mesi (30 giorni dopo il trattamento e poi ogni 2-3 mesi in base ai risultati) e una volta all’anno dopo i primi 12 mesi, anche nei pazienti eutiroidei. Il monitoraggio della funzione tiroidea, almeno una volta l’anno, deve continuare indefinitamente per la possibile comparsa di ipotiroidismo anche molti anni dopo la terapia (8).
E’ opportuno eseguire una TC del collo di controllo dopo 6-12 mesi, per verificare l’effetto citoriduttivo e la decompressione locale, valutando il diametro traverso della trachea, ed eventualmente pianificare un successivo trattamento, consigliabile nel caso in cui non si verifichino riduzione clinicamente significativa del volume dopo 6 mesi.
Controindicazioni
Le uniche controindicazioni alla terapia con 131I sono la gravidanza e l’allattamento.
La presenza di noduli sospetti per malignità è una precisa indicazione alla tiroidectomia totale.
Limiti della terapia citoriduttiva medico-nucleare
Al momento della dimissione i pazienti avranno una residua attività circolante di 131I e dovranno seguire scrupolosamente istruzioni radioprotezionistiche per limitare l’esposizione a radiazioni ionizzanti al pubblico e ai familiari; ciò può comportare limitazioni dell'attività sociale e/o lavorativa. La terapia medico-nucleare non può essere eseguita in pazienti non in grado di seguire tali raccomandazioni (vedi tutto sul radioiodio).
Poichè gli effetti della terapia medico nucleare si ottengono dopo vari mesi, la terapia con 131I non è consigliabile nei pazienti con gravi effetti compressivi, in cui sia indicato un effetto decompressivo rapido.
L’efficacia di questo tipo di terapia, infine, è limitata dalla captazione del radioiodio: solo le aree tiroidee captanti subiscono gli effetti dell’irraggiamento; l’efficacia, pertanto, sarà minore nei gozzi disomogenei, con estese aree non captanti, e limitata alle sole aree captanti.
CON UTILIZZO DI rhTSH
Per superare i limiti della terapia citoriduttiva con 131I, è stato recentemente proposto l’impiego del rhTSH perchè la somministrazione del rhTSH aumenta la captazione del 131I, anche nelle aree scarsamente captanti.
A tutt’oggi l’uso del rhTSH per questa indicazione è off label e deve essere impiegato in studi sperimentali dopo autorizzazione del comitato etico, o nel singolo paziente, dopo consenso informato sotto la responsabilità del medico che effettua la somministrazione.
Vantaggi
L’impiego del rhTSH, consente il trattamento medico-nucleare in regime ambulatoriale anche di pazienti che, a causa della scarsa captazione avrebbero necessitato di ricovero protetto per le elevate dosi necessarie. Esempio: se un paziente ha una bassa captazione del 131I a 24 ore (20%) e la sua tiroide pesa 60 g, per ottenere una concentrazione di 131I pari a 100 µCi/g è necessario somministrare 30 mCi di 131I (il 20% di 30 mCi è pari a 6 mCi, dose captata dalla tiroide, che, per 60 g di tiroide corrispondono a 100 µCi/g). Per somministrare 30 mCi di 131I è necessario il ricovero ospedaliero in ambiente protetto. Se il paziente viene pre-trattato con rhTSH, si ottiene un aumento della captazione del 131I di circa il 100%; dopo stimolo, pertanto, la captazione del 131I sarà di circa il 40%; per ottenere la stessa concentrazione intra-tiroidea del radioiodio, pertanto, sarà possibile somministrare al paziente solo 15 mCi, compatibili con il trattamento ambulatoriale. La riduzione dell'attività somministrata, infine, determina una netta riduzione dell'esposizione alle radiazioni ionizzanti, con riduzione del rischio e semplificazione delle norme radioprotezionistiche.
La riduzione di volume complessiva ottenuta dopo somministrazione di rhTSH, inoltre, è maggiore, in quanto rispondono al trattamento anche i noduli che, di base, sono scarsamente captanti. L’uso del rhTSH determina una riduzione di volume dal 35 al 56% maggiore rispetto all’uso del 131I senza stimolo con rhTSH. (3,9,10). In contrasto con quanto avviene con il solo 131I, l’effetto citoriduttivo dopo rhTSH aumenta all’aumentare delle dimensioni del gozzo.
Effetti collaterali
L’effetto collaterale più temuto è il transitorio aumento di volume tiroideo, che si può verificare 24-48 ore dopo la somministrazione di rhTSH in circa il 20% dei pazienti. Tale effetto è dose-dipendente: pari al 35% per 0.9 mg rhTSH, 24% per 0.3 mg rhTSH, e 10% for 0.1 mg rhTSH (9,11).
L'aumento di volume, dovuto a edema tiroideo, è sensibile alla somministrazione di cortisone, che può essere somministrato preventivamente nei pazienti a maggior rischio (betametasone 4 mg per via e.v. prima della terapia, da ripetere 24 e 48 ore dopo).
Un altro effetto che si verifica frequentemente è un transitorio ipertiroidismo, conseguente alla stimolazione della produzione di ormoni tiroidei indotta dal rhTSH. Inizia 4-8 ore dopo la somministrazione, raggiunge il massimo 24-48 ore dopo, per normalizzarsi entro 3 settimane. Dosi di rhTSH pari a 0.1 mg determinano un aumento della produzione di ormoni tiroidei contenuta entro i limiti della norma nella maggior parte dei pazienti (12), in assenza di significativi effetti cardiovascolari (13).
Note metodologiche
Nonostante non esista un protocollo riconosciuto e condiviso, sono stati ottenuti numerosi dati. Una dose di rhTSH tra 0.1 e 0.03 mg aumenta la captazione di circa il 100%; l’impiego di 0.1 mg sembra dare risultati maggiormente riproducibili. Dosi superiori, fino a 0.3 mg, sono state impiegate ma con scarso incremento della captazione tiroidea del 131I, a scapito di un significativo aumento degli effetti collaterali (14).
Il rhTSH somministrato 24-48 ore prima della dose terapeutica di 131I consente il massimo aumento della captazione. Il protocollo attualmente più consigliabile si basa sulla somministrazione di 0.1 mg di rhTSH seguito, 24 ore dopo, dalla somministrazione di una dose diagnostica di 131I per scintigrafia e captazione e, 48 ore dopo, dalla somministrazione di una dose terapeutica di 131I, tipicamente calcolata per ottenere una concentrazione di 100-120 µCi/g di tessuto tiroideo.
BIBLIOGRAFIA
- AACE/AME/ETA Thyroid Nodule Guidelines. Endocr Pract 2010, 16 (Suppl 1): 1-43.
- Royal College of Physicians. Radioiodine in the management of benign thyroid disease: clinical guidelines. Report of a Working Party. London: RCP, 2007.
- Bonnema SJ, Bertelsen H, Mortensen J, et al. The feasibility of high dose iodine 131 treatment as an alternative to surgery in patients with a very large goiter: effect on thyroid function and size and pulmonary function. J Clin Endocrinol Metab 1999, 84: 3636–41.
- Raccomandazioni procedurali per la terapia medico nucleare. AIMN 2012.
- Nygaard B, Hegedus L, Gervil M, et al. Radioiodine treatment of multinodular non-toxic goitre. BMJ 1993, 307: 828–32.
- Nygaard B, Faber J, Hegedus L. Acute changes in thyroid volume and function following 131I therapy of multinodular goitre. Clin Endocrinol (Oxf) 1994, 41: 715–8.
- Bonnema SJ, Nielsen VW, Hegedus L. Long-term effects of radioiodine on thyroid function, size and patient satisfaction in non-toxic diffuse goitre. Eur J Endocrinol 2004 150: 439–45.
- Association for Clinical Biochemistry, British Thyroid Foundation and British Thyroid Association. UK guidelines for thyroid function tests.
- Nielsen VE, Bonnema SJ, Boel-Jorgensen H, et al. Stimulation with 0.3-mg recombinant human thyrotropin prior to iodine 131 therapy to improve the size reduction of benign nontoxic nodular goiter: a prospective randomized double-blind trial. Arch Intern Med 2006, 166: 1476-82.
- Silva MN, Rubio IG, Romao R, et al. Administration of a single dose of recombinant human thyrotrophin enhances the efficacy of radioiodine treatment of large compressive multinodular goitres. Clin Endocrinol (Oxf) 2004, 60: 300-8.
- Nielsen VE, Bonnema SJ, Hegedus L. The effects of recombinant human thyrotropin, in normal subjects and patients with goitre. Clin Endocrinol (Oxf) 2004, 61: 655-63.
- Nieuwlaat WA, Huysmans DA, van den Bosch HC, et al. Pretreatment with a single, low dose of recombinant human thyrotropin allows dose reduction of radioiodine therapy in patients with nodular goiter. J Clin Endocrinol Metab 2003, 88: 3121-9.
- Barca MF, Gruppi C, Oliveira MT, et al. Cardiovascular assessment of hyperthyroid patients with multinodular goiter before and after radioiodine treatment preceded by stimulation with recombinant human TSH. Endocrine 2007, 32: 175-81.
- Fast S, Nielsen VE, Bonnema SJ, et al. Time to reconsider nonsurgical therapy of benign non-toxic multinodular goitre: focus on recombinant human TSH augmented radioiodine therapy. Eur J Endocrinol 2009, 160: 517-28.
Patologia nodulare della tiroide
Overview sulla formazione dei noduli
Overview su clinica e approccio diagnostico
Linee guida per la gestione clinica del nodulo tiroideo
Terapia chirurgica:
Overview sulla formazione dei noduli tiroidei
Carlo Cappelli
Unità di Endocrinologia, Dipartimento di Medicina Interna, Spedali Civili di Brescia
Gozzo multinodulare
Il TSH è il principale, anche se non unico, fattore che regola la proliferazione e funzione delle cellule tiroidee. Nei paesi iodio-carenti il deficit di iodio rappresenta la principale causa predisponente allo sviluppo di gozzo multinodulare. Il meccanismo principale attraverso il quale la carenza iodica porta alla formazione del gozzo è legato ad una iniziale riduzione della sintesi degli ormoni tiroidei che causano una maggiore increzione di TSH. Il cronico stimolo tireotropinico indurrà ipertrofia e iperplasia dei follicoli.
Un complesso network di vie TSH-dipendenti ma anche indipendenti dirette sulla crescita e funzione delle cellule follicolari tiroidee svolge un ruolo nel processo di goitrogenesi, qualunque sia la causa della diminuita concentrazione di iodio intra-ghiandolare. In particolare, numerosi fattori di crescita, derivanti sia dal circolo sanguigno sia da secrezioni autocrine e paracrine, regolano la proliferazione e differenziazione delle cellule tiroidee (1). A questo proposito è stata dimostrata la presenza sulle cellule follicolari di recettori per fattori stimolanti la crescita, come l’epidermal growth factor (EGF), l’insulin-like growth factor (IGF-1 e IGF-2), o di fattori inibenti quale il transforming growth factor ß (TGF ß) (1). Mutazioni somatiche monoclonali di cellule ad elevata capacità di metabolizzare lo iodio daranno origine a formazioni funzionanti (noduli “caldi”), mentre l’espansione di cloni a bassa o nulla capacità daranno origine a noduli non funzionanti (noduli “freddi”) (2).
Mutazioni genetiche del recettore per TSH
Mutazioni somatiche per il recettore del TSH (TSH-R) si riscontrano nel 30-80% dei pazienti affetti da adenoma autonomo (M. di Plummer):
- mutazioni attivanti il gene del TSH-R causano una sua attivazione costitutiva con proliferazione clonale
- mutazioni del gene Gs-alfa causano una attivazione costitutiva dell’adenilato-ciclasi con conseguente proliferazione clonale.
Adenomi follicolari
Mutazioni puntiformi dei proto-oncogeni H-ras, K-ras e N-ras sono stati identificati sia negli adenomi che carcinomi follicolari (3-7).
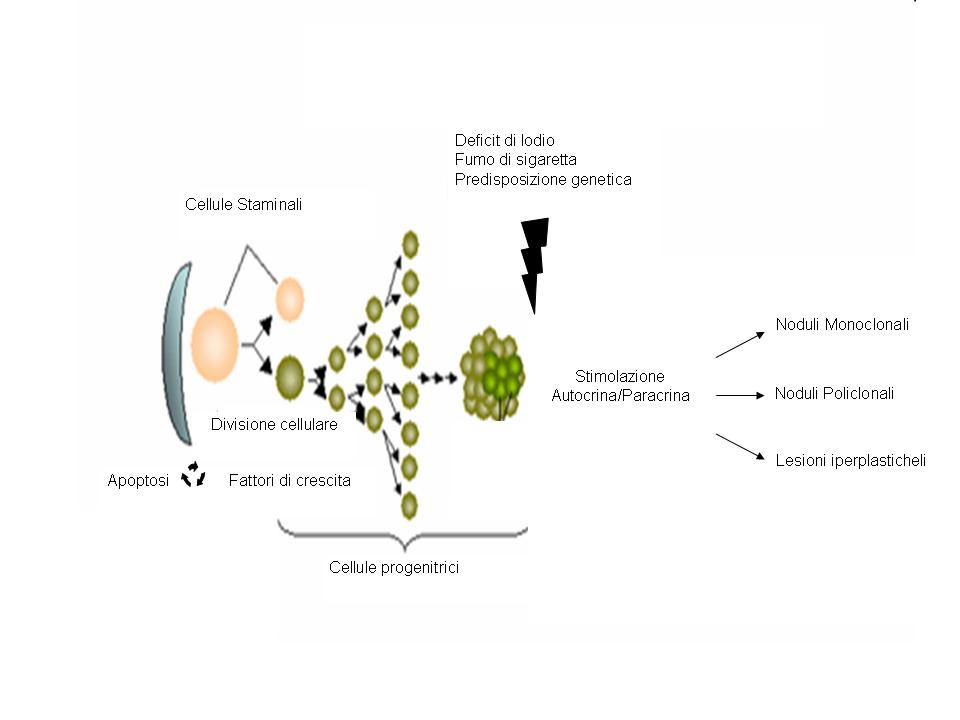
La teoria del gozzo nodulare come patologia delle cellule staminali
Cellule staminali totipotenti sono state recentemente individuate nel tessuto tiroideo, indipendentemente dall’età del soggetto (8).
In vitro si è evidenziato come la loro potenziale proliferazione e sdifferenzazione sia sotto stretto controllo ed in equilibrio tra processi di apoptosi e fattori di crescita. L’aumento dei processi apoptotici o l’eccessivo stimolo proliferativo può alterare la fine regolazione di questo equilibrio, così da indurre proliferazione delle cellule staminali e trasformazione in cellule progenitrici differenziate, base per lo sviluppo di formazioni nodulari (9).
Bibliografia
- Krohn K, Fuhrer D, Bayer Y, et al. Molecular pathogenesis of euthyroid and toxic multinodular goiter. Endocr Rev 2005, 26: 504-24.
- Ramelli F, Studer H, Bruggisser D. Pathogenesis of thyroid nodules in multinodular goiter. Am J Pathol 1982, 109: 215.
- Lemoine NR, Mayalla ES, Wyllie FS, et al. High frequency of ras oncogene activation in all stages of human thyroid tumorigenesis. Oncogene 1989, 4: 159.
- Namba H, Rubin SA, Fagin JA. Point mutations of ras oncogenes are an early event in thyroid tumorigenesis. Mol Endocrinol 1990, 4: 1474.
- Suarez HG, du Villard JA, Severino M, et al. Presence of mutations in all three ras genes in human thyroid tumors. Oncogene 1990, 5: 565.
- Boss JL. Ras oncogenes in human cancer: a review. Cancer Res 1989, 49: 4682.
- Karga H, Lee JK, Vickery AL Jr, et al. Ras oncogene mutations in benign and malignant thyroid neoplasms. J Clin Endocrinol Metab 1991, 73: 832.
- Moore KA, Lemischka IR. Stem cells and their niches. Science 2006, 311: 1880-5.
- Frisch SM, Francis H. Disruption of epithelial cell-matrix interactions induces apoptosis. J Cell Biol 1994, 124: 619-26.
Overview su clinica e approccio diagnostico del nodulo tiroideo
Carlo Cappelli
Unità di Endocrinologia, Dipartimento di Medicina Interna, Spedali Civili di Brescia
Il riscontro di noduli tiroidei è piuttosto frequente nella pratica clinica, soprattutto in aree con deficit di iodio di grado lieve-moderato come l’Italia (1).
La presenza di uno o più noduli all’interno della ghiandola tiroide viene solitamente rivelata da:
- evidenza alla palpazione e/o all’ispezione di tumefazione nella regione anteriore del collo;
- riscontro nel corso di ecografia tiroidea eseguita come approfondimento diagnostico in un paziente affetto da ipotiroidismo o ipertiroidismo;
- riscontro occasionale nel corso di indagini eseguite per patologie non tiroidee (es. doppler TSA, ecografia del collo per linfoadenopatia latero-cervicale, Rx prime vie digestive con pasto baritato, ecc.).
La clinica dipenderà dalle dimensioni del nodulo e se lo stesso è causa di distiroidismo.
Un nodulo tiroideo di piccole dimensioni generalmente è asintomatico.
Uno o più noduli voluminosi possono causare dispnea e/o disfagia, tosse stizzosa e /o disfonia (figura).
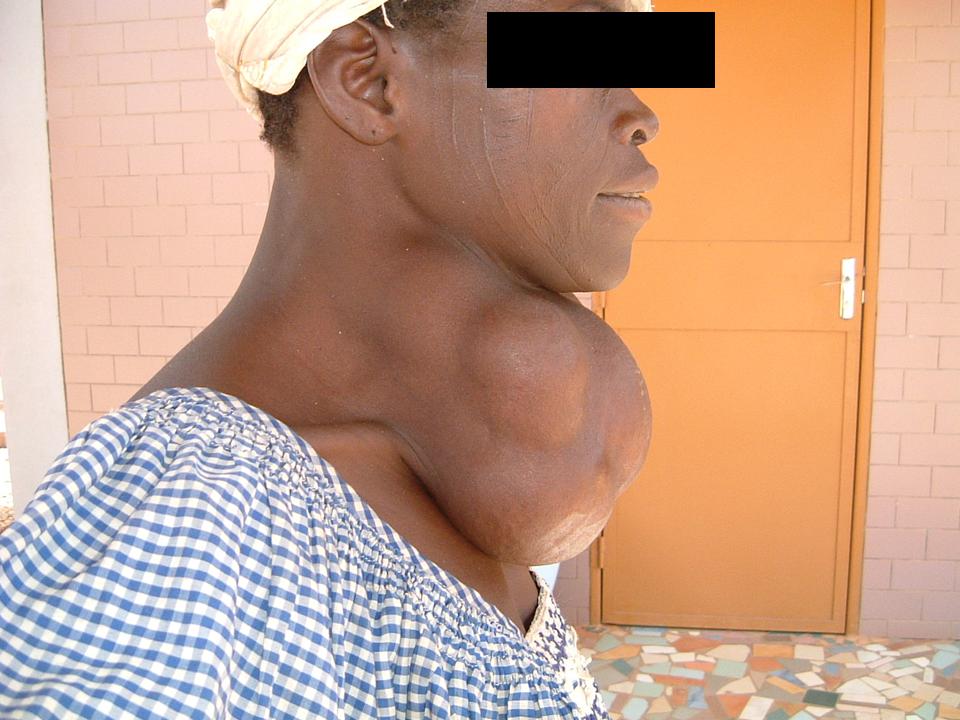
Se il nodulo è iperfunzionante, il paziente avverte i sintomi classici dell'ipertiroidismo: nervosismo, tremori, iperidrosi, intolleranza al caldo, astenia, perdita di peso, aumento dell'appetito, tachicardia, ecc (2,3).
Bibliografia
- Cappelli C, Castellano M, Pirola I, et al. Reduced thyroid volume and nodularity in dyslipidaemic patients on statin treatment. Clin Endocrinol 2008, 68: 16-21.
- Hegedus L. The thyroid nodule. N Engl J Med 2004, 351: 1764-71.
- Gharib H, Papini E, Paschke R, et al. American Association of Clinical Endocrinologists, Associazione Medici Endocrinologi, and European Thyroid Association medical guidelines for clinical practice for the diagnosis and management of thyroid nodules. J Endocrinol Invest, 2010, 33: 1-50.
Scopo del percorso diagnostico è quello di identificare i noduli di interesse chirurgico (1). Il rilievo clinico e/o strumentale di un nodulo tiroideo dovrebbe essere seguito da un'accurata anamnesi e da un esame obiettivo completo.
NOTIZIE ANAMNESTICHE
Il sospetto di patologia neoplastica deve essere tenuto in considerazione nel caso di:
- esposizione a radiazioni ionizzanti (a scopo terapeutico o incidentale) a livello della testa e del collo durante l’infanzia e/o l’adolescenza, poiché rappresenta l’unico fattore eziologico ambientale certo predisponente allo sviluppo di neoplasia tiroidea maligna (2-6)
- storia familiare di carcinoma tiroideo o di cancro tiroideo sindromico (p.e. sindrome di Cowden, poliposi familiare, complesso di Carney, neoplasie endocrine multiple [MEN] tipo 2, sindrome di Werner) in un familiare di primo grado (7)
- qualora il nodulo venga riscontrato in soggetti di sesso maschile, in particolar modo di età > 60 anni e/o < 20 anni, o nel caso in cui il nodulo abbia una crescita rapida e/o si associ a sintomi da compressione quali dispnea, disfagia, tosse stizzosa, disfonia (5,7,8)
- riscontro di un nodulo tiroideo in età pediatrica ed adolescenziale, indipendentemente dal sesso (9).
ESAME OBIETTIVO
La palpazione del collo permette di accertare il carattere unico o multiplo, la localizzazione, le dimensioni, la fissità, la dolorabilità dei noduli tiroidei e, infine, l’eventuale coesistenza di linfoadenopatia satellite.
La tendenza al progressivo accrescimento, la consistenza duro-lignea, l’irregolarità della superficie del nodulo, la fissità alla trachea e/o alle strutture molli del collo sono parametri di sospetto per carcinoma tiroideo (10).
La rapida comparsa di una tumefazione ghiandolare (“dalla sera alla mattina”), il dolore acuto, la tensione e la dolorabilità alla palpazione suggeriscono invece una emorragia in un nodulo cistico o misto, o una lesione infiammatoria.
L’inizio subdolo del dolore e la sua persistenza indirizzano invece per una lesione infiammatoria acuta o subacuta (10).
La presenza di linfoadenopatia latero-cervicale e/o sovra-claveare è tra i segni obiettivi più indicativi di una patologia maligna e può essere, specie nei giovani, la manifestazione clinica iniziale di un carcinoma papillare della tiroide (10).
ESAMI DI LABORATORIO
Il dosaggio del TSH sierico è fondamentale nella valutazione iniziale di un paziente con noduli tiroidei. Se il TSH è inferiore ai limiti della norma, andrebbe eseguita una scintigrafia tiroidea. In presenza di nodulazioni ipocaptanti (noduli freddi) bisognerà procedere ad esame citologico.
I dosaggi della tireoglobulina e degli anticorpi anti-tiroide (AbTg, AbTPO, TRAb) non sono informativi nel distinguere la natura di un nodulo.
Alcuni dati suggeriscono come l’uso routinario del dosaggio della calcitonina sierica sia utile nell’individuare il carcinoma midollare della tiroide in uno stadio più precoce, aumentando la sopravvivenza globale per tale patologia (11-14).
TECNICHE DI DIAGNOSTICA PER IMMAGINI
Scintigrafia tiroidea
Allo stato attuale l’indagine scintigrafica assume un ruolo diagnostico solo nel caso in cui il TSH risulti soppresso: si tratta quindi di un esame da prescrivere solamente in condizioni di tireotossicosi (7).
I noduli possono avere scarsa attività funzionale e quindi non captare o ipocaptare il radioisotopo (“noduli freddi”) o avere attività funzionale autonoma e iperconcentrare il tracciante (“noduli caldi”) (figure).
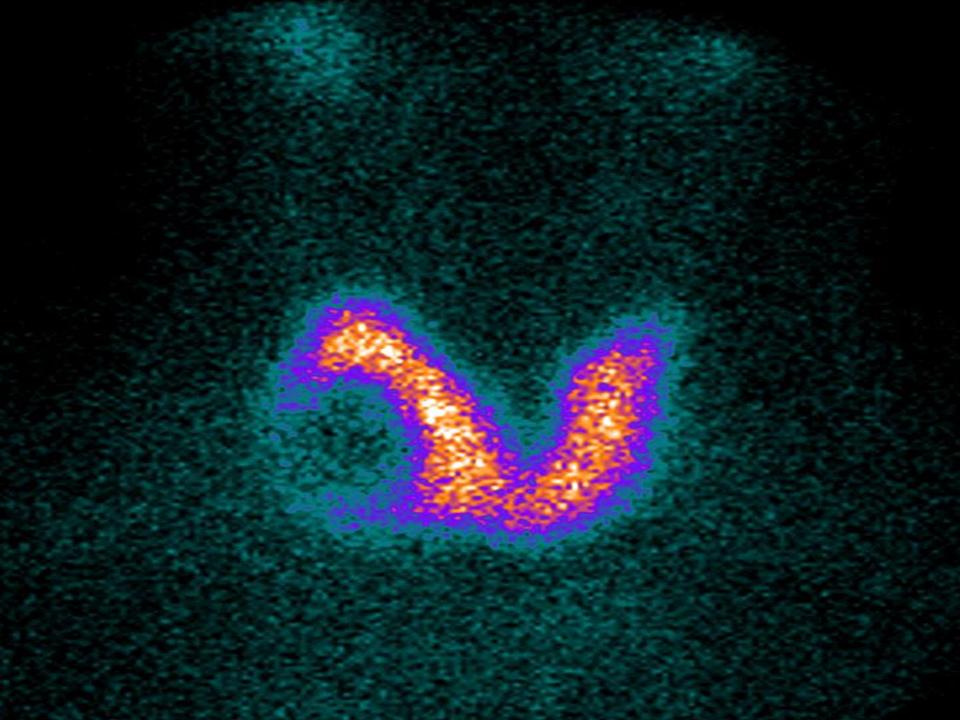

Nodulo Freddo lobo destro Nodulo caldo lobo sinistro
Circa l’85% delle formazioni nodulari appaiono alla scintigrafia tiroidea come “noduli freddi” e di questi circa il 10-15% risulta poi essere di natura maligna (15, 16). Viceversa i noduli caldi sono da sempre considerati a bassissimo rischio di malignità (17).
Ecografia del collo
L’ecografia tiroidea dovrebbe essere eseguita in tutti i pazienti con noduli tiroidei noti o sospetti.
Attraverso l’ecografia è possibile rilevare la presenza di formazioni nodulari non palpabili. L’ecografia del collo consente inoltre uno studio approfondito anche delle regioni extra-ghiandolari, valutando, in particolare, l’eventuale presenza di linfoadenopatia locoregionale e le possibili infiltrazioni di strutture vicine (10).
È l’indagine di prima scelta per una corretta valutazione del numero, dei margini e delle dimensioni delle lesioni nodulari: di queste ultime, la tecnica ad ultrasuoni consente di apprezzarne la natura (solida, cistica oppure mista), l’eventuale presenza di calcificazioni e di discriminare strutture nodulari di dimensioni anche inferiori al millimetro (7).
Integrando lo studio ecografico con la valutazione del flusso vascolare al Color-Doppler è possibile avere informazioni sulla vascolarizzazione della lesione nodulare.
In ambito ecografico l’identificazione di un nodulo sospetto si fonda sulla valutazione di aspetti predittivi di malignità. Non esistono parametri ecografici che ci consentono con certezza di classificare una lesione nodulare come benigna o maligna; tuttavia, alcune caratteristiche possono orientare verso un’ipotesi diagnostica (1): l’ipoecogenicità, la vascolarizzazione intra-nodale, i margini irregolari, la presenza di microcalcificazioni, l’assenza di alone periferico e la forma più alta che larga nella scansione trasversale sono stati associati ad una più elevata probabilità di malignità (18-23). Con l’eccezione della presenza di linfoadenopatie cervicali sospette, che costituisce una caratteristica altamente specifica ma poco sensibile, le altre caratteristiche ecografiche di sospetto, isolatamente o in combinazione, non costituiscono parametri adeguatamente sensibili e specifici per identificare con certezza tutti i noduli maligni, anche se alcune caratteristiche o associazioni hanno un elevato potere predittivo (22). Inoltre, i più comuni aspetti ecografici del carcinoma papillifero tiroideo (PTC) sono diversi da quelli del carcinoma follicolare tiroideo. Il PTC è generalmente solido o prevalentemente solido e ipoecogeno, spesso con margini irregolari e aumento della vascolarizzazione. La presenza di microcalcificazioni è altamente specifica per PTC ma possono essere difficili da distinguere rispetto a lacune di colloide. Al contrario, il carcinoma follicolare è più spesso iso- o iperecogeno, ha un alone spesso e irregolare e non presenta microcalcificazioni (24). Il nodulo cistico esprime solitamente una lesione benigna (25).
Un’attenta e accurata valutazione ecografica delle stazioni linfonodali del collo può indirizzare il clinico verso una diagnosi di malignità (26). Infatti, la concomitante presenza di linfoadenopatia loco-regionale, caratterizzata da linfonodi con rapporto diametro massimo/diametro minimo alterato, assenza di ilo germinativo e presenza di calcificazioni, avvalora il sospetto di lesione tiroidea di verosimile natura maligna, indipendentemente dalle caratteristiche ecografiche della lesione nodulare (26).
| Caratteristiche ecografiche dirimenti delle linfadenopatie | ||
| Carattere | LN reattivo | LN neoplastico |
| Rapporto asse longitudinale/trasversale | > 2 | < 1.5 |
| Profilo | fusiforme | tondeggiante |
| Ilo | presente, centrale | assente |
| Ecostruttura | omogenea | disomogenea |
| Vascolarizzazione | assente o ilare | diffusa, anarchica |
| Calcificazioni | assenti | presenti |
Elastografia
L’elastografia è una nuova tecnica ecografica, che permette di stimare la “durezza” del tessuto in esame, misurando il grado di distorsione sotto l’applicazione di una forza esterna. Si basa sul principio che sotto compressione le parti soffici del tessuto si deformano più facilmente delle parti dure, permettendo una determinazione oggettiva della consistenza del tessuto. Dati recenti evidenziano alta sensibilità e specificità nel predire la natura del nodulo, suggerendo una loro applicazione nel management del nodulo tiroideo (27).
Radiografia standard, TAC, RMN
In presenza di noduli di grandi dimensioni o di un gozzo multinodulare, può essere utile eseguire una radiografia della trachea per visualizzarne eventuali deviazioni o restringimenti di calibro (7).
L’impiego della Tomografia Assiale Computerizzata (TAC) è indicato nel valutare l’eventuale estensione della lesione ghiandolare nella regione mediastinica e nell’individuare l’eventuale coinvolgimento delle stazioni linfonodali toraco-mediastiniche o nel corso del follow-up delle eteroplasie.
L’utilizzo della Risonanza Magnetica Nucleare (RMN) è riservato esclusivamente a casi selezionati.
Ai fini della diagnosi differenziale dei noduli tiroidei la TAC e la RMN non forniscono alcun elemento diagnostico (7).
PET
Attualmente la tomografia a emissione di positroni con 2-desossi-2[18F]fluoro-D-glucosio (18F-FDG-PET) non trova impiego nella valutazione dei noduli tiroidei. Tuttavia, nell’1-2% dei pazienti sottoposti a tale metodica per motivi non tiroidei si evidenziano noduli. Poiché il rischio di malignità di queste lesioni è del 30-35% e questi tumori sono solitamente più aggressivi, tali formazioni devono essere sottoposte ad esame citologico (28-30).
ESAME CITOLOGICO MEDIANTE AGOASPIRATO (FNAC)
La FNAC è il metodo più accurato e cost-effective per la valutazione di noduli tiroidei (31,32), raggiungendo sensibilità e specificità del 95% (33,34).
L’esame eseguito con guida ecografica è scarsamente aggressivo, semplice da effettuare, ripetibile e le complicanze (emorragiche e/o infettive) sono rarissime (35,36).
In teoria tutti i noduli tiroidei potrebbero essere sottoposti a FNAC, ma la sua esecuzione, di regola sotto guida ecografica, è indicata nei pazienti con nodulo tiroideo che presentino elementi di rischio anamnestici e/o clinici e/o ecografici (37).
L’agoaspirazione di eventuali masse extra-tiroidee (linfonodali), specialmente se associata al dosaggio della tireoglobulina nel liquido di lavaggio dell’ago utilizzato, consente una diagnosi di certezza nel caso in cui la malattia si presenti solo con tumefazioni latero-cervicali o quando il coinvolgimento linfonodale sia clinicamente dubbio (38).
Oltre alla citologia convenzionale, sul materiale allestito su vetrino è possibile effettuare altre indagini al fine di avere ulteriori indicazioni diagnostiche e prognostiche:
- immunocitochimica, per il riconoscimento di marcatori tumorali
- videocitometria (image analysis): studio del contenuto di DNA cellulare
- ricerca di marcatori mediante tecniche di biologia molecolare (es: mutazioni gene RET, mutazioni p53)(39).
BIBLIOGRAFIA
- Hegedus L. The thyroid nodule. N Engl J Med 2004, 351: 1764-71.
- Favus MJ, Schneider AB, Stachura ME, et al. Thyroid cancer occurring as a late consequence of head and neck irradiation. N Engl J Med 1976, 284: 1119.
- Ashcraft MW, Van Herle AJ. Management of thyroid nodules. History and physical examination, blood tests, X-ray tests and ultrasonography. Head Neck Surg 1981, 3: 216-28.
- Brander A, Viikinkoski P, Tuuhea J, et al. Clinical versus ultrasound examination of the thyroid gland in common clinical pratice. J Clin Ultrasound 1992, 20: 37-42.
- Ross DS. Thyroid hormone suppressive therapy of sporadic non-toxic goiter. Thyroid 1992, 2: 263-9.
- Zanotti-Fregonara P, Hindiè E. Health risks of accidents at nuclear power plants. N Engl J Med 2011, 364: 2334-41.
- Schlumberger M, Pacini F. Thyroid tumors. Second Edition, Nucleon, Paris, 2003.
- Rojeski MT, Gharib H. Nodular thyroid disease: evaluation and management. N Eng J Med 1985, 313: 428-36.
- Franceschi S, Boyle P, Masisonneuve P, et al. The epidemiology of thyroid carcinoma. Crit Rev Oncogenesis 1993, 4: 25.
- Cappelli C, Agosti B, Camoni F, et al. Patologia nodulare tiroidea: proposta di un approccio diagnostico sulla base dell’esperienza di una unità tiroidologica. Chir Ital 2001, 53: 645-52.
- Pacini F, Pinchera A, Giani C, et al. Serum thyroglobulin in thyroid carcinoma and other thyroid disorders. J Endocrinol Invest 1980, 3: 283–92.
- Elisei R, Bottici V, Luchetti F, et al. Impact of routine measurement of serum calcitonin on the diagnosis and outcome of medullary thyroid cancer: experience in 10,864 patients with nodular thyroid disorders. J Clin Endocrinol Metab 2004, 89: 163–8.
- Hahm JR, Lee MS, Min YK, et al. Routine measurement of serum calcitonin is useful for early detection of medullary thyroid carcinoma in patients with nodular thyroid diseases. Thyroid 2001, 11: 73–80.
- Niccoli P, Wion-Barbot N, Caron P, et al. Interest of routine measurement of serum calcitonin: study in a large series of thyroidectomized patients. The French Medullary Study Group. J Clin Endocrinol Metab 1997, 82: 338–41.
- Dworkin HJ, Meier DA, Kaplan M. Advances in the management of patients with thyroid disease. Semin Nucl Med 1995, 25: 205-20.
- Daniels GH. Thyroid nodules and nodular thyroids: a clinical overview. Compr Ther 1996, 22: 239-50.
- Vaiana R, Cappelli C, Perini P, et al. Hyperthyroidism and concurrent thyroid cancer. Tumori 1999, 85: 247-52.
- Baloch ZW, LiVolsi VA, Asa SL, et al. Diagnostic terminology and morphologic criteria for cytologic diagnosis of thyroid lesions: a synopsis of the National Cancer Institute Thyroid Fine-Needle Aspiration State of the Science Conference. Diagn Cytopathol 2008, 36: 425–37.
- Leenhardt L, Hejblum G, Franc B, et al. Indications and limits of ultrasound-guided cytology in the management of nonpalpable thyroid nodules. J Clin Endocrinol Metab 1999, 84: 24–8.
- Papini E, Guglielmi R, Bianchini A, et al. Risk of malignancy in nonpalpable thyroid nodules: predictive value of ultrasound and color-Doppler features. J Clin Endocrinol Metab 2002, 87: 1941–6.
- Nam-Goong IS, Kim HY, Gong G, et al. Ultrasonography guided fine-needle aspiration of thyroid incidentaloma: correlation with pathological findings. Clin Endocrinol (Oxf) 2004, 60: 21–8.
- Cappelli C, Castellano M, Pirola I, et al. The predictive value of ultrasound findings in the management of thyroid nodules. QJM 2007, 100: 29–35.
- Frates MC, Benson CB, Doubilet PM, et al. Prevalence and distribution of carcinoma in patients with solitary and multiple thyroid nodules on sonography. J Clin Endocrinol Metab 2006, 91: 3411–7.
- Moon WJ, Jung SL, Lee JH, et al. Thyroid Study Group, Korean Society of Neuro- and Head and Neck Radiology 2008 Benign and malignant thyroid nodules: US differentiation—multicenter retrospective study. Radiology 2008, 247: 762–70.
- Valcavi R. Corso di ecografia diagnostica ed interventistica. Reggio Emilia 2003.
- Knudsen N, Bulow I, Jorgensen T, et al. Goiter prevalence and thyroid abnormalities at ultrasonography: a comparative epidemiological study in two regions with slightly different iodine status. Clin Endocrinol 2000, 53: 479-85.
- Ciledag N, Arda K, Aribas BK et al. The utility of ultrasound elastography and micropure imaging in the differentiation of benign and malignant thyroid nodules. AJR Am J Roentgenol 2012, 198: 244-9.
- Are C, Hsu JF, Ghossein RA, et al. Histological aggressiveness of fluorodeoxyglucose positron-emission tomogram (FDG-PET)-detected incidental thyroid carcinomas. Ann Surg Oncol 2007, 14: 3210–5.
- Bogsrud TV, Karantanis D, Nathan MA, et al. The value of quantifying 18F-FDG uptake in thyroid nodules found incidentally on whole-body PET-CT. Nucl Med Commun 2007, 28: 373–81.
- Kang KW, Kim SK, Kang HS, et al. Prevalence and risk of cancer of focal thyroid incidentaloma identified by 18F-fluorodeoxyglucose positron emission tomography for metastasis evaluation and cancer screening in healthy subjects. J Clin Endocrinol Metab 2003, 88: 4100–4.
- Gagel RF, Hoff AO, Cote GJ. Medullary thyroid carcinoma. In: Werner and Ingbar’s The Thyroid. Lippincott Williams and Wilkins, Philadelphia 2005: 967–88.
- Danese D, Sciacchitano S, Farsetti A,et al. Diagnostic accuracy of conventional versus sonography-guided fine-needle aspiration biopsy of thyroid nodules. Thyroid 1998, 8: 15–21.
- Singer P. Evaluation and management of the solitary thyroid nodule. Otolaryngol Clin North Am 1996, 29: 577-84.
- Rolla AR. Thyroid nodules in the elderly. Clin Geriatr Med 1995, 11: 259-69.
- Lippincott W & W. Carcinoma. In Werner and Ingbar’s The Thyroid, Eight Edition 2000: 930-43.
- Cappelli C, Tironi A, Marchetti GP, et al. Aggressive thyroid carcinoma showing thymic-like differentiation (CASTLE): case report and review of the literature. Endocr J 2008, 55: 685-90.
- Gharib H, Papini E, Paschke R, et al. American Association of Clinical Endocrinologists, Associazione Medici Endocrinologi, and European Thyroid Association medical guidelines for clinical practice for the diagnosis and management of thyroid nodules. J Endocrinol Invest 2010, 33: 1-50.
- Kurana K, Richard V, Izquero R, et al. The role of ultrasonography-guided fine-needle aspiration biopsy in the management of non-palpable and palpable thyroid nodules. Thyroid 1998, 8: 511-5.
- Bartolazzi A, Gasparri A, Papotti M, et al. Application of an immunodiagnostic method for improving preoperative diagnosis of nodular thyroid lesion. Lancet 2001, 357: 1644-50.
Linee guida per la gestione clinica del nodulo tiroideo
Rinaldo Guglielmi & Enrico Papini
Divisione di Endocrinologia, Ospedale Regina Apostolorum, Albano Laziale (RM)
(aggiornato al 14 maggio 2019)
- Introduzione
- Costruzione delle linee guida
- Nodulo tiroideo
- Definizione
- Inquadramento
- Anamnesi (R 1 a-b)
- Esame obiettivo (R 2 a-b)
- Ecografia
- Indicazioni e ruolo (R 3 a-g)
- Sistemi di classificazione ecografica e refertazione (R 4 a-d)
- Indicazione all’agoaspirato tiroideo (R 5 a-l)
- Il significato delle tecniche di immagine “pesanti” (R 6 a-i)
- Il ruolo del laboratorio di analisi (R 7 a-l)
- Il ruolo dell’imaging radioisotopico nella valutazione iniziale (R 8 a-g)
- L’ago-aspirato tiroideo (R 9 a-c)
- La valutazione citologica (R 10 a-d)
- La gestione clinica del referto citologico (R 11 a-y)
- L’intervento chirurgico (R 12 a-e)
- La stadiazione pre-chirurgica (R 13 a-e)
- La “sorveglianza attiva” del micro-carcinoma (R 14 a-e)
- Intervento di completamento dopo iniziale lobo-istmectomia (R 15 a-c)
- La dissezione linfonodale dei compartimenti centrale e latero-cervicali (R 16 a-c)
- Gestione non chirurgica della patologia nodulare tiroidea
- Il referto istologico utilizzato per i tumori tiroidei
Bibliografia di riferimento
Abbreviazioni
La patologia nodulare della tiroide ha raggiunto dimensioni epidemiche negli ultimi decenni, a seguito dell’enorme diffusione dell’ecografia e della sua sensibilità. Questo ha portato al riscontro di noduli di piccole dimensioni, che sfuggono all’esame clinico palpatorio e il cui significato clinico è ancora incerto.
Mentre la prevalenza palpatoria dei noduli tiroidei nelle aree a sufficiente apporto iodico è di circa il 5% nelle donne e di circa l’1% negli uomini, l’impiego dell’ecografia ad alta risoluzione consente nelle stesse aree, a seconda delle varie casistiche, il riscontro di noduli tiroidei in una percentuale compresa tra il 19% e il 68%, con un aumento della prevalenza all’aumentare dell’età.
Il riscontro di malignità è incrementato parallelamente, come conseguenza della diffusione dell’esame citologico da ago-aspirato di tali noduli; non essendo immaginabile eseguire la valutazione citologica di tutti i noduli, nel corso degli anni sono stati individuati i caratteri ecografici che più frequentemente si associano al rischio di malignità e la cui presenza suggerisce l’approfondimento diagnostico citologico.
Il percorso clinico dovrebbe consentire di evidenziare i pazienti a reale rischio significativo di malignità clinica: in altri termini il work-up ha il compito di permettere la diagnosi di malattia in uno stadio precoce, quando tale diagnosi ha un impatto reale sulla gestione della malattia e sulla sua prognosi (possibili recidive e sopravvivenza).
2. COSTRUZIONE DELLA LINEE GUIDA
Le raccomandazioni contenute in questo capitolo devono essere applicate solo dopo un’adeguata valutazione del singolo soggetto, al fine di confermare l’adeguatezza delle raccomandazioni al contesto clinico specifico. È comunque necessaria un’approfondita discussione con il paziente, volta a valutare, oltre alle condizioni cliniche oggettivabili, anche le sue preferenze e valori.
La maggior parte delle presenti raccomandazioni deriva dalle linee guida (LG) AACE–ACE–AME e ATA, entrambe comparse nel 2016, e dal Joint Statement sulla Gestione della Patologia Neoplastica della Tiroide apparso nella primavera del 2018 e nato grazie alla collaborazione della Associazione Italiana della Tiroide, della Società Italiana di Endocrinologia, dell’Associazione Medici Endocrinologi, della Società Italiana di Medicina Nucleare, delle Società Italiana di Endocrino-Chirurgia e della Società dei Patologi Clinici.
3.1. Definizione
Un nodulo tiroideo è una lesione circoscritta nell’ambito ghiandolare, distinta e definita dal restante parenchima all’esame di immagini. La rilevazione può essere palpatoria o strumentale (ecografia tiroidea ad alta risoluzione).
Ai fini della condotta clinica è necessario ricordare che la maggior parte dei noduli tiroidei corrisponde a una lesione benigna e la percentuale di malignità è dell’ordine del 5%.
3.2. Inquadramento dei noduli tiroidei
In generale tutti i pazienti con riscontro palpatorio di formazioni nodulari della tiroide, isolate o nel contesto di un gozzo multi-nodulare, indipendentemente dal riscontro incidentale (nel corso di indagini eseguite per studio di patologie del collo non dirette alla tiroide) o non, necessitano di inquadramento clinico.
Anamnesi ed esame obiettivo (diretto alla ghiandola tiroidea e alle stazioni linfonodali del collo) sono utili strumenti per identificare i fattori di rischio per carcinoma e stratificare il rischio neoplastico del nodulo tiroideo.
Elementi clinici predittivi di possibile malignità di una lesione sono:
- esposizione a radiazioni ionizzanti in età pediatrica o adolescenziale;
- terapia radiante esterna total body eseguita prima del trapianto di midollo osseo;
- familiarità per carcinoma tiroideo o carcinoma tiroideo sindromico (sindrome di Cowden, sindrome di Gardner, complesso di Carney, MEN-2, poliposi adenomatosa familiare);
- sesso maschile, in particolare se età < 40 anni o > 60 anni;
- paese di origine (Hawaii specie nei maschi di origine cinese e donne filippine, Islanda, Filippine, Giappone e Israele);
- pregressa partecipazione a missioni militari;
- carcinoma midollare della tiroide (MTC) in un familiare di primo grado;
- rapida crescita del nodulo, consistenza dura e fissità rispetto ai tessuti circostanti;
- insorgenza di cambiamenti della tonalità della voce (voce roca), paralisi delle corde vocali;
- presenza di linfadenopatia cervicale persistente e con sintomatologia compressiva.
3.2.1. Anamnesi
R 1a. Valutare i seguenti dati: età, storia personale o familiare di malattia o carcinoma della tiroide, pregressa irradiazione di testa o collo, rapidità di crescita della lesione tiroidea, dolore in regione cervicale anteriore, disfonia, disfagia, sintomi di iper- o ipotiroidismo, assunzione di farmaci o supplementi contenenti iodio.
R 1b. Non basare l’esclusione della malignità sulla base della semplice assenza di sintomi.
3.2.2. Esame obiettivo
R 2a. Esaminare attentamente il collo, registrando: dimensioni e consistenza della tiroide, sede, consistenza, dimensione e numero dei noduli, dolorabilità o dolore cervicale, eventuale adenopatia cervicale di rilievo palpatorio.
R 2b. Valutare il rischio di tumore indipendentemente dalla presenza di un nodulo solitario o di un gozzo multi-nodulare.
4.1 Indicazioni e ruolo
L’ecografia della tiroide rappresenta il mezzo tecnico più utile per l’identificazione di lesioni nodulari tiroidee sospette per malignità, consentendo una selezione dei noduli da sottoporre ad agoaspirato. I reperti ecografici non sono spesso in grado di definire con sufficiente accuratezza la natura benigna o maligna di un nodulo tiroideo. Tuttavia, i singoli aspetti ecografici possono essere associati a un rischio di malignità basso, medio o elevato e la combinazione di più aspetti ecografici di rischio consente di predire con maggiore approssimazione la natura dei noduli.
Sono stati proposti numerosi sistemi di stratificazione del rischio ecografico di malignità ma, per la semplicità di uso, il Joint Statement Italiano ha adottato il sistema di stratificazione delle LG AACE/ACE/AME del 2016. Un recente contributo ha confermato che tale sistema di stratificazione è in grado di prevedere il rischio di neoplasia con accuratezza sovrapponibile ai sistemi più complessi, pur presentando il vantaggio di una maggiore semplicità d’uso.
Un’attenzione particolare va dedicata al referto dell’esame ecografico, che costituisce la principale interfaccia tra l’esaminatore e il destinatario dell’indagine (medico curante, specialista o altri). Poiché l’immagine ecografica statica allegata al referto ha un’utilità limitata, il referto deve assolvere ai compiti di informare il paziente e il medico inviante, rendere possibile il confronto con controlli precedenti o successivi e rendere possibile la costruzione di una casistica.
R 3a. L’ecografia tiroidea è raccomandata nei pazienti ad alto rischio di neoplasia, con noduli o gozzo palpabili o con adenopatia cervicale sospetta.
R 3b. L’ecografia tiroidea non è raccomandata come screening nella popolazione generale e nei pazienti con tiroide normale alla palpazione e/o a basso rischio clinico di tireopatia.
R 3c. Il referto ecografico deve essere focalizzato sul rischio di malignità, descrivendo posizione, dimensione, forma, margini, contenuto, ecogenicità e vascolarizzazione del nodulo. In caso di noduli multipli, descrivere in dettaglio il nodulo con caratteristiche a rischio di malignità e quindi più significativo (dominanza ecografica), piuttosto che il nodulo dimensionalmente più grande.
R 3d. Al referto ecografico dovrebbe essere aggiunta una classificazione che stratifichi il rischio di malignità della lesione, in modo da comunicare con chiarezza il rischio di neoplasia atteso per il nodulo in esame.
R 3e. Descrivere i linfonodi cervicali ingranditi solo se sospetti: in tal caso specificare compartimento, numero, forma, dimensione, margini, contenuto, ecogenicità, presenza o meno di ilo e vascolarizzazione.
R 3f. L’elastografia non può essere utilizzata in sostituzione dell’esame ecografico, ma solo a complemento nei noduli con reperti ecografici e/o citologici ambigui.
R 3g. Nell’inquadramento dei noduli tiroidei non è raccomandato l’uso di mezzi di contrasto ecografici. Si suggerisce il loro uso solo nel caso di individuazione dell’area di ablazione indotta dalle tecniche minimamente invasive.
4.2. Sistemi di classificazione ecografica e refertazione
R 4. Seguire la classificazione ecografica proposta dalle linee guida AACE-ACE-AME (figura 1).
R 4a. Classe 1: lesioni a basso rischio (rischio atteso di malignità circa 1%):
- cisti semplici;
- noduli in gran parte cistici (contenuto fluido > 80%) che presentino margini regolari, con artefatti da riverberazione (“comet tail”) e senza segni ecografici di sospetto;
- noduli pressoché interamente spongiformi, confluenti o con alone regolare.
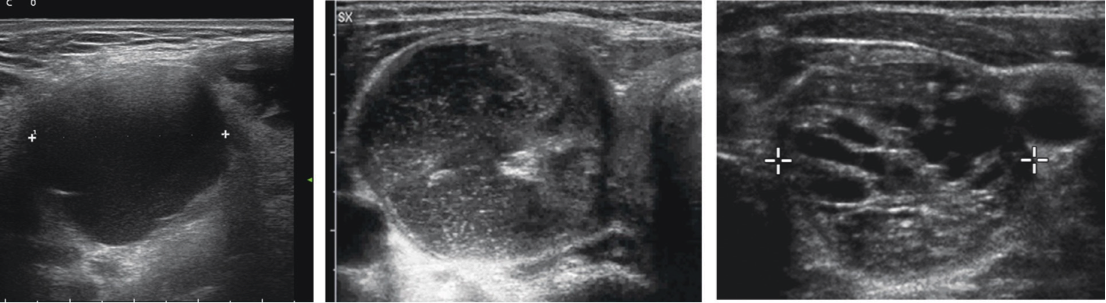
Figura 1. Lesioni a basso rischio
R 4b. Classe 2: lesioni a rischio intermedio (rischio atteso di malignità circa 5-15%):
- noduli debolmente ipoecogeni (in confronto col tessuto tiroideo circostante);
- noduli isoecogeni di forma ovoidale o arrotondata e margini regolari o indefiniti.
Possono essere presenti e aumentano il rischio di malignità:
- vascolarizzazione intra-nodulare;
- elevata rigidità all’elastografia;
- macro-calcificazioni;
- spot iperecogeni di incerto significato (non definibili con certezza come micro-calcificazioni).
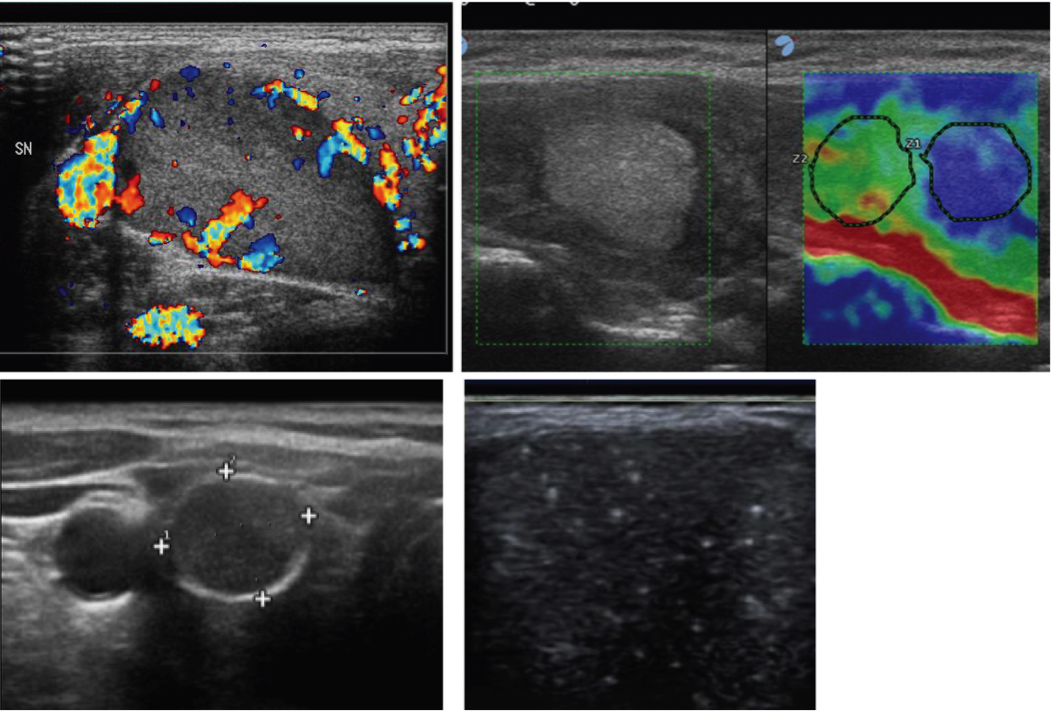
Figura 2. Lesioni a rischio intermedio
R 4c. Classe 3: lesioni ad alto rischio (rischio atteso di malignità circa 50-90%, in rapporto al numero di caratteri di sospetto). Sono presenti uno o più dei seguenti segni:
- marcata ipoecogenicità (rispetto ai muscoli pre-tiroidei);
- margini spiculati o lobulati (in almeno tre punti);
- micro-calcificazioni;
- forma “taller than wide”;
- crescita extra-tiroidea;
- adenopatia patologica.
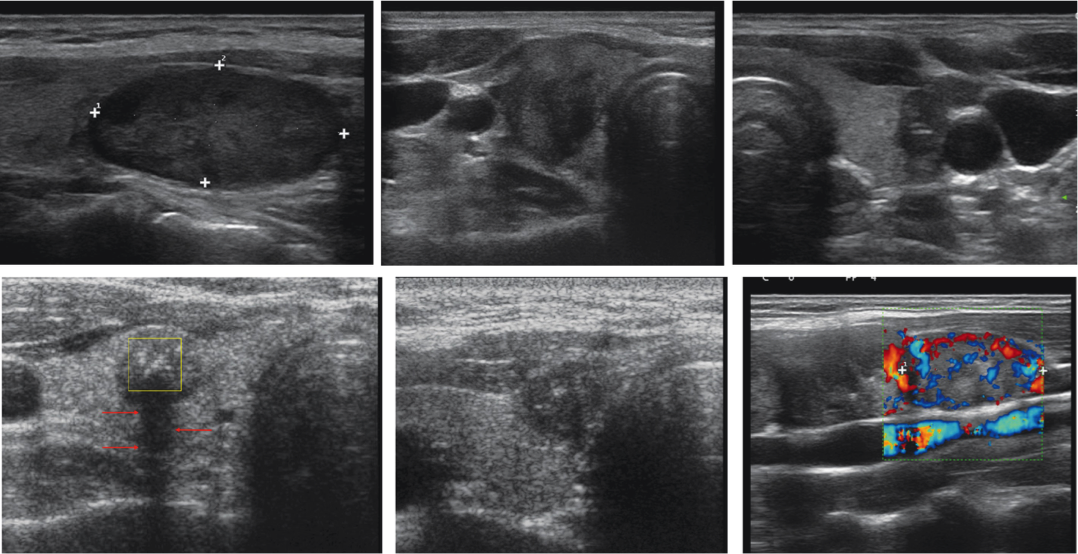
Figura 3. Lesioni ad alto rischio
| Tabella 1 Caratteristiche ecografiche dei noduli tiroidei benigni o maligni |
||
| Suggestive di benignità | Cisti semplici (margini sottili e regolari) | |
| Aspetto spongiforme (micro-cisti in un’area del nodulo > 50%) | ||
| Noduli in gran parte cistici (> 80%), contenenti colloide (presenza di spot iperecogeni a “coda di cometa”) | ||
| Calcificazione regolare a “guscio d’uovo” | ||
| Suggestive di malignità | Carcinoma papillare | Nodulo solido marcatamente ipoecogeno (in confronto con i muscoli pre-tiroidei) |
| Micro-calcificazioni prive di attenuazione posteriore | ||
| Nodulo solido ipoecogeno con marcata vascolarizzazione intra-nodulare e senza alone periferico | ||
| Nodulo “taller than wide” (diametro antero-posteriore > trasverso in scansione trasversale) | ||
| Nodulo ipoecogeno con margini spiculati o lobulati | ||
| Nodulo ipoecogeno con margini calcifici, interrotti da crescita di tessuto oltre il bordo calcificato | ||
| Neoplasia follicolare (adenoma o carcinoma) | Nodulo isoecogeno o debolmente ipoecogeno, con vascolarizzazione intra-nodulare e alone periferico ben definito | |
| Intermedie | Nodulo isoecogeno o iperecogeno con alone ipoecogeno periferico | |
| Nodulo debolmente ipoecogeno (rispetto al parenchima circostante) con margini regolari | ||
| Vascolarizzazione periferica | ||
| Macro-calcificazione intra-nodulare | ||
R 4d. Il referto tiroideo deve contenere dettagli relativi a:
- sede della tiroide: descrizione di ectopie tiroidee o approfondimento mediastinico del gozzo;
- volume ghiandolare con descrizione di alterazioni: iperplasia/gozzo, atrofia o asimmetria dei lobi;
- eco-struttura ghiandolare e/o presenza di noduli.
In caso di noduli significativi (al massimo 2), specificare:
- dimensioni e morfologia;
- ecogenicità e omogeneità;
- presenza di eventuale componente cistica;
- caratteristiche dei margini;
- presenza e caratteristiche delle calcificazioni;
- vascolarizzazione nodulare (color-doppler e power-doppler).
Il referto deve segnalare in dettaglio solo linfadenopatie sospette del collo, indipendentemente dal fatto che siano riconducibili alla patologia tiroidea in esame.
Quando possibile eseguire elastografia e comunque al termine dell’esame deve essere riportata l’eventuale indicazione alla valutazione citologica da ago-aspirato.
4.3. Indicazione all’agoaspirato tiroideo (FNA)
R 5a. Nell’indicazione alla FNA bilanciare il rischio di ritardata diagnosi di malignità con quello di procedure diagnostiche o chirurgiche superflue e gestire uniformemente i noduli tiroidei, indipendentemente dal riscontro incidentale o non.
R 5b. La FNA non è raccomandata in noduli con diametro ≤ 5 mm, indipendentemente dai loro caratteri; in tali noduli è suggerita l’esecuzione dell’ecografia di controllo a 12-24 mesi.
R 5c. In noduli con diametro fra 5 e 10 mm con caratteri ecografici ad alto rischio è suggerita l’esecuzione di FNA o la semplice osservazione, a seconda del contesto clinico e della volontà del paziente. Si suggerisce comunque in tali noduli, se tecnicamente fattibile, la FNA nelle seguenti situazioni:
- lesioni sub-capsulari o para-tracheali;
- sospetto di crescita extra-tiroidea;
- presenza di linfonodi metastatici;
- storia personale o familiare di carcinoma midollare della tiroide o MEN;
- sospetto clinico di crescita invasiva (come disfonia persistente).
R 5d. La FNA è sempre raccomandata nelle lesioni tiroidee:
- con diametro ≥ 10 mm se ad alto rischio ecografico;
- con diametro ≥ 15 mm se a rischio ecografico intermedio;
- con diametro ≥ 20 mm se a rischio ecografico basso solo se i noduli sono in accrescimento significativo o sono associati a elementi clinici di sospetto.
R 5e. La FNA deve essere eseguita prima di procedere a chirurgia tiroidea o a terapia ablativa minimamente invasiva, indipendentemente dal tipo di ablazione.
R 5f. La FNA non deve essere eseguita routinariamente nei noduli iperfunzionanti (ipercaptazione alla scintigrafia), ad eccezione dei noduli in età pediatrica.
R 5g. Nelle tireopatie multi-nodulari eseguire la FNA in genere su non più di 2 noduli, sulla base dei criteri di sospetto per malignità.
R 5h. Campionare la componente solida delle lesioni complesse, preferibilmente se vascolarizzata, sottoponendo a esame citologico sia il materiale dell’FNA che il fluido drenato.
R 5i. La FNA è raccomandata nei noduli con rigidità all’elastografia.
R 5j. Eseguire la valutazione ecografica delle lesioni rilevate alla TC o alla RM prima di procedere alla FNA.
R 5k. Sottoporre a FNA eco-guidata le lesioni con captazione focale incidentale alla 18F-FDG-PET, dopo la loro conferma ecografica.
R 5l. In presenza di adenopatia cervicale sospetta, eseguire esame citologico mediante FNA sul linfonodo sospetto e il dosaggio della tireoglobulina (Tg) o della calcitonina (CT) sul liquido di lavaggio dell’ago (in base alle indicazioni cliniche).
5. IL SIGNIFICATO DELLE TECNICHE DI IMMAGINE “PESANTI”
Spesso i noduli tiroidei sono riscontrati nel corso di indagini effettuate per altri motivi clinici. Il riscontro di gozzo nodulare nel corso di eco-doppler dei vasi epi-aortici è una situazione frequente. In tale contesto può accadere che lo stesso operatore che sta eseguendo l’eco-doppler possa effettuare direttamente l’ecografia tiroidea o possa segnalare il riscontro sul referto in modo generico, indicando un esame ecografico specifico per la tiroide.
I noduli tiroidei possono essere riscontrati anche durante l’esecuzione di TC o di RM del collo/torace. I contributi in letteratura dimostrano che la capacità discriminante la natura dei noduli di queste tecniche è inferiore a quella dell’esame ecografico e tali indagini non devono essere utilizzate per definire il rischio di malignità. La TC e la RM, al contrario, hanno un ruolo non sostituibile nei casi di gozzo voluminoso che si approfonda al di sotto del giugulo, vista l’impossibilità dell’ecografia di valutare la porzione immersa della ghiandola e l’imprecisione della scintigrafia. In tali casi, le due indagini (TC e RM) sono in grado di fornire una valutazione sulle reali dimensioni della ghiandola e sui rapporti anatomici con le strutture vitali del collo (determinando in particolare il lume della trachea nel suo diametro più ristretto) e l’immersione nel mediastino, fornendo informazioni utili per decidere la necessità di un intervento chirurgico e la sua corretta pianificazione.
Un discorso a parte merita il riscontro di noduli nel corso di PET/TC con 18F-FDG: in quasi il 5% di tali esami (di solito eseguiti per follow-up di pazienti oncologici) viene segnalato un incidentaloma tiroideo, che corrisponde ad area focale ipercaptante. Qualora tale area ipercaptante corrisponda a un nodulo, soprattutto in presenza di TSH normale, la probabilità di malignità nei noduli solidi è abbastanza elevata: 20-45% (valore medio del 33%). Se il TSH è basso e/o soppresso, è necessario escludere un’iperfunzione mediante esecuzione di scintigrafia tiroidea.
In tutti i pazienti con riscontro di un incidentaloma tiroideo si impone la valutazione ecografica della tiroide e il dosaggio del TSH, poiché il valore del SUVmax (indice di captazione massimo della lesione normalizzato per la superficie corporea del paziente e per la dose di 18F-FDG somministrata) non è utile nel differenziare le lesioni maligne da quelle benigne. È riportato che i noduli con citologia indeterminata (TIR 3A e 3B) se ipercaptanti alla PET/CT con 18F-FDG sono ad alta probabilità di neoplasia. In considerazione dell’incostante captazione delle neoplasie tiroidee non aggressive (carcinomi follicolari e varianti follicolari del carcinoma papillare) e della prevalenza non elevata delle neoplasie maligne tra i noduli indeterminati (15 – 35%), non appare “cost-effective” completare l’inquadramento dei noduli indeterminati con l’esecuzione di routine della PET/CT con 18F-FDG.
R 6a. RM e TC non sono raccomandate per l’inquadramento di routine del nodulo tiroideo.
R 6b. Nel caso di riscontro di gozzo nodulare alla RM e/o alla TC, è opportuna l’esecuzione di un’ecografia specifica per stratificare il rischio di malignità dei noduli.
R 6c. Si suggerisce l’uso di RM e/o TC in gozzi nodulari di grandi dimensioni, al fine di escludere la compressione delle vie aeree, valutare l’estensione mediastinica del gozzo e i rapporti anatomici con le strutture cervicali o evidenziare la presenza di linfonodi patologici in regioni cervicali non esplorabili con l’ecografia.
R 6d. Nel caso di riscontro di ipercaptazione tiroidea alla PET/CT con 18F-FDG, è opportuna l’esecuzione di un’ecografia specifica per confermare la presenza di lesioni nodulari.
R 6e. I noduli tiroidei ipercaptanti alla PET/CT con 18F-FDG devono essere sottoposti a FNA se > 5 mm.
R 6f. Eseguire una scintigrafia tiroidea se l’ipercaptazione tiroidea alla PET/CT con 18F-FDG corrisponde ecograficamente a nodulo almeno > 8-10 mm e il TSH è basso o soppresso.
R 6g. Programmare un follow-up clinico-ecografico dei noduli positivi alla PET/CT con 18F-FDG anche se citologicamente benigni.
R 6h. La PET/CT con 18F-FDG non è raccomandata nei noduli tiroidei con citologia indeterminata.
R 6i. La PET/TC può essere utilizzata per la stadiazione pre-operatoria dei noduli maligni con caratteristiche citologiche o cliniche aggressive.
6. IL RUOLO DEL LABORATORIO DI ANALISI
Il TSH è il singolo dato di laboratorio che meglio definisce la funzione tiroidea e in alcune regioni rappresenta l’unico dato di laboratorio consentito nell’inquadramento iniziale. Con questo schema (definito TSH reflex), nel caso il valore del TSH sia basso (al di sotto di una soglia pre-determinata) o francamente soppresso, viene effettuato in automatico il dosaggio delle frazioni libere e degli anticorpi anti-recettore del TSH; nel caso di valore di TSH ai limiti alti o francamente al di sopra del limite massimo della norma, viene effettuato in automatico il dosaggio di FT4 e TPOAb.
La tireoglobulina (Tg) è un marcatore di recidiva di neoplasia differenziata tiroidea dopo l’intervento di tiroidectomia, soprattutto (ma non necessariamente) se questa è seguita dall’ablazione del residuo chirurgico con iodio radioattivo. In fase pre-operatoria i livelli sierici non mostrano valori elevati in presenza di malignità rispetto alla patologia nodulare benigna: la correlazione più significativa dei valori di Tg, infatti, è con le dimensioni del gozzo (pressoché “lineare”) piuttosto che con la natura dei noduli. La Tg non rappresenta pertanto un esame specifico per il carcinoma tiroideo. Il dosaggio può essere di aiuto se valutato sul liquido di lavaggio della siringa utilizzata per l’FNA nel caso sia stata campionata una lesione al di fuori del letto tiroideo suggestiva di tessuto tiroideo o un linfonodo con criteri ecografici sospetti per secondarietà.
La calcitonina (CT) è un marcatore sensibile e specifico per MTC. La sua importanza è legata al fatto che il MTC è un tumore non molto frequente (< 5% di tutti i tumori della tiroide) ma potenzialmente molto aggressivo e non responsivo alla terapia con radioiodio. Sfortunatamente il dosaggio della CT può presentare falsi positivi (CT elevata in assenza di MTC) ed elevati valori di CT sierica si possono riscontrare in numerose condizioni, patologiche e non: iperplasia cellule C para-follicolari, ipergastrinemia (gastrinomi, gastrite cronica atrofica), ipercalcemia (iperparatiroidismo primario), insufficienza renale cronica, NET (microcitoma polmonare, carcinoide polmonare, tumore delle isole pancreatiche, VIPoma, tumori prostatici, tutte situazioni in cui la CT non aumenta dopo stimolo con calcio), tumori differenziati della tiroide, tiroidite autoimmune, anticorpi eterofili anti-CT (macro-CT), gravidanza, attività fisica. Aumentati valori di CT possono essere farmaco-indotti: inibitori di pompa protonica, gluco-corticoidi, ß-bloccanti, glucagone, agonisti del GLP-1. È inoltre difficile stabilire un unico cut-off di CT, sia basale che stimolata, in grado di diagnosticare un MTC. La determinazione di CT nel siero ha un valore predittivo di MTC prossimo al 100% per valori > 100 pg/mL, mentre per valori compresi tra 50 e 100 pg/mL tale valore scende a circa il 25% e per valori tra 20 e 50 pg/mL a meno del 10% (tab 2).
| Tabella 2 Rischio di MTC per i diversi valori di CT |
|
| Valore (pg/mL) | Rischio di MTC |
| > 100 | Estremamente elevato (100%) |
| 50-100 | Moderato (25%) |
| 20-50 | Basso (8.3%) |
| < 10 | Normale |
Nei casi con CT fra 20-100 pg/mL può essere effettuato il test di stimolo con calcio endovena. In alcune casistiche controllate, sono risultati altamente sospetti per MTC valori stimolati di CT > 90 pg/mL nelle donne e > 130 pg/mL negli uomini. Analogamente alla Tg, la CT può essere dosata sul liquido di lavaggio della siringa utilizzata per l’FNA tiroideo in caso il nodulo sia sospetto per CMT.
R 7a. Nell’inquadramento iniziale del nodulo tiroideo è consigliato il dosaggio del TSH reflex.
R 7b. Non è raccomandato il dosaggio routinario delle frazioni libere degli ormoni tiroidei e degli anticorpi anti-tiroide.
R 7c. Dosare FT4 ed FT3 in caso di TSH basso ed FT4 e TPOAb in caso di TSH elevato.
R 7d. Nei pazienti con reperti ecografici o clinici suggestivi di tiroidite cronica linfocitaria, se TPOAb sono nei limiti dosare gli anticorpi anti-Tg.
R 7e. Non è consigliata la misurazione dei livelli della Tg sierica nella valutazione iniziale del nodulo tiroideo.
R 7f. Il dosaggio della Tg può essere preso in considerazione nei pazienti che devono essere sottoposti a chirurgia per carcinoma differenziato.
R 7g. Dosare gli anticorpi anti-recettore del TSH (TRAb) solo nei pazienti con TSH soppresso, nel sospetto di un coesistente morbo di Graves.
R 7h. Non si raccomanda a favore né contro la determinazione della CT sierica nell’inquadramento di routine dei noduli tiroidei.
R 7i. La CT deve essere dosata nei noduli con reperti ecografici sospetti o con referto citologico indeterminato o sospetto per malignità e nei pazienti con storia familiare o sospetto clinico di MTC o MEN-2. Considerarlo inoltre prima dell’intervento chirurgico nei gozzi pluri-nodulari.
R 7j. Ripetere il dosaggio della CT se i livelli basali sono superiori alla norma, soprattutto in presenza di possibili fattori interferenti. Il dosaggio dovrà essere inoltre eseguito dopo un’adeguata sospensione dei possibili farmaci interferenti.
R 7k. Si suggerisce di considerare il test di stimolo endovenoso della CT con calcio se i livelli basali sono < 100 pg/mL.
R 7l. Si suggerisce il dosaggio di calcemia e PTH in caso di lesioni cervicali ecograficamente compatibili con paratiroidi iperplastiche.
7. RUOLO DELL’IMAGING RADIOISOTOPICO NELLA VALUTAZIONE INIZIALE DEL NODULO TIROIDEO
La capacità di identificare un nodulo all’indagine scintigrafica dipende dalla funzione del nodulo e dalle sue dimensioni (con la gamma-camera sono ben identificabili come distinti noduli di diametro ≥ 1 cm).
Benché sia teoricamente preferibile l’impiego dello Iodio123-iodurato, in quanto permette di eseguire una precisa mappatura funzionale della ghiandola, la sua non sempre pronta disponibilità, il maggior costo e la maggior dose di radiazioni che fornisce al paziente (rispetto al 99mTc-Pertecnetato) ne limitano l’utilizzo di routine. Per tale motivo, nella pratica clinica viene utilizzato prevalentemente il 99mTc-Pertecnetato.
Anche se i noduli scintigraficamente “freddi” hanno una maggiore probabilità di essere maligni rispetto a quelli “caldi”, il valore predittivo per malignità dei noduli non captanti è comunque basso (10-15%). Per tale motivo, il semplice riscontro di nodulo freddo non è sufficiente a indirizzare all’esame citologico ed è necessario valutare in modo combinato tale caratteristica con i caratteri ecografici suggestivi per malignità.
Nonostante il TSH possa essere non completamente soppresso nei noduli iperfunzionanti in zone di endemia gozzigena, è altamente improbabile trovare valori di TSH > 1 mUI/mL in pazienti con noduli “caldi”. La scintigrafia mantiene un ruolo nella valutazione dei noduli con citologia indeterminata, riscontro abbastanza frequente nei noduli caldi. In caso di citologia indeterminata, non è necessario l’intervento chirurgico se la scintigrafia tiroidea mostra un’area di ipercaptazione chiaramente corrispondente al nodulo incriminato.
R 8a. L’esecuzione routinaria della scintigrafia non è raccomandata nell’inquadramento iniziale del nodulo tiroideo.
R 8b. La scintigrafia tiroidea può essere suggerita in tutte le condizioni in cui il TSH è soppresso.
R 8c. La scintigrafia tiroidea dovrebbe essere considerata quando si sospetta la presenza di tessuto tiroideo ectopico o di gozzo retro-sternale.
R 8d. In aree iodo-carenti la scintigrafia può essere eseguita per escludere l’autonomia funzionale del gozzo nodulare anche quando il TSH è ai limiti inferiori della norma (per esempio 0.5-1.0 mIU/L).
R 8e. Eseguire la scintigrafia, indipendentemente dai livelli di TSH, quando si valuta l’opportunità della terapia con radioiodio.
R 8f. La iodo-captazione tiroidea non è raccomandata di routine, eccetto che nel sospetto di tireotossicosi a bassa captazione.
R 8g. La scintigrafia va eseguita in caso di citologia indeterminata se il TSH è basso e le dimensioni del nodulo sono > 10 mm.
La corretta gestione dei noduli tiroidei è basata sull’integrazione delle informazioni cliniche con quelle dell’esame ecografico, in modo da selezionare appropriatamente i noduli da sottoporre a FNA, l’indagine dotata di maggiore accuratezza nel verificare il rischio di malignità delle lesioni tiroidee.
I rischi della procedura sono modesti e vanno dalla comparsa di transitorio dolore locale, a ecchimosi cutanee, fino a emorragie tiroidee e/o extra-tiroidee, in genere a riassorbimento spontaneo. La frequenza delle complicanze minori è comunque bassa (< 5%) e solo gravi errori di tecnica possono indurre complicanze maggiori (puntura di grossi vasi o di strutture nervose).
I maggiori limiti diagnostici dell’FNA sono dovuti al prelievo di materiale non adeguato a porre la diagnosi citologica, con conseguente necessità di ripetere il prelievo. Tale evento si verifica con una frequenza di circa il 5-10%, solo in parte influenzata dall’esperienza dell’operatore.
L’esame citologico in rari casi può non individuare la presenza di una neoplasia (1-3% di falsi negativi) o, al contrario e meno frequentemente, è possibile il sospetto di neoplasia in un nodulo in realtà benigno (falsi positivi in circa l’1% dei casi). Per tali motivi e per la bassa ma possibile evolutività in senso maligno della patologia nodulare tiroidea, può essere opportuno ripetere l’esame a distanza. L’FNA deve essere ripetuto in occasione di un aumento dimensionale significativo (> 20% del diametro maggiore o > 50% del volume) o di una modifica sospetta dell’aspetto ecografico del nodulo interessato.
Nel modulo di consenso informato devono essere presenti le informazioni relative alle complicanze e ai limiti diagnostici, che devono essere spiegati analiticamente dal medico esecutore al paziente per la firma prima della manovra.
R 9a. Anche in caso di noduli palpabili eseguire sempre la FNA sotto guida ecografica, per la sua migliore accuratezza diagnostica.
R 9b. Inviare al patologo tutte le informazioni cliniche rilevanti, compresa la stratificazione ecografica del rischio di malignità.
R 9c. Specificare la sede del prelievo, il numero di vetrini complessivi (fissati in aria/cytofix) e/o degli altri campioni biologici inviati.
Il primo elemento di un referto citologico è il giudizio complessivo sull’adeguatezza della FNA, specificando se il materiale fornito può essere considerato sufficiente per una diagnosi (esame adeguato) o non diagnostico (esame inadeguato). Come regola generale, il campione è definito diagnostico se sono presenti almeno 6 gruppi di cellule epiteliali tiroidee, costituiti da almeno 10 cellule ben conservate per gruppo. Tuttavia, i campioni citologici caratterizzati da marcata atipia cellulare sono definiti come sospetti anche in assenza del numero di cellule follicolari usualmente richiesto per l’adeguatezza.
Nella maggior parte dei Servizi di Anatomia Patologica sul territorio nazionale vengono utilizzate per il referto citologico le 5 classi diagnostiche stabilite dal Consensus AIT-SIAPEC del 2014.
| Tabella 3 Consensus Italiana per la Citologia Tiroidea (SIAPEC 2014) |
|
| Classe | Definizione |
| TIR 1 | Non diagnostico (inadeguato o insufficiente) |
| TIR 1c | Cistico non diagnostico |
| TIR 2 | Benigno |
| TIR 3A | Lesione indeterminata a basso rischio (atipia o lesione follicolare di significato indeterminato) |
| TIR 3B | Lesione indeterminata ad alto rischio (neoplasia follicolare o lesione sospetta per neoplasia follicolare) |
| TIR 4 | Sospetto per malignità |
| TIR 5 | Maligno |
R 10a. Il patologo deve fornire una breve ma dettagliata descrizione dei reperti citologici, corredata da una diagnosi citologica conclusiva.
R 10b. Specificare nel referto citologico la classe di rischio di malignità sulla base della consensus SIAPEC-AIT 2014.
R 10c. In caso di reperto citologico indeterminato, richiedere un secondo parere a un patologo esperto in citologia tiroidea, appartenente a centri ad alto volume di patologia.
R 10d. In caso di reperto citologico indeterminato, il citologo può fornire l’indicazione operativa a eseguire approfondimento con determinazione immuno-citochimica.
10. GESTIONE CLINICA DEL REFERTO CITOLOGICO
La Consensus SIAPEC-AIT del 2014, oltre che assicurare una classificazione dei reperti citologici, fornisce le raccomandazioni operative cliniche per ciascuna classe.
Per i referti citologici TIR 1 (campione inadeguato) viene consigliata la ripetizione dell’esame entro 1-3 mesi. Al fine di ridurre il rischio di inadeguatezza del campione, nelle lesioni complesse prelevare sulla porzione solida e nei noduli di grandi dimensioni campionare le porzioni più periferiche per evitare la parte necrotica centrale, spesso presente. Nel caso di citologia ancora inadeguata dopo la ripetizione dell’esame, prendere in considerazione l’esame micro-istologico del nodulo mediante biopsia con ago tranciante (CNB).
Deve essere sottolineato che la classificazione prevede un referto di inadeguatezza compatibile con benignità (TIR 1 C), in caso di nodulo prevalentemente o completamente cistico. Questo tipo di nodulo non può, infatti, fornire una quota di cellule tali da considerare adeguato il prelievo. La combinazione di tale classe citologica con il riscontro di caratteri ecografici benigni depone sul piano clinico per la benignità.
I noduli con citologia benigna (TIR 2) possono essere avviati a semplice follow-up annuale o biennale. La ripetizione dell’esame citologico sarà guidata, come già detto, da aumenti dimensionali significativi e/o da modifiche sospette della struttura del nodulo.
I noduli con citologia indeterminata devono avere gestione differente a seconda che siano classificati come TIR 3 A o TIR 3 B.
In caso di citologia TIR 3 A, con prevalenza di malignità dal 5 al 15%, è di regola indicato un approccio conservativo che preveda la ripetizione a distanza dell’esame. La ripetizione dell’esame in circa il 50% dei casi è seguita da una riclassificazione citologica TIR 2, che quindi definisce il nodulo come benigno e ne consente il follow-up nel tempo. Ulteriori approfondimenti, dalla valutazione immunocitochimica, alla CNB eco-guidata o all’intervento chirurgico, sono presi in considerazione solo in caso di persistenza della citologia indeterminata, associata a crescita del nodulo o alla presenza di caratteri ecografici sospetti.
I noduli con citologia TIR 3 B sono gravati da una prevalenza di malignità del 15-30% e di norma sono inviati alla chirurgia diagnostica (in genere rappresentata dalla lobo-istmectomia). In caso di rilevanti comorbilità del paziente o di volontà di non essere operati, sono prese in considerazioni ulteriori indagini (immuno-citochimica, CNB per esame micro-istologico, determinazioni molecolari), al fine di meglio definire il rischio di malignità della lesione. Quest’ultimo approccio, più conservativo, può essere considerato in presenza di caratteri ecografici non sospetti.
Le classi TIR 4 e TIR 5 devono essere avviate all’intervento chirurgico, specificando al paziente il rischio di malignità che nel caso del TIR 4 è dell’ordine dell’65-80% e nel caso del TIR 5 è > 95%. Al fine di una migliore pianificazione dell’intervento chirurgico, i noduli con citologia TIR 4 possono essere sottoposti a indagini immuno-citochimiche e/o molecolari e, in casi e ambienti selezionati, può essere utile la programmazione dell’esame istologico intra-operatorio.
| Tabella 4 Categorie di refertazione citologica SIAPEC-AIT 2014 con le azioni cliniche suggerite |
|||
| Codice | Categoria diagnostica | Rischio atteso di malignità (%) | Azione clinica suggerita |
| TIR 1 | Non diagnostico | Non definito | Ripetere FNA eco-guidata dopo 3 mesi |
| TIR 1C | Non diagnostico-cistico | Basso (variabile in base al quadro clinico) | Valutare nel contesto clinico, eventualmente ripetere FNA |
| TIR 2 | Non maligno/benigno | < 3 | Follow-up |
| TIR 3A | Lesione indeterminata a basso rischio | < 10 | Follow-up/indagini molecolari/ eventuale ripetizione FNA |
| TIR 3B | Lesione indeterminata ad alto rischio | 15-30 | Exeresi chirurgica (eventuali Indagini molecolari) |
| TIR 4 | Sospetto di malignità | 60-80 | Exeresi chirurgica con eventuale esame intra-operatorio (eventuali Indagini molecolari) |
| TIR 5 | Maligno | > 95 | Exeresi chirurgica. Approfondimento diagnostico in casi selezionati |
Raccomandazioni
Noduli non diagnostici alla FNA (TIR 1)
R 11a. in caso di TIR 1, ripetere l’FNA tiroideo entro 3 mesi.
R 11b. Se il risultato della FNA è ripetutamente inadeguato in un nodulo solido, considerare l’esecuzione di CNB sotto guida ecografica. In seconda istanza, soprattutto in presenza di caratteri ecografici o clinici di sospetto, considerare l’esecuzione di chirurgia diagnostica. Solo in noduli solidi con caratteri clinici ed ecografici chiaramente non sospetti può essere considerato il semplice follow-up.
R 11c. Nei noduli cistici o prevalentemente cistici, senza caratteri clinici o ecografici di sospetto e persistentemente non diagnostici (TIR 1C), è suggerito un attento follow-up clinico ed ecografico.
Noduli benigni alla FNA (TIR 2)
R 11d. Nei noduli citologicamente benigni:
- eseguire il solo follow-up clinico, a meno che non siano causa di sintomi locali o presentino accrescimento progressivo;
- considerare la ripetizione dell’ecografia e il dosaggio del TSH a 12 – 24 mesi, in accordo con il contesto clinico;
- se sono invariati al primo controllo ecografico, ripetere un secondo controllo ecografico non prima di 24 mesi;
- asintomatici con citologia ripetutamente benigna e senza caratteri clinici o ecografici di sospetto, il follow-up può essere rimandato a 24-36 mesi;
- con citologia benigna ma con caratteri clinici o ecografici di sospetto, ripetere la FNA entro 1–3 mesi;
- a rapida crescita o diventati sintomatici ripetere la FNA entro un mese.
Lesioni indeterminate (TIR 3)
R 11e. La gestione dei noduli tiroidei citologicamente indeterminati deve essere pianificata in base alla sotto-classificazione citologica, ai dati clinici e alle caratteristiche ecografiche. Considerare nella decisione clinica l’esecuzione di indagini supplementari, come l’elastosonografia, l’immuno-citochimica, lo studio molecolare. Valutare sempre inoltre le preferenze del paziente.
Noduli con citologia TIR 3A
R 11f. Considerare la gestione conservativa nel caso di criteri favorevoli riguardanti gli aspetti clinici, le dimensioni della lesione e i caratteri di rischio ecografici ed elastografici.
R 11g. Ripetere la FNA per un’ulteriore valutazione citologica e rivalutare il campione con un citopatologo esperto.
R 11h. Può essere presa in considerazione la CNB per un prelievo micro-istologico, ma il suo uso di routine non è raccomandato.
R 11j. Non si raccomanda né a favore né contro la determinazione di routine dei marcatori molecolari e/ immuno-citochimici. Considerarne l’esecuzione solo in centri con specifica esperienza.
Noduli con citologia TIR 3B
R 11k. Si suggerisce la chirurgia (lobo-istmectomia) per la maggior parte delle lesioni.
R 11l. La tiroidectomia totale può essere eseguita in base al contesto clinico, alla coesistenza di noduli nel lobo tiroideo controlaterale e alla preferenza del paziente.
R 11m. L’uso dell’esame istologico estemporaneo non è raccomandato nella routine clinica.
R 11n. Considerare uno stretto follow-up clinico in una minoranza di casi con caratteri clinici ed ecografici favorevoli, ma solo dopo una valutazione multi-disciplinare e la discussione con il paziente delle varie opzioni terapeutiche.
R 11o. Non si raccomanda né a favore né contro la determinazione di routine dei marcatori molecolari e/ immuno-citochimici.
Noduli sospetti alla FNA (TIR 4)
R 11p. Si raccomanda il trattamento chirurgico per i noduli citologicamente sospetti.
R 11q. Ripetere la FNA in caso di cellularità inadeguata o di necessità di una migliore caratterizzazione con tecniche immuno-istochimiche o di biologia molecolare
R 11r. L’uso dell’esame istologico estemporaneo può essere considerato solo in casi specifici.
Noduli maligni alla FNA (TIR 5)
R 11s. Nel caso di carcinoma tiroideo differenziato, si raccomanda il trattamento chirurgico.
R 11t. In caso di sospetto carcinoma anaplastico, di metastasi e di linfoma tiroideo, si raccomanda un approfondimento diagnostico completo prima di procedere all’intervento chirurgico.
R 11u. Prima dell’intervento rivedere con il paziente i risultati dell’ecografia e dell’esame citologico, discutere le opzioni di trattamento e consultare un chirurgo esperto in chirurgia endocrina.
R 11v. Prima della chirurgia eseguire l’esame ecografico del collo, la FNA di ogni nodulo o linfonodo sospetto e valutare la motilità delle corde vocali.
R 11w. Nel caso di linfonodi ecograficamente sospetti per secondarietà, è raccomandata la conferma della natura metastatica con l’esame citologico completato dalla misurazione della Tg o CT nel liquido di lavaggio dell’ago.
R 11y. Per una più accurata stadiazione pre-operatoria in casi con caratteristiche aggressive, considerare l’uso di RM, TC e/o 18F-FDG PET/TC.
11. INTERVENTO CHIRURGICO
L'intervento chirurgico della tiroide non è scevro da possibili complicanze transitorie e/o definitive (emorragie, disfonia e/o disturbi respiratori da paralisi del ricorrente, ipoparatiroidismo e cicatrici cutanee). Il tasso di complicanze dipende dall’esperienza dell’operatore e si riduce drasticamente nei centri ad alto volume di patologia tiroidea. Ricordare al paziente che la maggior parte dei tumori tiroidei ha un decorso indolente e che la prognosi in genere è favorevole. Per tale motivo, il tipo di intervento chirurgico deve essere programmato dopo attenta discussione con il paziente e avendo analizzato il rapporto tra i potenziali benefici e le possibili complicanze.
R 12a. La lobo-istmectomia è suggerita come trattamento iniziale nei pazienti con micro-carcinoma (PTMC) senza evidenza di estensione extra-tiroidea o interessamento linfonodale, senza pregressa irradiazione del collo e con normali valori di CT.
R 12b. L’intervento chirurgico di tiroidectomia totale è raccomandato per tumori di grandi dimensioni (> 4 cm) e in caso di citologia probante per lesione follicolare aggressiva o MTC, indipendentemente da altri fattori clinici.
R 12c. Per tumori > 1 e < 4 cm, senza segni estensione extra-capsulare o evidenza clinica di metastasi locali, l’intervento iniziale può essere di semplice lobo-istmectomia. La tiroidectomia totale può essere eseguita in caso di preferenza del paziente, poiché consente di poter eseguire terapia radio-metabolica, ove necessaria, ed evita il rischio di un secondo intervento di completamento in caso di istologia non favorevole.
R 12d. In caso di evidenza pre-operatoria di metastasi linfonodali locali, la tiroidectomia totale deve essere associata alla rimozione dei linfonodi dei compartimenti interessati e, sempre, del compartimento centrale (VI) del collo.
R 12e. Uno stretto follow-up clinico (“sorveglianza attiva”) può essere preso in considerazione nei pazienti con PTMC a basso rischio e nei pazienti anziani o ad alto rischio chirurgico per comorbilità internistiche.
11.1 Stadiazione pre-chirurgica
In considerazione del rischio di interessamento linfonodale del collo, nei tumori della tiroide è necessaria una valutazione preoperatoria accurata dei compartimenti linfonodali cervicali. Il risultato di tale valutazione ha un impatto significativo sul tipo di intervento chirurgico da effettuare.
L’ecografia è lo strumento più adatto per evidenziare metastasi locali (sensibilità maggiore per i compartimenti laterali vs compartimento centrale). L’uso di ecografia ad alta risoluzione con operatore esperto (meglio se della stessa struttura dove il paziente sarà operato) consente di fornire informazioni riguardo a:
- grandezza e sede del tumore;
- multi-focalità/bilateralità o estensione extra-tiroidea della neoplasia;
- presenza di linfonodi e/o masse cervicali sospette o di anomalie dei grossi vasi.
Nello studio delle stazioni linfonodali, in caso di dubbio ecografico, considerare l’esame citologico associato al dosaggio della Tg sul liquido di wash-out ell’ago utilizzato per la FNA. Valori di Tg elevati (in alcune casistiche > 500 ng/mL) sono diagnostici per metastasi linfonodali, mentre per valori più bassi è opportuno confrontare i valori della Tg ottenuti sul wash-out con quelli ematici.
In una piccola percentuale di casi la presentazione del tumore si associa a segni e sintomi suggestivi di invasione delle strutture profonde deI collo e del mediastino (disfagia, dispnea, disfonia), che lo studio ecografico non è in grado di visualizzare. Nell’impossibilità di escludere masse mediastiniche o l’estensione sotto-giugulare di tumori di grandi dimensioni, è necessario completare lo studio ecografico con RM e/o TC del collo e del mediastino, ricordando che, una volta utilizzato il mezzo di contrasto iodato per la TC, l’eventuale trattamento con 131I non può avvenire prima di 1-3 mesi, in rapporto alle caratteristiche del contrasto. Se sono presenti segni e/o sintomi di invasione delle vie aeree, è necessario programmare una broncoscopia e/o una esofagoscopia preliminare.
Nella maggior parte dei casi di neoplasia tiroidea differenziata non è necessario lo screening pre-operatorio per l’esclusione di metastasi a distanza.
Il dosaggio sierico di Tg e TgAb non è utile, poiché valori elevati di Tg sono più frequenti in caso di gozzo voluminoso e/o iperfunzionante piuttosto che in caso di neoplasia. Al contrario, il dosaggio della CT pre-operatoria è utile per escludere la presenza di un MTC nei noduli sospetti o nei gozzi multi-nodulari.
R 13a. È sempre raccomandata l’esecuzione di ecografia cervicale pre-operatoria da parte di un operatore esperto nell’ecografia del collo e che appartenga alla struttura dove il paziente sarà operato.
R 13b. I linfonodi sospetti devono essere sottoposti ad FNA con dosaggio della Tg sul liquido di lavaggio.
R 13c. Nei pazienti che mostrano segni e/o sintomi sospetti per carcinoma localmente avanzato, è raccomandato il completamento dello staging pre-operatorio con l’esecuzione di TC o RM.
R 13d. Non è raccomandato il dosaggio routinario di Tg e TgAb sierici.
R 13e. Si suggerisce il dosaggio della CT in tutti i pazienti che devono essere operati.
11.2. Sorveglianza attiva del micro-carcinoma papillare
Sono disponibili in letteratura evidenze secondo cui il PTMC ha progressione lenta e prognosi quoad vitam eccellente. Comunque, un sottogruppo di tali tumori presenta una progressione clinica, caratterizzata da incremento progressivo delle dimensioni e comparsa di secondarismi locali, anche se sono comunque rare le metastasi a distanza.
I mezzi diagnostici di routine (compreso lo studio molecolare) al momento non sono in grado di distinguere con certezza il sottogruppo di PTMC a rischio di progressione clinica dalla maggior parte dei micro-carcinomi indolenti. Caratteristiche che aumentano il rischio di aggressività del PTMC sono:
- pregressa irradiazione del collo;
- evidenza ecografica di probabile estensione extra-capsulare e/o multi-focalità;
- localizzazione posteriore o sotto-capsulare;
- aspetti citologici aggressivi e mutazione di BRAF e TERT.
Il rischio di aggressività locale inoltre aumenta con l’aumentare delle dimensioni della lesione.
Pertanto, qualora il PTMC non sia avviato all’intervento chirurgico per l’età avanzata o la presenza di comorbilità, è necessaria una “sorveglianza attiva” con esecuzione di un accurato esame ecografico del collo da parte di un operatore esperto ogni sei mesi per i primi due anni. Successivamente, in caso di stabilità, il controllo potrà essere eseguito annualmente. In ogni controllo clinico sarà necessaria rivalutazione con il paziente della strategia terapeutica alla luce dei risultati del controllo ecografico.
R 14a. Il trattamento di scelta del PTMC è la lobo-istmectomia (in assenza di patologia contro-laterale o di estensione extra-tiroidea).
R 14b. In caso di PTMC a basso rischio può essere considerato un intervento non immediato nei pazienti ad alto rischio chirurgico per comorbilità internistiche o nei pazienti che rifiutino l’intervento.
R 14c. Si raccomanda un’attenta e approfondita discussione con il paziente circa i possibili vantaggi e svantaggi della sorveglianza attiva vs l’exeresi chirurgia della lesione.
R 14d. Si raccomanda sempre, prima della decisione terapeutica, la ripetizione di un accurato esame ecografico volto all’esclusione di possibili coinvolgimenti linfonodali e/o di estensione extra-tiroidea del tumore.
R 14e. Nei primi due anni di “sorveglianza” è obbligatorio l’esame ecografico accurato del collo ogni 6 mesi, da effettuare poi con modalità annuale in caso di stabilità della lesione.
11.3. Indicazione all’intervento di completamento dopo la lobo-istmectomia
La lobo-istmectomia è l’intervento chirurgico iniziale appropriato per molti casi di carcinoma della tiroide. Mentre non vi sono dubbi nel caso del PTMC, nelle altre situazioni è opportuna un’attenta valutazione da parte del team multi-disciplinare, finalizzata alla valutazione nello specifico paziente dei vantaggi di una lobo-istmectomia (seguita eventualmente dall’intervento di completamento) vs la tiroidectomia iniziale. La valutazione multi-disciplinare aiuta a definire meglio il corretto approccio chirurgico alla luce degli alti rischi di complicanze in caso di re-intervento, specialmente in centri non ad alto volume di patologia chirurgica.
R 15a. L’intervento di completamento dopo lobo-istmectomia è di regola raccomandato nei carcinomi differenziati > 4 cm e in tutti i casi in cui sono dimostrati istologicamente estensione extra-capsulare, interessamento linfonodale o presenza di variante istologica aggressiva.
R 15b. In tutti gli altri casi l’eventuale l’intervento di completamento deve essere discusso dal team multi-disciplinare con il paziente sulla base dei dati clinici.
R 15c. L’intervento di completamento non è indicato in caso di istologia deponente per NIFT-P.
11.4. La dissezione linfonodale dei compartimenti cervicali centrali e laterali
In passato la dissezione profilattica del compartimento cervicale centrale era proposta come trattamento inziale in associazione alla tiroidectomia totale, indipendentemente dall’aggressività del carcinoma. Molto controverso è al momento il suo ruolo. Essa potrebbe fornire alcuni vantaggi:
- eliminare possibili fonti di recidive della neoplasia e ridurre il rischio collegato a possibili re-interventi;
- aumentare l’accuratezza della stadiazione in previsione di terapia con 131I;
- migliorare l’accuratezza del ruolo diagnostico della Tg nel follow-up.
Dati derivanti da revisioni sistematiche di studi di confronto tra pazienti trattati profilatticamente e non, hanno evidenziato un ruolo clinico solo marginale delle possibili metastasi occulte nei linfonodi del compartimento centrale. Inoltre, la linfadenectomia del compartimento centrale aumenta sensibilmente il rischio di ipoparatiroidismo permanente e di danno ricorrenziale.
R 16a. La dissezione profilattica del compartimento centrale del collo non è indicata routinariamente nei carcinomi differenziati tiroidei.
R 16b. La dissezione è appropriata solo con l’evidenza clinica o ecografica di interessamento linfonodale (cN1), sia del compartimento centrale sia di quello laterale.
R 16c. Il giudizio del chirurgo in sede intra-operatoria può determinare la decisione dello svuotamento del compartimento centrale.
12. GESTIONE NON CHIRURGICA DELLA PATOLOGIA NODULARE DELLA TIROIDE
Nella maggior parte delle condizioni in cui, dopo un inquadramento clinico, ecografico e laboratoristico iniziale, non ci sono le indicazioni chirurgiche, il paziente viene avviato al follow-up clinico ed ecografico. Non è consigliato l’uso della terapia soppressiva con levo-tiroxina, in considerazione della scarsa risposta dimensionale dei noduli (una metanalisi del 2005 riporta un NNT di 8, esprimente la necessità di trattare almeno 8 noduli per avere una riduzione del 50% del volume in uno solo di essi) e dell’elevato rischio di effetti collaterali cardiaci (cardiopatia ipertrofica/aritmie) e ossei (aumentato rischio di osteoporosi) dopo trattamento prolungato.
Nei noduli benigni sintomatici di grandi dimensioni possono essere impiegati trattamenti alternativi alla chirurgia, nel caso il paziente non voglia operarsi o siano presenti comorbilità che controindicano parzialmente o totalmente l’intervento chirurgico.
Di questi, l’alcoolizzazione ha un ruolo accettato universalmente per i noduli con ampia componente liquida, che risultino citologicamente benigni ma recidivino dopo drenaggio.
L’ablazione percutanea dei noduli solidi con ipertermia (laser o radiofrequenza) consente di modificare la storia naturale dei noduli in accrescimento, che diventino cosmeticamente rilevanti o causa di sintomi locali. Tali metodiche dovrebbero essere in genere impiegate non come alternative alla chirurgia per lesioni di grandi dimensioni, ma come mezzo di prevenzione della chirurgia per i noduli che progressivamente aumentano di volume nel corso di controlli seriati nel tempo. È necessario eseguire un doppio controllo citologico con risultato benigno prima del trattamento ablativo. La procedura è in genere ben tollerata ed è eseguibile ambulatorialmente o in day-hospital. È, tuttavia, necessaria un’esperienza specifica degli operatori.
La terapia radiometabolica con Iodio-131 rappresenta in molti casi (con l’esclusione della gravidanza, della contaminazione iodica o dell’età infantile) la terapia di scelta dei noduli iperfunzionanti. Il quadro clinico complessivo può in questi casi suggerire la scelta chirurgica (gozzi iperfunzionanti voluminosi) o la gestione medica con terapia tireostatica. Più limitato è l’impiego nei voluminosi gozzi “freddi”, da utilizzare solo quando la chirurgia è controindicata.
Follow-up clinico ecografico
R 17a. La valutazione clinica ed ecografica di un nodulo tiroideo citologicamente benigno deve essere programmata inizialmente entro 6-12 mesi e successivamente, in caso di stabilità dimensionale e clinica, ogni 12-24 mesi.
R 17b. Si raccomanda la rivalutazione citologica in tutti i casi in cui si verifichi un aumento significativo delle dimensioni del nodulo e/o modifiche dell’aspetto ecografico, con comparsa di caratteristiche sospette per malignità.
R 17c. Si suggerisce una rivalutazione della funzione tiroidea in caso il paziente mostri la comparsa di sintomatologia suggestiva di ipo- o iper-funzione.
Terapia con L-T4
R 18a. La terapia TSH-soppressiva con levo-tiroxina (L-T4) non è raccomandata. In aree a carenza iodica, la supplementazione di iodio e/o la terapia non soppressiva con L-T4 possono essere prese in considerazione nei giovani con gozzo nodulare di piccole dimensioni e livelli di TSH normali-alti.
R 18b. Nei giovani con ipotiroidismo subclinico da tiroidite autoimmune e concomitante presenza di patologia nodulare è raccomandata la terapia sostitutiva con L-T4.
R 18c. La terapia con L-T4 non è raccomandata per prevenire la recidiva nodulare dopo lobectomia, quando il TSH sierico è già nell’ambito della norma.
Alcolizzazione percutanea (PEI)
R 19a. La PEI è una terapia sicura ed efficace per le cisti tiroidee e i noduli complessi con ampia componente fluida.
R 19b. Si raccomanda di eseguire preliminarmente un attento campionamento della componente solida della lesione.
R 19c. La PEI è la terapia di prima linea per le lesioni cistiche benigne recidivanti, mentre non è raccomandata per i noduli solidi, siano essi iperfunzionanti o no, e i gozzi multi-nodulari.
R 19d. La PEI può essere presa in considerazione per i noduli caldi determinanti sintomi compressivi, solo quando non siano accessibili altre modalità di trattamento.
Termoablazione
R 20a. Considerare l’ablazione, con laser o radio-frequenza, dei noduli tiroidei solidi o complessi in crescita progressiva, sintomatici o responsabili di disagio estetico, previa ripetuta conferma citologica di benignità.
R 20b. L’ablazione dei noduli con ultrasuoni focalizzati al momento non dispone delle evidenze sufficienti per prevederne un uso clinico routinario.
Terapia con radioiodio
R 21a. Considerare la terapia con radioiodio per il gozzo tossico e/o sintomatico, specialmente per pazienti con pregressa chirurgia tiroidea o a rischio chirurgico e in quelli che rifiutano la chirurgia.
R 21b. Prima della terapia con radioiodio, eseguire la FNA sui noduli freddi eventualmente coesistenti.
R 22c. Evitare l’uso di mezzi di contrasto o sostanze contenenti iodio e sospendere, se possibile, i farmaci anti-tiroidei 4-7 giorni prima della terapia con radioiodio, tornando ad assumerli una settimana dopo.
R 22d. Il radioiodio è controindicato nelle donne in gravidanza e allattamento. Nelle donne in età fertile deve sempre essere eseguito un test di gravidanza prima della terapia.
R 22e. Si raccomanda il regolare monitoraggio della funzione tiroidea dopo la terapia con radioiodio.
R 22f. Ripetere la terapia dopo 3-6 mesi in caso di ipertiroidismo persistente o recidivante o di inadeguata riduzione volumetrica.
13. IL REFERTO ISTOLOGICO UTILIZZATO PER I TUMORI DELLA TIROIDE
Esame macroscopico
Tiroide:
- peso (grandezza);
- multi-nodularità/uni-nodularità;
- aspetto macroscopico del nodulo:
- sede:
- lobo destro;
- lobo sinistro;
- istmo;
- lobo piramidale;
- diametro;
- colore;
- degenerazione cistico-emorragica;
- presenza/assenza della capsula;
- distanza dalla capsula e descrizione dei margini chirurgici;
- descrizione dei margini (espansivi/infiltrativi);
- omogeneo/eterogeneo;
- solido/colloideo;
- presenza di calcificazioni.
- sede:
Linfonodi:
- sede;
- grandezza;
- aspetto macroscopico del linfonodo maggiore.
Esame microscopico
Nodulo tiroideo:
- capsula (presente/assente);
- struttura (colloidea/sclerotica/solida);
- istotipo:
- NIFT-P;
- papillare:
- variante classica;
- variante follicolare;
- varianti aggressive:
- “hobnail”;
- “tall cells” (> 10% delle cellule esaminate);
- solida (esprimere la percentuale);
- colonnare (> 10% delle cellule esaminate);
- diffusamente sclerosante.
- follicolare:
- minimamente invasivo;
- ampiamente invasivo;
- oncocitico;
- scarsamente differenziato (insulare);
- midollare;
- anaplastico;
- linfoma tiroideo;
- metastasi;
- invasione:
- capsulare (capsula nodulo);
- vascolare (numero di vasi: 4 o più);
- extra-capsulare minima;
- extra-tiroidea:
- tessuti molli;
- laringe;
- trachea;
- esofago;
- nervo ricorrente;
- fascia pre-vertebrale;
- muscoli del collo;
- grossi vasi;
- immuno-istochimica e analisi molecolare (se necessari e se effettuati).
Linfonodi:
- numero totale;
- numero di linfonodi metastatici;
- misura dell’area metastatica più grande all’interno del linfonodo:
- micro-metastasi (< 2 mm);
- macro-metastasi;
- presenza di invasione extra-nodale.
- Gharib H, Papini E, Garber JR, et al, on behalf of the AACE/ACE/AME Task Force on Thyroid Nodules. American Association of Clinical Endocrinologists, American College of Endocrinology, and Associazione Medici Endocrinologi medical guidelines for clinical practice for the diagnosis and management of thyroid nodules. Endocr Pract 2016, 22 suppl 1: 1-60.
- Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2016, 26: 1-133.
- Nardi F, Basolo F, Crescenzi A, et al. Italian Consensus for the classification and reporting of thyroid citology. J Endocrinol Invest 2014, 37: 593-9.
- Frates MC, Benson CB, Charboneau JW, et al. Management of thyroid nodules detected at US: Society of Radiologists in Ultrasound consensus conference statement. Radiology 2005, 237: 794-800.
- Pacini F, Basolo F, Bellantone R, et al. Italian consensus on diagnosis and treatment of differentiated thyroid cancer: joint statements of six Italian societies. J Endocrinol Invest 2018, 41: 849-76.
- Persichetti A, Di Stasio E, Guglielmi R, et al. Predictive value of malignancy of thyroid nodule ultrasound classification systems. A prospective study. J Clin Endocrinol Metab 2018, 103: 1359-68.
Abbreviazioni usate nel documento
AACE = American Association of Clinical Endocrinologists
ACE = American College of Endocrinology
ATA = American Thyroid Association
BEL = best evidence level (miglior livello di evidenza)
CNB = core needle biopsy
CT = calcitonina
18FDG-PET= [18F]fluorodeoxyglucose Positron Emission Tomography
FNA = Fine-Needle Aspiration (aspirazione con ago sottile)
GLP-1 = glucagon-like peptide 1
LG = linee guida
MEN-2 = Multiple Endocrine Neoplasia type 2
MTC = Medullary Thyroid Cancer (carcinoma midollare tiroideo)
NET = NeuroEndocrine Tumor (tumore neuroendocrino)
NIFT-P = non-invasive follicular thyroid neoplasms with papillary-like nuclear features
PEI = Percutaneous Ethanol Injection (alcolizzazione percutanea)
PTMC = micro-carcinoma papillare tiroideo
TC = tomografia computerizzata
Tg = tireoglobulina
TgAb = anticorpi anti-tireoglobulina
TRAb = anticorpi anti-recettore del TSH
TPOAb = anticorpi anti-perossidasi tiroidea
VIP = vasoactive intestinal peptide
Nodulo tiroideo in età pediatrica
Marco Cappa & Carla Bizzarri
Unità Operativa Complessa di Endocrinologia e Diabetologia, Dipartimento Pediatrico Universitario-Ospedaliero, Ospedale Pediatrico Bambino Gesù, IRCCS, Roma
Epidemiologia
I noduli tiroidei in età pediatrica ed adolescenziale sono globalmente rari, con una prevalenza stimata tra 0.05% e 1.8%. Essi risultano però maligni in una percentuale significativamente maggiore rispetto all’età adulta (fino al 25% dei casi); di conseguenza, richiedono una valutazione attenta e un iter diagnostico più aggressivo di quello proposto di solito nell'adulto.
Ipotesi diagnostiche da considerare in caso di nodulo tiroideo in un bambino
- Carcinoma tiroideo differenziato
- Carcinoma midollare sporadico o familiare (isolato o nel contesto nella sindrome MEN 2A)
- Adenoma follicolare ("Gozzo uninodulare tossico" o non funzionante)
- Nodulo nel contesto di una tiroidite
- Cisti del dotto tireoglosso
- Cisti colloide
- Teratoma della tiroide (nel neonato)
- Incluso timico
La caratterizzazione clinica ed eziologica dei noduli tiroidei esorditi in età pediatrica manca di studi ampi e controllati e la maggior parte dei lavori si sono focalizzati sulle due patologie maligne più frequenti: i carcinomi differenziati (papillare e follicolare), mentre esistono pochi dati sugli altri istotipi.
L'irradiazione del collo (es. l'irradiazione a mantellina utilizzata nel linfoma di Hodgkin) predispone sia ai noduli benigni che al cancro della tiroide.
Il nodulo dolente ad insorgenza improvvisa deve far pensare alla tiroidite subacuta o acuta suppurativa o al sanguinamento intra-lesionale di una lesione cistica.
L'incluso timico all'interno della tiroide appare come una lesione nodulare. Esso è in genere un rilievo occasionale nei bambini sottoposti a ecografia del collo, non richiede di per sè alcun trattamento, nè un monitoraggio specifico, ma per la diagnosi differenziale è spesso rischiesto l'agoaspirato.
Il teratoma della tiroide è una lesione rara, di solito si riscontra nel neonato e ha un comportamento benigno, anche se sono stati segnalati foci di cellule maligne all'interno della lesione.
Tiroidite autoimmune e noduli tiroidei
I dati sull’incidenza di noduli tiroidei e cancro della tiroide nei pazienti con tiroidite autoimmune riguardano quasi esclusivamente l’età adulta, con una prevalenza riportata nei diversi studi variabile tra l’1% e il 30%. Uno studio recente (1) ha preso in esame la relazione tra tiroidite autoimmune, cancro e noduli tiroidei in un'ampia casistica pediatrica. La presenza di noduli tiroidei veniva riscontrata in 115 su 365 patienti con tiroidite autoimmune (31.5%): 69 soggetti (60%) presentavano un nodulo solitario e 46 soggetti (40%) avevano noduli multipli, 38 noduli erano palpabili (33%). Undici casi di carcinoma papillare venivano diagnosticati mediante esame istologico, dopo aver eseguito la tiroidectomia totale, 5 di essi erano associati a metastasi linfonodali. Otto pazienti presentavano un cancro multifocale e 3 pazienti un cancro unifocale. La prevalenza del sesso maschile era significativamente più elevata nei pazienti con cancro, rispetto a quelli con tiroidite autoimmune (odds ratio: 2.95). Il rilievo di linfoadenopatia ed incremento del volume nodulare in corso di terapia con levotiroxina era significamente più frequente nei pazienti con cancro della tiroide, rispetto ai pazienti con una lesione benigna. La multinodularità all'ecografia era significativamente più frequente dell'uninodularità nei pazienti con cancro.
Diagnosi
Le indagini di primo livello sono le stesse proposte nell’età adulta (TSH, FT4, Ab anti-tireoperossidasi, Ab anti-tireoglobulina, ecocolordoppler della ghiandola tiroidea). Anche i criteri anamnestici, clinici ed ecografici di sospetta malignità sono sostanzialmente simili (tabella).
| Fattori di rischio per malignità del nodulo tiroideo | |
| Anamnestici | Accrescimento rapido del volume nodulare Pregressa esposizione del collo a radiazioni Età < 6 anni Storia familiare positiva per carcinoma midollare o per MEN |
| Clinici | Nodulo solitario Linfoadenomegalia associata Consistenza dura Aderenza ai tessuti circostanti |
Un nodulo tiroideo in un bambino va sempre sottoposto ad ago-aspirato anche se non è ancora stata definita la dimensione minima che renda tecnicamente possibile l’esame. Ci si attiene in generale alle stesse indicazioni/linee guida proposte per l’età adulta. In caso di bambini piccoli o comunque non collaboranti può essere necessario effettuare l’esame in sedazione.
La scintigrafia tiroidea è invece scarsamente utilizzata, in quanto noduli benigni possono non concentrare il radioisotopo (essere cioè freddi), mentre alcuni carcinomi papilliferi possono risultare ipercaptanti (caldi)(2,3).
Bibliografia essenziale
- Corrias A, Cassio A, Weber G, et al. Thyroid nodules and cancer in children and adolescents affected by autoimmune thyroiditis.Arch Pediatr Adolesc Med 2008, 162: 526–31.
- Tfayli HM, Teot LA, Indyk JA, Witchel SF. Papillary thyroid carcinoma in an autonomous hyperfunctioning thyroid nodule: case report and review of the literature. Thyroid 2010, 20: 1029-32.
- Damle N, Gupta S, Kumar P, Mathur S, Bal C. Papillary carcinoma masquerading as clinically toxic adenoma in very young children. J Pediatr Endocrinol Metab 2011, 24: 1051-4.
La terapia soppressiva con ormone tiroideo per la patologia nodulare benigna
Enrico Papini, Roberta Rinaldi, Lucilla Petrucci, Irene Misischi
UOC di Endocrinologia e Malattie Metaboliche, Ospedale Regina Apostolorum Albano Laziale, Roma
La gestione clinica dei noduli della tiroide è guidata dai risultati della ecografia e/o dell’esame citologico per aspirazione. La maggior parte dei noduli non mostra caratteri di sospetto e, in assenza di sintomi compressivi locali o di iperfunzione tiroidea, può essere seguita regolarmente nel tempo senza interventi terapeutici (1-2). Tuttavia, anche se molti noduli e gozzi rimangono sostanzialmente stabili nel tempo, una parte di essi mostra crescita progressiva ed è causa di preoccupazione o fastidio locale per i pazienti. E’ nozione comune che maggiore è l’età del paziente e la durata del gozzo e più rilevanti sono le dimensioni che esso raggiunge (3-5). La tendenza all’accrescimento, inoltre, è più marcata nelle donne pluripare e appare attenuarsi con la menopausa (6).
Nei modelli animali e nell’uomo l'assenza protratta di secrezione del TSH è seguita da graduale ipotrofia della tiroide (7). Il TSH, inoltre, è un fattore necessario per lo sviluppo del gozzo secondario a deficit di iodio o a tiroidite di Hashimoto. Al contrario, i noduli solitari, in ghiandole normali, in assenza di deficit iodico o di autoimmunità tiroidea, sono probabilmente espressione di proliferazione clonale o dell’intervento di fattori di crescita indipendenti dal TSH (8). Sulla base delle osservazioni cliniche e dei presupposti fisiopatologici è stata proposta e ampiamente utilizzata, a partire dalla metà del secolo scorso, la “terapia soppressiva” con ormone tiroideo per la patologia nodulare tiroidea (9).
Noduli tiroidei solitari
I dati presenti in letteratura sui noduli non iperfunzionanti sono controversi (10). Numerosi trial clinici non randomizzati (11-13) avevano dimostrato la riduzione del volume dei noduli tiroidei dopo terapia con ormone tiroideo ma, nel 1987, un trial clinico randomizzato nordamericano ha escluso l’efficacia della terapia soppressiva con levotiroxina nei noduli tiroidei solitari (14). Fra il 1989 e il 1999 altri tre trial clinici randomizzati hanno confermato l’assenza di efficacia della terapia soppressiva nei noduli solitari della tiroide (15-17). E’ tuttavia necessario ricordare i limiti di questi trial: il cut-off per un decremento clinicamente significativo era posto al 50% del volume iniziale, la durata dei trial era breve, il numero dei pazienti era ridotto e in alcuni studi erano presenti evidenti limiti metodologici.
Tre successivi trial randomizzati di 12, 12 e 18 mesi, condotti in aree con deficit iodico borderline (18-20) hanno al contrario mostrato una riduzione clinicamente significativa. Un decremento del volume pari al 50% si osservava solo in una parte dei pazienti trattati (17–39%), ma la riduzione media nel gruppo in trattamento attivo risultava statisticamente significativa rispetto al gruppo di controllo, che era caratterizzato da una moderata tendenza all’accrescimento. Risultava evidente un'eterogeneità nella risposta alla terapia soppressiva, che è apparsa correlabile ad alcuni caratteri iniziali: noduli con maggior diametro < 1.7 cm (volume < 2.4 mL), noduli con componenti degenerative e senza caratteri fibrotici e presenza di abbondante colloide all’esame citologico (21).
Il solo studio prospettico randomizzato di lunga durata (cinque anni) ha confermato che la terapia soppressiva è in grado di ridurre il volume dei noduli tiroidei solo in una parte dei casi trattati (22). Il gruppo trattato, tuttavia, mostrava dopo cinque anni un'efficace prevenzione dell’incremento di volume sia dei noduli sia della ghiandola nel suo complesso e la comparsa meno frequente di nuovi noduli rispetto al gruppo in trattamento con placebo (22).
E’ interessante rilevare che in uno studio di un anno su pazienti randomizzati a una terapia pienamente (TSH < 0.01 mU/L) o parzialmente soppressiva (TSH 0.4-0.6 mU/L) la riduzione del volume nodulare non mostrava differenze statisticamente significative (36 vs 45%) (23). La sospensione della terapia era, in questo come in altri trial, seguita dalla ripresa dell’accrescimento.
Nel 1998, 2001 e 2005 sono state effettuate tre successive meta-analisi (comprendenti 7, 6 e 9 trials) (24-26). L’ultima di esse, condotta soltanto sui trial caratterizzati da maggior rigore metodologico, ha dimostrato che la terapia soppressiva è statisticamente più efficace del placebo nell’indurre una riduzione del volume dei noduli > 50% (26). Veniva inoltre confermato che solo una parte dei pazienti trattati (15% circa) appare pienamente responsiva alla soppressione del TSH e che la sospensione della terapia è seguita dalla ripresa dell’accrescimento.
Gozzo normofunzionante
Sette trial non randomizzati hanno mostrato una riduzione del volume del gozzo nel 60% dei casi trattati (11). La riduzione appariva più probabile nei soggetti più giovani, con gozzo diffuso, di entità moderata e più recente insorgenza.
Due studi prospettici randomizzati in pazienti con gozzo non tossico hanno confermato una riduzione clinicamente significativa del volume ghiandolare (determinato ecograficamente) nel 48% e, rispettivamente, nel 58% dei pazienti trattati con levotiroxina (27,28).
La terapia soppressiva appare particolarmente efficace nel ridurre le dimensioni del gozzo e la tendenza all’accrescimento nel tempo nei pazienti con tiroidite di Hashimoto, anche se ancora eutiroidei (29).
Effetti collaterali della terapia soppressiva
La condizione di ipertiroidismo subclinico, sia endogeno che iatrogeno, appare associata nelle donne in post-menopausa (ma non in quelle in pre-menopausa) a un decremento della densità ossea (30).
Nei pazienti anziani con livelli di TSH soppresso la prevalenza di fibrillazione atriale appare aumentata di tre volte rispetto ai soggetti eutiroidei, anche se la mortalità cardiovascolare non è significativamente accresciuta (31). Nei soggetti con protratto ipertiroidismo subclinico (come in caso di terapia soppressiva a lungo termine per carcinoma tiroideo) sono, inoltre, evidenziabili alterazioni del ritmo e della struttura cardiaca di rilievo ecocardiografico (32).
Gli effetti sfavorevoli della terapia soppressiva protratta sono ben documentati. Nel corso degli ultimi anni, tuttavia, alcune osservazioni retrospettive su ampie casistiche di pazienti con patologia nodulare hanno suggerito un possibile ruolo protettivo dei bassi livelli di TSH nei confronti dell'insorgenza del carcinoma differenziato tiroideo (33). Questo dato, che potrebbe essere correlabile con la minore insorgenza di nuove lesioni tiroidee dimostrata nei pazienti in terapia soppressiva (22), necessita di ulteriore conferma.
Suggerimenti per la pratica clinica
La terapia soppressiva con ormone tiroideo ha efficacia soltanto parziale nel ridurre il volume dei noduli tiroidei citologicamente benigni. Essa tuttavia appare rallentare la crescita del gozzo nodulare non iperfunzionante e la comparsa di ulteriori lesioni tiroidee. Poiché la cessazione della terapia è seguita dalla ripresa della storia naturale della malattia, il trattamento dovrebbe essere condotto per periodi di tempo molto lunghi. Una condizione di ipertiroidismo subclinico così protratta appare associarsi a effetti collaterali rilevanti, particolarmente importanti nelle donne in post-menopausa e nei soggetti di età avanzata (34).
Sulla base di queste considerazioni, possono essere formulati i seguenti suggerimenti:
- il trattamento con ormoni tiroidei non dovrebbe essere impiegato di routine nella patologia nodulare tiroidea
- dovrebbe comunque essere condotto a dosi semi-soppressive (portando i livelli di TSH ai limiti inferiori della normalità)
- deve essere preso in considerazione in soggetti giovani, con noduli tiroidei < 2 cm, soprattutto se associati a iperplasia tiroidea diffusa e se viventi in aree a bassa endemia gozzigena
- in aree di endemia gozzigena deve essere sempre condotta una parallela supplementazione con iodio (150 µg/die), soprattutto nei soggetti giovani con gozzo nodulare senza note di autonomia funzionale
- la presenza di autonomia funzionale tiroidea deve essere sempre esclusa in via preliminare con il dosaggio del TSH
- non vi è indicazione al trattamento con ormone tiroideo nei noduli voluminosi (> 3 cm) e nei gozzi di grandi dimensioni e di lunga durata
- la terapia soppressiva è controindicata nelle donne in postmenopausa, negli uomini di età superiore a 60 anni e in presenza di comorbilità internistiche, malattie cardiovascolari e osteoporosi
- nei soggetti con noduli benigni in accrescimento o sintomatici che non sono candidati alla terapia soppressiva deve essere considerato il ricorso alla chirurgia o a procedure terapeutiche non chirurgiche, quali la sclerosi percutanea con etanolo, l’ablazione con ipertermia o il trattamento con radioiodio (7,34).
Bibliografia
- Gharib H, Papini E, Paschke R et al. AACE/AME/ETA Medical Guidelines for clinical practice for the diagnosis and management of thyroid nodules. J Endocrinol Invest 2010, 33 (Suppl to no. 5): 1–50.
- American Thyroid Association (ATA) Guidelines Taskforce on Thyroid Nodules and Differentiated Thyroid Cancer, Cooper DS, Doherty GM, et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2009, 19: 1167.
- Hegedus L, Bonnema SJ, Bennedbaek FN. Management of simple nodular goiter: current status and future perspectives. Endocr Rev 2003, 24: 102-32.
- Berghout A, Wiersinga WM, Smits NJ, et al. Interrelationships between age, thyroid volume, thyroid nodularity, and thyroid function in patients with sporadic nontoxic goiter. Am J Med 1990, 89: 602.
- Elte JW, Bussemaker JK, Haak A. The natural history of euthyroid multinodular goitre. Postgrad Med J 1990, 66: 186-90.
- Costante G, Crocetti U, Schifino E, et al. Slow growth of benign thyroid nodules after menopause: no need for long-term suppressive therapy in post-menopausal women. J Endocrinol Invest 2004, 27: 31-6.
- Rienhoff WF Jr. Microscopic changes induced in thyroid gland by oral administration of desiccated thyroid. Arch Surg 1940, 41: 487.
- Studer H, Peter HJ, Gerber H. Natural heterogeneity of thyroid cells: the basis for understanding thyroid function and nodular goiter growth. Endocr Rev 1989, 10: 125.
- Greer Ma, Astwood Eb. Treatment of simple goiter with thyroid. J Clin Endocrinol Metab 1953, 13: 1312-31.
- Castro MR, Gharib H. Continuing controversies in the management of thyroid nodules. Ann Intern Med 2005, 142: 926-31.
- Ross DS. Thyroid hormone suppressive therapy of sporadic nontoxic goiter. Thyroid 1992, 2: 263-9.
- Mainini E, Martinelli I, Morandi G, et al. Levothyroxine suppressive therapy for solitary thyroid nodule. J Endocrinol Invest 1995, 18: 796.
- Lima N, Knobel M, Cavaliere H, et al. Levothyroxine suppressive therapy is partially effective in treating patients with benign, solid thyroid nodules and multinodular goiters. Thyroid 1997, 7: 691.
- Gharib H, James EM, Charboneau JW, et al. Suppressive therapy with levothyroxine for solitary thyroid nodules. A double-blind controlled clinical study. N Engl J Med 1987, 317: 70.
- Cheung PS, Lee JM, Boey JH. Thyroxine suppressive therapy of benign solitary thyroid nodules: a prospective randomized study. World J Surg 1989, 13: 818.
- Reverter JL, Lucas A, Salinas I, et al. Suppressive therapy with levothyroxine for solitary thyroid nodules. Clin Endocrinol (Oxf) 1992, 36: 25.
- Pajouhi M, Bastanhagh MH, et al. Evaluation of suppressive therapy for cold thyroid nodules with levothyroxine: double-blind placebo-controlled clinical trial. Endocr Pract 1999, 5: 251.
- La Rosa GL, Lupo L, Giuffrida D, et al. Levothyroxine and potassium iodide are both effective in treating benign solitary solid cold nodules of the thyroid. Ann Intern Med 1995, 122: 1.
- Wémeau JL, Caron P, Schvartz C, et al. Effects of thyroid-stimulating hormone suppression with levothyroxine in reducing the volume of solitary thyroid nodules and improving extranodular nonpalpable changes: a randomized, double-blind, placebo-controlled trial by the French Thyroid Research Group. J Clin Endocrinol Metab 2002, 87: 4928-34.
- Papini E, Bacci V, Panunzi C et al. A prospective randomized trial of levothyroxine suppressive therapy for solitary thyroid nodules. Clin Endocrinol (Oxf) 1993, 38: 507-13.
- La Rosa GL, Ippolito AM, Lupo L, et al. Cold thyroid nodule reduction with L-thyroxine can be predicted by initial nodule volume and cytological characteristics. J Clin Endocrinol Metab 1996, 81: 4385.
- Papini E, Petrucci L, Guglielmi R, et al. Long-term changes in nodular goiter: a 5-year prospective randomized trial of levothyroxine suppressive therapy for benign cold thyroid nodules. J Clin Endocrinol Metab 1998, 83: 780.
- Koc M, Ersoz HO, Akpinar I, et al. Effect of low- and high-dose levothyroxine on thyroid nodule volume: a crossover placebo-controlled trial. Clin Endocrinol (Oxf) 2002, 57: 621.
- Zelmanovitz F, Genro S, Gross JL. Suppressive therapy with levothyroxine for solitary thyroid nodules: a double-blind controlled clinical study and cumulative meta-analyses. J Clin Endocrinol Metab 1998, 83: 3881.
- Castro MR, Caraballo PJ, Morris JC. Effectiveness of thyroid hormone suppressive therapy in benign solitary thyroid nodules: a meta-analysis. J Clin Endocrinol Metab 2002, 87: 4154.
- Sdano MT, Falciglia M, Welge JA, et al. Efficacy of thyroid hormone suppression for benign thyroid nodules: meta-analysis of randomized trials. Otolaryngol Head Neck Surg 2005, 133: 391.
- Berghout A, Wiersinga WM, Drexhage HA, et al. Comparison of placebo with L-thyroxine alone or with carbimazole for treatment of sporadic non-toxic goitre. Lancet 1990, 336: 193.
- Badillo J, Shimaoka K, Lessman Em, et al. Treatment of nontoxic goiter with sodium liothyronine. A double-blind study. JAMA 1963, 184: 29.
- Svensson J, Ericsson UB, Nilsson P, et al. Levothyroxine treatment reduces thyroid size in children and adolescents with chronic autoimmune thyroiditis. J Clin Endocrinol Metab 2006, 91: 1729.
- Schneider R, Reiners C. The effect of levothyroxine therapy on bone mineral density: a systematic review of the literature. Exp Clin Endocrinol Diabetes 2003, 111: 455-70.
- Parle JV, Maisonneuve P, Sheppard MC, et al. Prediction of all-cause mortality in elderly people from one low serum thyrotropin result: a 10-year cohort study. Lancet 2001, 358: 861-5.
- Biondi B, Palmieri EA, Filetti S, et al. Mortality in elderly patients with subclinical hyperthyroidism. Lancet 2002, 359: 799-800.
- Fiore E, Rago T, Provenzale MA, et al. L-thyroxine-treated patients with nodular goiter have lower serum TSH and lower frequency of papillary thyroid cancer: results of a cross-sectional study on 27 914 patients. Endocr Relat Cancer 2010, 17: 231.
- Gharib H, Papini E. Thyroid nodules: clinical importance, assessment and treatment. Endocrinol Metab Clin N Am 2007, 36: 707-35.
Terapia chirurgica per la patologia nodulare tiroidea
Scelta del tipo di trattamento chirurgico nella patologia nodulare tiroidea
Corrado Pedroni, Verter Barbieri
Divisione ORL, Arcispedale S. Maria Nuova, Reggio Emilia
La gestione clinica della patologia nodulare tiroidea prevede un'accurata valutazione ecografica, seguita da verifica citologica mediante agoaspirazione con ago sottile (FNAB).
L’indicazione all’intervento chirurgico nella patologia tiroidea è essenzialmente riservata ai seguenti casi:
- citologia indicativa o fortemente sospetta di neoplasia maligna tiroidea (Tir 4 - Tir 5)
- citologia indeterminata (nella maggior parte dei casi corrispondente alla lesione follicolare (Tir 3)
- noduli con citologia benigna o non diagnostica (Tir 1-2) con caratteristiche clinico-ecografiche di sospetto o in pazienti con aumentato rischio di malignità (pregressa radioterapia cervicale, familiarità per neoplasia tiroidea)
- noduli con citologia benigna o non diagnostica, associati a sintomi di compressione della via aero-digestiva e/o problemi cosmetici
- patologia nodulare associata a marcato ingrossamento dell’intera ghiandola o di un lobo tiroideo con affondamento in mediastino.
In linea generale, il paziente con evidenza citologica certa di malignità (Tir-5) riceve un’indicazione alla tiroidectomia totale, con linfoadenectomia del compartimento centrale. In caso di citologia sospetta (Tir-4), l’indicazione preferenziale è la lobectomia totale con istmectomia associata ad esame istologico intra-operatorio ed eventuale tiroidectomia totale di completamento e linfoadenectomia del compartimento centrale. Rimandiamo ai capitoli dedicati alla chirurgia del carcinoma tiroideo per una trattazione dettagliata di questi aspetti.
Il presente capitolo è incentrato sul trattamento chirurgico della patologia nodulare della tiroide caratterizzata da citologia dubbia per lesione indeterminata o follicolare (Tir-3), o da citologia benigna (Tir-2) ma con caratteristiche cliniche “a rischio”, o sintomi di tipo compressivo. In tali quadri, il trattamento chirurgico standard è rappresentato dalla lobectomia tiroidea totale con istmectomia, che rappresenta l’intervento chirurgico basilare, con l’unica eccezione del nodulo istmico solitario, trattabile con la semplice istmectomia tiroidea. Non trovano indicazione le varianti limitative dell’intervento di lobectomia totale, come l’enucleazione, l’enucleo-resezione e la lobectomia parziale.
La filosofia concettuale della lobectomia totale con istmectomia (o lobo-istmectomia) poggia sulla radicalità dell’intervento dal lato operato e sulla conservazione dell’integrità anatomica dell’area tiroidea del lobo controlaterale, e di conseguenza dei nervi laringei e delle ghiandole paratiroidi di quel lato, mantenendo intatta la possibilità di eseguire una tiroidectomia totale di completamento senza alcun aumento del rischio di complicanze sulle strutture “nobili” suddette.
Il trattamento della neoformazione follicolare della tiroide (Tir-3) resta a tutt’oggi un argomento dibattuto e controverso. Sappiamo che il 15–30% dei noduli tiroidei solitari sono classificati alla FNAB come lesioni indeterminate o neoformazioni follicolari (1) e queste rappresentano il vero problema per il citologo: egli, infatti, non è in grado di distinguere, in questo gruppo di lesioni, le forme benigne (adenomi) da quelle maligne (carcinomi) per la morfologia cellulare assolutamente identica di entrambe le forme (2). A questa diagnosi citologica potranno corrispondere diversi quadri patologici: adenoma follicolare, carcinoma follicolare, variante follicolare di carcinoma papillare e anche adenoma e carcinoma a cellule di Hürthle (vedi capitolo sulla citologia tiroidea). Pertanto, i pazienti con reperto citologico di lesione indeterminata o neoformazione (proliferazione) follicolare (Tir-3) devono essere sottoposti a procedura chirurgica diagnostica, a meno che bassi livelli di TSH serico e la scintigrafia tiroidea non abbiano evidenziato un nodulo “caldo”, funzionalmente, perché in questa eventualità è altamente probabile la diagnosi di benignità (adenoma follicolare)(1, 3).
La valutazione citologica di una neoplasia follicolare resta un problema diagnostico insoluto per l’assenza di chiare atipie citologiche anche nel carcinoma follicolare ben differenziato, per il quale gli unici criteri diagnostici validi, l’angio-invasività e l’invasione della capsula, sono di tipo istopatologico ed architetturale e pertanto evidenziabili solo con l’esame istologico definitivo. Anche gli aspirati con reperto prevalente di cellule ossifile (di Hürthle) devono essere considerati alla stesso modo (4). Nel carcinoma papillare varietà follicolare, qualora non sia presente nessuna delle caratteristiche nucleari patognomoniche del carcinoma papillare varietà classica, si riproporrà la diagnosi citologica di neoformazione follicolare. Nella diagnostica differenziale pre-operatoria tra adenoma e carcinoma follicolare sono stati valutati diversi marcatori molecolari (es. Galectina-3, BRAF, RET/PTC, RAS, HBME-1, TTF-1, LEU-M1, hTERT (telomerase activity), Topoisomerasi-II alfa), ma, a tutt’oggi, il loro impiego clinico è ancora limitato (5-10). Le linee guida ATA del 2009 suggeriscono (con una raccomandazione di grado C) che nei pazienti con reperto citologico di lesione indeterminata alla FNA può essere preso in considerazione l’impiego dei marcatori molecolari per la scelta del trattamento (11).
Anche l’esame istologico al congelatore è difficilmente in grado di distinguere l’adenoma dal carcinoma follicolare. Infatti, la diagnosi al congelatore del carcinoma follicolare “minimamente invasivo” è quasi impossibile, sia per l’elevata differenziazione della neoplasia, che simula un adenoma, sia per la necessità di un esame completo ed accurato su più sezioni di tutta la capsula del nodulo, per evidenziare i caratteri su cui si basa interamente la diagnosi di malignità: l’invasione vascolare e capsulare. Gli stessi criteri diagnostici valgono per i carcinomi oncocitari o a cellule di Hürthle. Pertanto, la maggior parte degli Autori (12-15) è convinta che l’uso routinario dell’istologia intra-operatoria nei casi con reperto citologico di neoformazione follicolare sia inutile, perché fornisce risultati incerti e non conclusivi, rimandando la diagnosi ai preparati definitivi. Nella serie di 135 pazienti consecutivi con lesione follicolare della tiroide, operati presso il Johns Hopkins Hospital di Baltimora, l’istologia al congelatore ha mostrato uno scarso valore diagnostico, non fornendo informazioni utili aggiuntive nell’87% dei casi e fornendo risultati inaffidabili nel 5% (12). Altri Autori (16-18) sono invece convinti che l’istologia intra-operatoria al congelatore possa essere ancora utile nei noduli che presentano un reperto citologico indeterminato o dubbio. Per Kingston (16), nelle neoformazioni follicolari, se la lesione risulterà benigna all’esame di tre sezioni al congelatore, l’esame istologico definitivo rivelerà verosimilmente un adenoma o, al massimo, un carcinoma follicolare minimamente invasivo. Inoltre, l’istologia intra-operatoria al congelatore può essere utile nei casi con reperto citologico di neoplasia follicolare con alcuni dei caratteri nucleari del carcinoma papillare, in cui potrebbe consentire l’identificazione di una variante follicolare di carcinoma papillare.
La possibilità di determinare pre-operatoriamente o intra-operatoriamente la malignità nelle neoplasie follicolari rimane, pertanto, un problema clinico di difficile soluzione. Sappiamo, comunque, che circa il 20% delle lesioni indeterminate (neoplasie follicolari o a cellule di Hürthle) risulterà essere un carcinoma all’istologia definitiva (4, 13, 19-22) e che vi sono alcun caratteristiche cliniche che aumentano il rischio di malignità: un pregresso trattamento radiante sul collo, la familiarità per carcinoma della tiroide, le dimensioni della lesione (> 4 cm), l’età avanzata del paziente, il sesso maschile (23-26).
Nel 2007 la National Cancer Institute Thyroid Fine-Needle Aspiration State of the Science Conference ha proposto una nuova classificazione dei reperti citologici degli ago-aspirati tiroidei, il Bethesda System for Reporting Thyroid Cytopathology (27, 28), che prevede 6 categorie anziché 5, distinguendo, nell’ambito delle lesioni indeterminare o follicolari, la categoria delle “neoplasie follicolari o sospette tali”, che hanno una probabilità del 15-30% di essere maligne (4, 20, 28-30), dalla categoria delle “atipie o lesioni follicolari di significato indeterminato”, che presentano un rischio di malignità più basso, del 5-15% (27, 28). Nell’ambito delle neoplasie follicolari con esito istologico di malignità, la maggior parte sono carcinomi follicolari, ma una quota non trascurabile è rappresentata dalla variante follicolare del carcinoma papillare (4, 30, 31). Delle neoplasie a cellule di Hürthle, secondo la classificazione WHO varianti oncocitiche delle neoplasie follicolari (32), circa il 15-45% sono carcinomi (20, 33, 34).
Di fronte ad un riscontro citologico di neoplasia follicolare o a cellule di Hürthle, per la maggior parte degli Autori (13, 27, 28, 35, 36, 37) è indicato ricorrere alla lobo-istmectomia tiroidea come trattamento chirurgico iniziale. Questo significa che ci si dovrà basare sulla diagnosi istologica definitiva per il completamento del programma terapeutico: se risulterà un carcinoma follicolare con caratteristiche che pongono il paziente ad alto rischio, come una significativa invasione capsulare o angio-invasione, si programmerà la tiroidectomia di completamento in un secondo tempo (38, 39). Nei quadri citologici di neoformazione follicolare caratterizzati da sporadiche alterazioni nucleari, può essere utile il ricorso alla lobo-istmectomia con esame istologico intra-operatorio al congelatore, stante la possibilità di identificare in corso di intervento una variante follicolare di carcinoma papillare della tiroide (17, 18).
Alcuni Autori (26, 35, 41) ritengono che, sino a quando non si disporrà di metodi più affidabili per differenziare pre-operariamente le neoplasie follicolari benigne e maligne, il modo più ragionevole per guidare l’estensione dell’intervento chirurgico primario, minimizzando la necessità di reinterventi e, viceversa, di procedure chirurgiche non necessarie, possa essere l’utilizzo di alcuni fattori di rischio clinici (età avanzata del paziente, precedente esposizione alla radioterapia, dimensioni e rapida crescita del nodulo, sintomi compressivi) e citologici (lesione a cellule di Hürthle). Il gruppo del John Hopkins Hospital di Baltimora raccomanda la tiroidectomia totale in luogo della lobectomia tiroidea nelle neoformazioni a cellule di Hürthle superiori a 4 cm di diametro, poichè nel 65% dei casi esse corrisponderebbero a lesioni maligne (41). Carling et al alla Yale University consigliano la tiroidectomia totale ab inizio per le neoformazioni follicolari o a cellule di Hürthle quando il paziente è stato trattato in età giovanile con RT esterna sul collo (35). Per Tyler (26) l’età del paziente superiore a 50 anni è un fattore di rischio di malignità statisticamente significativo.
Le più recenti linee guida dell’ATA (11) e della NCCN (42) raccomandano:
- nei pazienti con nodulo solitario, con reperto citologico sospetto per neoplasia follicolare o a cellule di Hürthle (lesione indeterminata), con TSH alto o normale, che preferiscono un trattamento chirurgico conservativo: lobectomia tiroidea come approccio chirurgico iniziale (raccomandazione di grado C);
- nei pazienti con reperto citologico di lesione indeterminata con noduli voluminosi (> 4 cm) o familiarità per carcinoma tiroideo o sottoposti ad un pregresso trattamento radiante sul collo, per l’aumentato rischio di malignità: tiroidectomia totale (raccomandazione di grado A);
- nei pazienti che presentano noduli in entrambi i lobi e in quelli che preferiscono evitare un eventuale secondo intervento sul lobo controlaterale: tiroidectomia totale o quasi totale (raccomandazione di grado C).
Anche la diagnosi istologica definitiva di carcinoma follicolare può essere talora problematica nelle lesioni follicolari capsulate. Infatti, la distinzione tra adenoma follicolare e carcinoma follicolare minimamente invasivo è spesso difficile, perché, sebbene siano stati descritti i criteri di valutazione dell’invasione capsulare e vascolare, la loro applicazione e la diagnosi conseguente possono variare tra i patologi. La diagnosi di carcinoma follicolare minimamente invasivo può essere fatta sulla base della sola invasione capsulare, della sola invasione vascolare o di entrambe. Però la determinazione di queste caratteristiche non è sempre facile e può essere soggettiva. Otto patologi, 4 americani e 4 giapponesi, hanno rivisto 21 preparati istologici di lesione follicolare capsulata. Solo nel 62% dei casi si è raggiunto un accordo nelle distinzione tra lesione benigna e maligna e, addirittura, solo nel 10% dei casi vi era accordo completo nella diagnosi (43). Comunque, per la diagnosi di carcinoma follicolare minimamente invasivo è necessaria un’indagine completa della lesione follicolare capsulata, realizzata con almeno 10 sezioni istologiche che evidenzino la penetrazione microscopica completa della capsula o la presenza di alcuni foci di invasione vascolare (44-46). Per le lesioni follicolari caratterizzate da aspetti infiltrativi e angioinvasivi minimi, è stata anche proposta la denominazione di “tumori follicolari a potenziale maligno incerto”; per tali quadri viene comunque suggerito come prima opzione di trattamento chirurgico un approccio conservativo (lobectomia tiroidea)(47).
Sebbene alcuni Autori (48), sulla base dei dati di sopravvivenza globalmente eccellenti, raccomandino per tutti i pazienti con carcinoma follicolare minimamente invasivo il trattamento conservativo mediante lobo-istmectomia, senza tiroidectomia di completamento, altri (36, 49-54) sottolineano che non tutti i carcinomi follicolari minimamente invasivi hanno un decorso favorevole, in particolare quelli con presenza di invasione vascolare. Alla Mayo Clinic (54) hanno analizzato 72 pazienti con carcinoma follicolare della tiroide minimamente invasivo e hanno riscontrato, con un follow-up a 10 anni, che i carcinomi follicolari con sola invasione capsulare si comportavano come tumori benigni, con incidenza di metatasi a distanza e tassi di mortalità tumore-specifica intorno allo zero, indipendentemente dal trattamento primario. Invece, i carcinomi follicolari minimamente invasivi con invasione vascolare presentavano un tasso di mortalità tumore-specifica a 10 anni del 28% e una prevalenza di metastasi a distanza del 19%. D’Avanzo e Clark (49) hanno proposto di distinguere il carcinoma follicolare in:
- minimamente invasivo: solo invasione capsulare, a tutto spessore
- moderatamente invasivo: angio-invasione con o senza invasione capsulare
- ampiamente invasivo: invasione trans-capsulare.
Nella loro casistica di 132 pazienti operati per carcinoma follicolare, di cui 45 (37.8%) con tumore minimamente invasivo, 50 (42%) con tumore moderatamente invasivo e 24 (29%) ampiamente invasivo, la sopravvivenza a 10 anni era significativamente migliore nei pazienti con carcinoma follicolare con sola invasione capsulare (98%), rispetto a quelli con invasione vascolare (80%). Entrambi presentavano una prognosi decisamente più favorevole rispetto a quelli con carcinoma follicolare ampiamente invasivo (38%).
Rosai (46) ha proposto una classificazione patologica del carcinoma follicolare minimamente invasivo, in cui distingue i tumori con invasione vascolare limitata, fino a 3 foci, dai carcinomi follicolari capsulati con invasione vascolare estesa, superiore a 3 foci. I primi devono essere trattati con lobo-istmectomia tiroidea come quelli con sola invasione capsulare, gli altri con tiroidectomia totale come i carcinomi follicolari ampiamente invasivi (55).
In conclusione, la maggior parte degli autori (36,49,50) concorda che nella categoria dei carcinomi follicolari minimamente invasivi sia necessario distinguere quelli con sola invasione capsulare, che hanno una storia naturale grosso modo simile a quella degli adenomi follicolari e che possono essere trattati con intervento conservativo (lobo-istmectomia tiroidea), da quelli con invasione vascolare che possono dare metastasi a distanza e devono essere trattati con tiroidectomia di completamento e successiva terapia radioablativa. Nei carcinomi follicolari ampiamente invasivi è indiscutibile l’indicazione alla tiroidectomia di completamento e alla successiva terapia ablativa con radioiodio.
Bibliografia
- Hegedus L. Clinical practice. The thyroid nodule. N Engl J Med 2004, 351: 1764–71.
- LayfieldLJ, Cibas ES, Gharib H, et al. Thyroid aspiration cytology: current status. CA Cancer J Clin 2009, 59: 99-110.
- Cersosimo E, Gharib H, Suman VJ, et al. Suspicious thyroid cytologic findings: outcome in patients without immediate surgical treatment. Mayo Clin Proc 1993, 68: 343-8.
- Baloch ZW, Fleisher S, LiVolsi VA, et al. Diagnosis of "follicular neoplasm": a gray zone in thyroid fine-needle aspiration cytology. Diagn Cytopathol 2002, 26: 41-4.
- Haugen BR, Woodmansee WW, McDermott MT. Towards improving the utility of fine-needle aspiration biopsy for the diagnosis of thyroid tumors. Clin Endocrinol 2002, 56: 281–90.
- Segev DL, Clark DP, Zeiger MA, et al. Beyond the suspicious thyroid fine needle aspirate. A review. Acta Cytol 2003, 47: 709–22.
- Sapio MR, et al. Detection of RET/PTC, TRK and BRAF mutations in preoperative diagnosis of thyroid nodules with indeterminate cytological findings. Clin Endocrinol (Oxf ) 2007, 66: 678–83.
- Bartolazzi A, et al; Italian Thyroid Cancer Study Group (ITCSG). Galectin-3-expression analysis in the surgical selection of follicular thyroid nodules with indeterminate fine-needle aspiration cytology: a prospective multicentre study. Lancet Oncol 2008, 9: 543–9.
- Franco C, Mart?nez V, Allamand JP, et al. Molecular markers in thyroid fine-needle aspiration biopsy: a prospective study. Appl Immunohistochem Mol Morphol 2009, 17: 211–5.
- Nikiforov YE, Nikiforov YE, Steward DL, et al. Molecular testing for mutations in improving the fine-needle aspiration diagnosis of thyroid nodules. J Clin Endocrinol Metab 2009, 94: 2092–8.
- Cooper DS, Doherty GM, Haugen BR, et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2009, 19: 1167–214.
- Alonso N, Lucas A, Salinas I, et al. Frozen section in a cytological diagnosis of thyroid follicular neoplasm. Laryngoscope 2003, 113: 563-6.
- Chen H, Nicol TL, Udelsman R. Follicular lesions of the thyroid. Does frozen section evaluation alter operative management? Ann Surg 1995, 222: 101-6.
- Hamburger JI, Hamburger SW. Declining role of frozen section in surgical planning for thyroid nodules. Surgery 1985, 98: 307-12.
- Kopald KH, et al. Clarifyng the role of fine needle aspiration cytology evaluation and frozen section examination in the operative management of thyroid cancer. Arch Surg 1989, 124: 1201-5.
- Kingston G, et al. Role of frozen section and clinical parameters in distinguishing benign from malignant follicular neoplasms of the thyroid. Am J Surg 1992, 164: 603-5.
- Rodriguez JM, et al. Comparison between preoperative cytology and intraoperative frozen section biopsy in the diagnosis of thyroid nodules. Br J Surg 1994, 81: 1151-4.
- Shaha AR, et al. Intraoperative decision making during thyroid surgery based on the results of preoperative needle biopsy and frozen section. Surgery 1990, 108: 964-70.
- Gharib H, Goellner JR, Zinsmeister AR, et al. Fine-needle aspiration biopsy of the thyroid. The problem of suspicious cytologic findings. Ann Intern Med 1984, 101: 25–8.
- Gharib H, Goellner JR. Fine needle aspiration citology of the thyroid. A 12 year experience with 11.000 biopsies. Clin Lab Med 1993, 13: 699-709.
- Sclabas GM, Staerkel GA, Shapiro SE, et al. Fine-needle aspiration of the thyroid and correlation with histopathology in a contemporary series of 240 patients. Am J Surg 2003, 186: 702–9; discussion 709–10.
- Singer PA, et al. Treatment guidelines for patients with thyroid nodules and well differentiated thyroid cancer. Arch Intern Med 1996, 156: 2165.
- Goldstein RE, Netterville JL, Burkey B, et al. Implications of follicular neoplasms, atypia, and lesions suspicious for malignancy diagnosed by fine-needle aspiration of thyroid nodules. Ann Surg 2002, 235: 656–62.
- Schlinkert RT, van Heerden JA, Goellner JR, et al. Factors that predict malignant thyroid lesions when fine-needle aspiration is ‘‘suspicious for follicular neoplasm’’. Mayo Clin Proc 1997, 72: 913–6.
- Tuttle RM, Lemar H, Burch HB. Clinical features associated with an increased risk of thyroid malignancy in patients with follicular neoplasia by fine-needle aspiration. Thyroid 1998, 8: 377–83.
- Tyler DS, Winchester DJ, Caraway NP, et al. Indeterminate fine-needle aspiration biopsy of the thyroid: identification of subgroups at high risk for invasive carcinoma. Surgery 1994, 116: 1054-60.
- Baloch ZW, LiVolsi VA, Asa SL, et al. Diagnostic terminology and morphologic criteria for cytologic diagnosis of thyroid lesions: a synopsis of the National Cancer Institute Thyroid Fine-Needle Aspiration State of the Science Conference. Diagn Cytopathol 2008, 36: 425–37.
- Cibas ES, MD,Ali SZ. The Bethesda System for Reporting Thyroid Cytopathology. Am J Clin Pathol 2009, 132: 658-65.
- Yang J, Schnadig V, Logrono R, et al. Fine-needle aspiration of thyroid nodules: a study of 4703 patients with histologic and clinical correlations. Cancer 2007, 111: 306-15.
- Yassa L, Cibas ES, Benson CB, et al. Long-term assessment of a multidisciplinary approach to thyroid nodule diagnostic evaluation. Cancer 2007, 111: 508-16.
- Ravetto C, Colombo L, Dottorini ME. Usefulness of fine needle aspiration in the diagnosis of thyroid carcinoma: a retrospective study in 37,895 patients. Cancer 2000, 90: 357-66.
- DeLellis RA, Lloyd RV, Heitz PU, et al, eds. Pathology and Genetics of Tumours of Endocrine Organs. Lyon, France: IARC Press; 2004. World Health Organization Classification of Tumours.
- Giorgadze T, Rossi ED, Fadda G, et al. Does the fine-needle aspiration diagnosis of “Hürthle-cell neoplasm/follicular neoplasm with oncocytic features” denote increased risk of malignancy? Diagn Cytopathol 2004, 31: 307-12.
- Pu RT, Yang J, Wasserman PG, et al. Does Hürthle cell lesion/neoplasm predict malignancy more than follicular lesion/neoplasm on thyroid fine-needle aspiration? Diagn Cytopathol 2006, 34: 330-4.
- CarlingT, Udelsman R. Follicular neoplasms of the thyroid: what to recommend. Thyroid 2005, 15: 583-7.
- Emerick GT, Duh QY, Siperstein AE, et al. Diagnosis, treatment, and outcome of follicular thyroid carcinoma. Cancer 1993, 72: 3287-95.
- McHenry CR, Sandoval BA. Management of follicular and Hürthle cell neoplasms of the thyroid gland. Surg Oncol Clin N Am 1998, 7: 893-910.
- DeGroot LJ, Kaplan EL. Second operations for "completion" of thyroidectomy in treatment of differentiated thyroid cancer. Surgery 1991, 110: 936-9; discussion 939-40.
- De Jong SA, Demeter JG, Lawrence AM, et al. Necessity and safety of completion thyroidectomy for differentiated thyroid carcinoma. Surgery 1992, 112: 734-7; discussion 737-9.
- Carling T, Udelsman R. Thyroid Tumors. In: De Vita Jr VT, Hellman S, Rosenberg SA (eds). Cancer: Principles & Practice of Oncology. 8th ed. Lippincott-Raven, Philadelphia, 2008: pg. 1663-82.
- Chen H, Nicol TL, Zeiger MA, et al. Hurthle cell neoplasms of the thyroid: Are there factors predictive of malignancy? Ann Surg 1998, 227: 542–6.
- Kloos RT, Sherman SI, Tuttle RM; the NCCN Thyroid Carcinoma Panel Members. National Comprehensive Cancer Network Clinical Practice Guidelines in Oncology: Thyroid Carcinoma V.1.2011.
- Hirokawa M, Carney JA, Goellner JR, et al. Observer variation of encapsulated follicular lesions of the thyroid gland. Am J Surg Pathol 2002, 26: 1508-14.
- LiVolsi VD. Pathobiology of the parathyroid and thyroid gland. Baltimore: Lippincott Williams & Wilkins, 1993.
- Rosai J, Carcangiu M, De Lellis RA. Tumors of the thyroid gland. Fascicle 5. Third series. In: Rosai J, Carcangiu M, DeLellis RA. Atlas of tumor pathology. Washington, DC: Armed Forces Institute of Pathology, 1992: 161–82.
- Rosai J. Handling of thyroid follicular patterned lesions. Endocr Pathol 2005, 16: 279-83.
- Williams ED. Guest Editorial: Two Proposals Regarding the Terminology of Thyroid Tumors. Int J Surg Pathol 2000, 8: 181-3.
- Thompson LD, Wieneke JA, Paal E, et al. A clinicopathologic study of minimally invasive follicular carcinoma of the thyroid gland with a review of the English literature. Cancer 2001, 91: 505-24.
- D'Avanzo A, Treseler P, Ituarte PH, et al. Follicular thyroid carcinoma: histology and prognosis. Cancer 2004, 100: 1123-95.
- DeGroot L, Kaplan E, Shula MS, et al. Morbidity and mortality in follicular thyroid cancer. J Clin Endocrinol Metab 1995, 80: 2946–53.
- Lo CY, Chan WF, Lam KY, et al. Follicular thyroid carcinoma: the role of histology and staging systems in predicting survival. Ann Surg 2005, 242: 708–15.
- Sanders LE, Silverman M. Follicular and Hurthle cell carcinoma: predicting outcome and directing therapy. Surgery 1998, 124: 967–74.
- Schmid KW, Totsch M, Ofner D, et al. Minimally invasive follicular thyroid carcinoma: a clinicopathological study. Curr Top Pathol 1997, 91: 37–43.
- van Heerden JA, Hay ID, Goellner JR, et al. Follicular thyroid carcinoma with capsular invasion alone: a nonthreatening malignancy. Surgery 1992, 112: 1130-6; discussion 1136-8.
- Hermann M, Tonninger K, Kober F, et al. Minimally invasive follicular thyroid carcinoma: Not always total thyroidectomy. Chirurg 2010, 81: 627-30, 632-5.
Terapia chirurgica mini-invasiva per la tiroide
Marco Boniardi
SC di Chirurgia Generale Oncologica e Laparoscopica, Ospedale Niguarda Ca’ Granda – Milano
Introduzione
Negli ultimi quindici anni anche nell’ambito della chirurgia endocrina si è progressivamente diffusa la tendenza all’impiego di tecniche mini-invasive, cioè di procedure che ottengono gli stessi risultati della chirurgia tradizionale con incisioni cutanee più limitate e con dissezioni più focalizzate. Questo progresso si è reso possibile grazie all’introduzione di nuovi strumenti endoscopici, per una visione ingrandita del campo operatorio, e soprattutto grazie alla disponibilità di presidi utilizzati per la sezione dei vasi sanguigni che garantiscono un’emostasi altrettanto sicura rispetto alle classiche “legature”.
La procedura mini-invasiva, utilizzabile solo in un numero limitato di pazienti candidati alla tiroidectomia, presenta, oltre al miglior risultato estetico, il vantaggio di una riduzione del dolore post-operatorio e della durata della degenza ospedaliera.
Indicazioni
La chirurgia mini-invasiva della tiroide presenta delle indicazioni limitate, condizionate soprattutto dalle dimensioni dei noduli e dal volume della tiroide: come dimostrato dalle casistiche dei Centri di riferimento, solo il 10-15% delle tiroidectomie possono avvalersi di questo approccio (1,2).
Le indicazioni assolute alla mini-invasiva sono rappresentate da: noduli del diametro < 30-35 mm, volume tiroideo < 30 mL.
La tecnica è controindicata nei gozzi multinodulari voluminosi, nei pazienti precedentemente trattati con radioterapia a livello cervicale o già sottoposti a tiroidectomie parziali (per le aderenze che ostacolano le manovre di dissezione lungo piani normalmente avascolari), nei carcinomi invasivi, in presenza di metastasi linfonodali. Controindicazioni relative sono la presenza di tiroidite, l’ipervascolarizzazione della ghiandola (morbo di Basedow) per il rischio di sanguinamento, le caratteristiche costituzionali del paziente (collo corto e largo, obesità).
Indicazioni elettive alla chirurgia mini-invasiva sono pertanto le proliferazioni follicolari (classe citologica TIR 3) di cui viene richiesta la definizione istologica ed i carcinomi papilliferi a basso rischio. In questi ultimi, studi randomizzati hanno dimostrato che la tecnica mini-invasiva garantisce la stessa radicalità oncologica della tiroidectomia convenzionale con risultati sovrapponibili, nel follow-up post-operatorio, in termini di valori di tireoglobulinemia e di percentuale di captazione alla scintigrafia con 131I (3-5). Altra indicazione elettiva è rappresentata dalle tiroidectomie profilattiche in soggetti portatori della mutazione del proto-oncogene RET, esposti al rischio di insorgenza di un carcinoma midollare.
Tecnica
Le prime tiroidectomie mini-invasive sono state eseguite da Michel Gagner nel 1996 e da Cristiano Husher nel 1997, utilizzando tre piccole incisioni cutanee per l’introduzione degli strumenti operativi e con l’insufflazione di CO2 per la creazione della camera di lavoro (tiroidectomia endoscopica “pura”). Questa tecnica presentava tempi operativi molto lunghi, richiedeva una particolare esperienza in chirurgia endoscopica ed esponeva al rischio di diffusione del gas nei tessuti sottocutanei (pneumo-collo).
Nel 1998 Paolo Miccoli ha proposto una nuova procedura, la tiroidectomia mini-invasiva video assistita (MIVAT), che ha il vantaggio di non richiedere l’impiego della CO2, di utilizzare una strumentazione semplice, di essere realizzabile in tempi operatori accettabili e di offrire un eccellente risultato estetico. Per questi motivi e per la sua facile riproducibilità dopo una breve curva di apprendimento, la MIVAT ha presentato subito ampia diffusione nel mondo scientifico e costituisce oggi la tecnica mini-invasiva più utilizzata in Occidente.
L’intervento prevede un’incisione cutanea di 1.5-2 cm, due dita trasverse al di sopra della fossetta del giugulo e la separazione dei muscoli pre-tiroidei sulla linea mediana, con conseguente accesso alla loggia tiroidea. Successivamente, vengono introdotte nella cavità così formata un’ottica del diametro di 5 mm, due piccole spatole smusse e due divaricatori (strumenti realizzati specificamente per questa tecnica): da questo momento il chirurgo opera controllando il movimento degli strumenti sul monitor collegato alla telecamera. L’intervento procede con la preparazione della tiroide mediante separazione della capsula tiroidea dalle strutture circostanti lungo tutto l’asse longitudinale del lobo. Vengono quindi isolati i rami vascolari del peduncolo superiore, che vengono sezionati con il bisturi ad ultrasuoni (Ultracision, Ethicon Endosurgery) ed eventuale applicazione di clip metalliche. Si procede quindi con una delle fasi più delicate dell’intervento, il riconoscimento e l’isolamento del nervo ricorrente e delle paratiroidi, che devono essere identificati e preservati con assoluta sicurezza durante le manovre di distacco della tiroide dalla trachea. L'ingrandimento delle immagini ad opera della telecamera è in questa fase di grande vantaggio per il chirurgo, perché offre una migliore definizione delle strutture vascolari e soprattutto del nervo ricorrente. Una volta ultimata questa fase “endoscopica”, il lobo tiroideo viene fatto fuoriuscire dall'incisione cutanea; il distacco dalla trachea viene quindi completato con tecnica tradizionale, sotto costante controllo visivo del nervo ricorrente. La tiroide viene infine sezionata in corrispondenza dell’istmo se è stata programmata un’emitiroidectomia; se, al contrario, si deve procedere ad un’asportazione completa della ghiandola si attua, con procedimento analogo, l’exeresi del lobo controlaterale. I muscoli pre-tiroidei e il sottocute vengono riavvicinati con punti riassorbibili, mentre la sintesi della cute viene effettuata con sutura intra-dermica o con applicazione di colla (cianoacrilato).
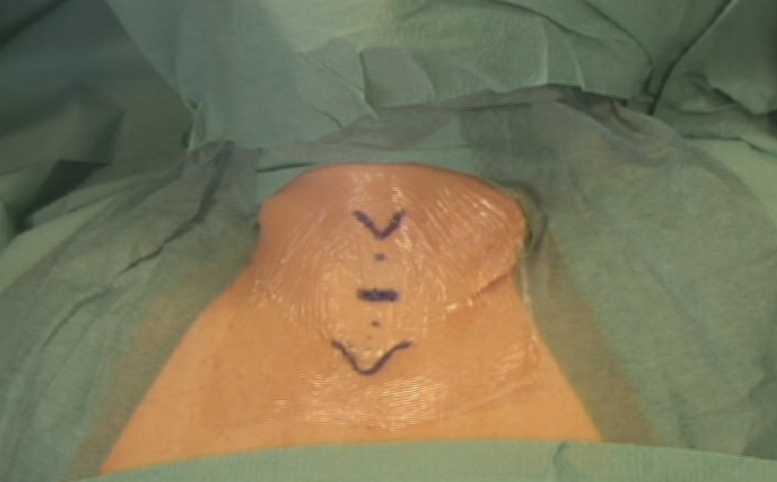
Figura 1. Setting operatorio: il campo operatorio è stato preparato evidenziando la cartilagine tiroidea (in alto), la linea del’incisione cutanea e la fossetta del giugulo (in basso).
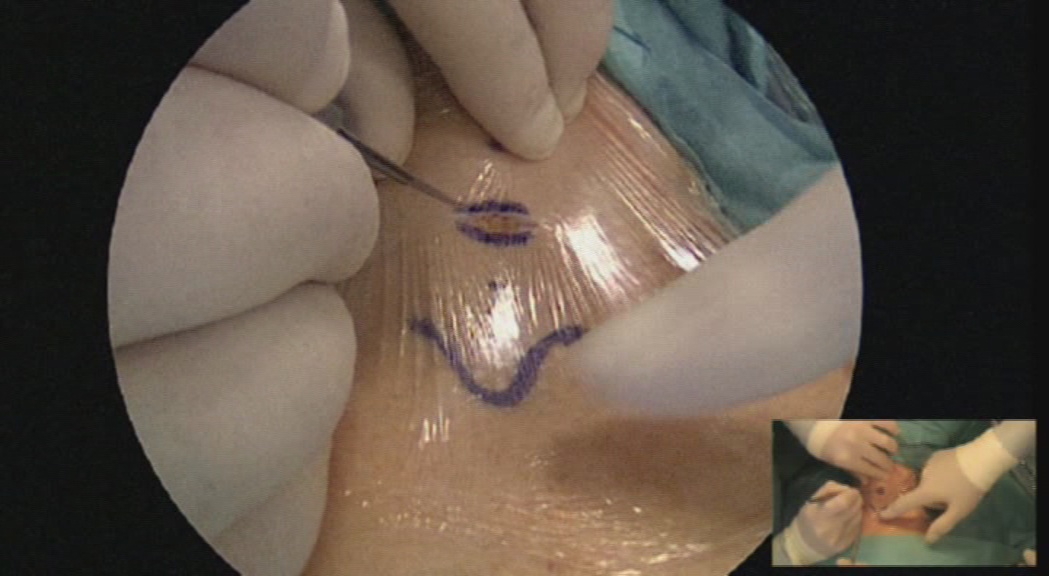
Figura 2: Incisione cutanea della lunghezza di 2 cm
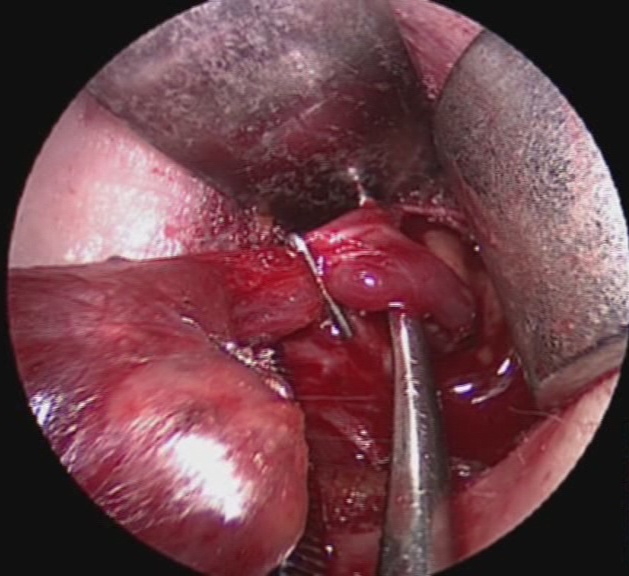
Figura 3: Sezione dei vasi del peduncolo vascolare superiore tra clip metalliche
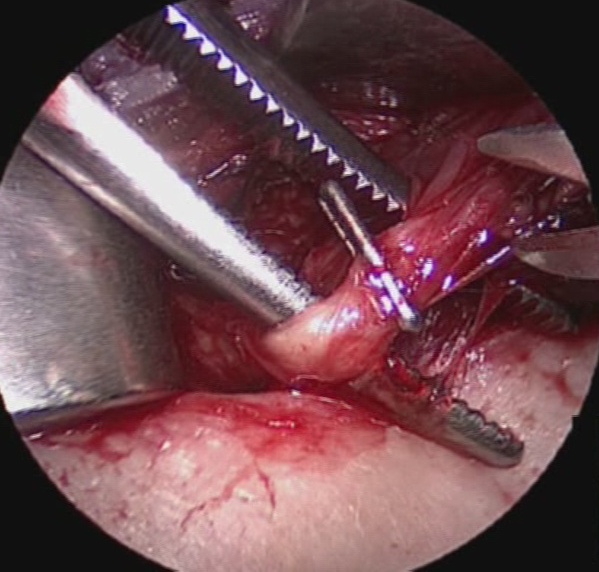
Figura 4: Sezione dei vasi del peduncolo inferiore
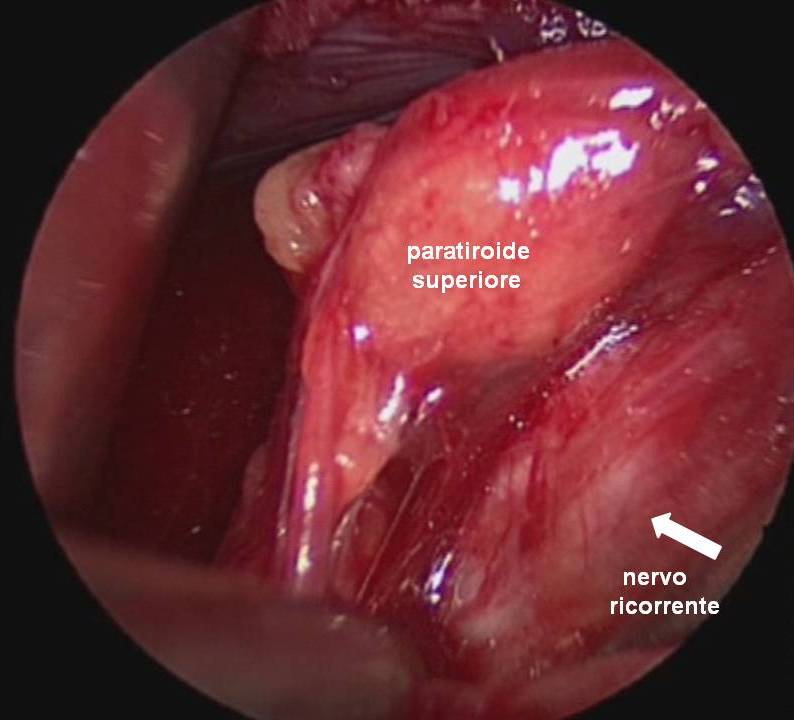
Figura 5: Riconoscimento del nervo ricorrente destro e della paratiroide superiore destra
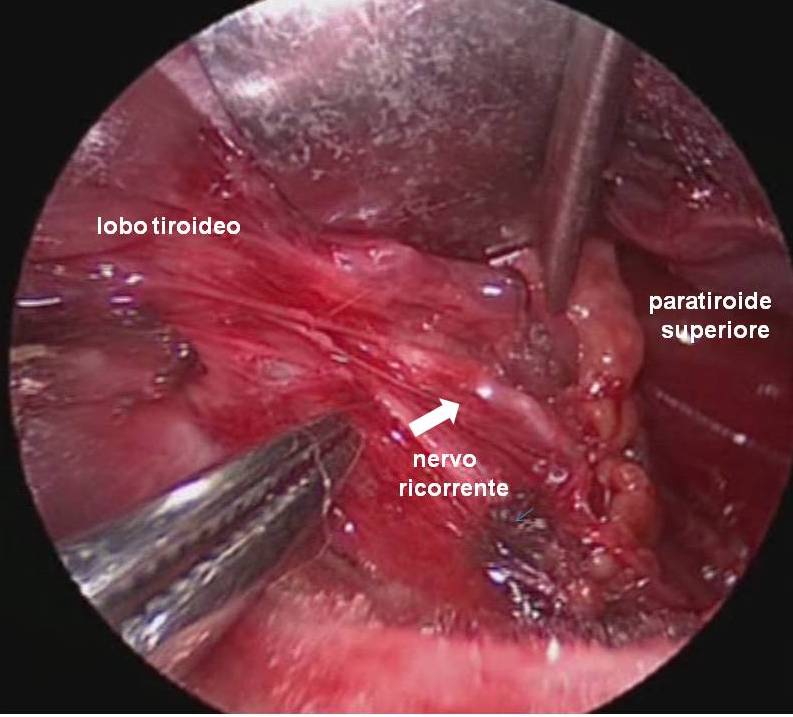
Figura 6: Il nervo ricorrente di sinistra isolato fino al punto di penetrazione nella laringe; la paratiroide superiore è stata separata dal lobo tiroideo
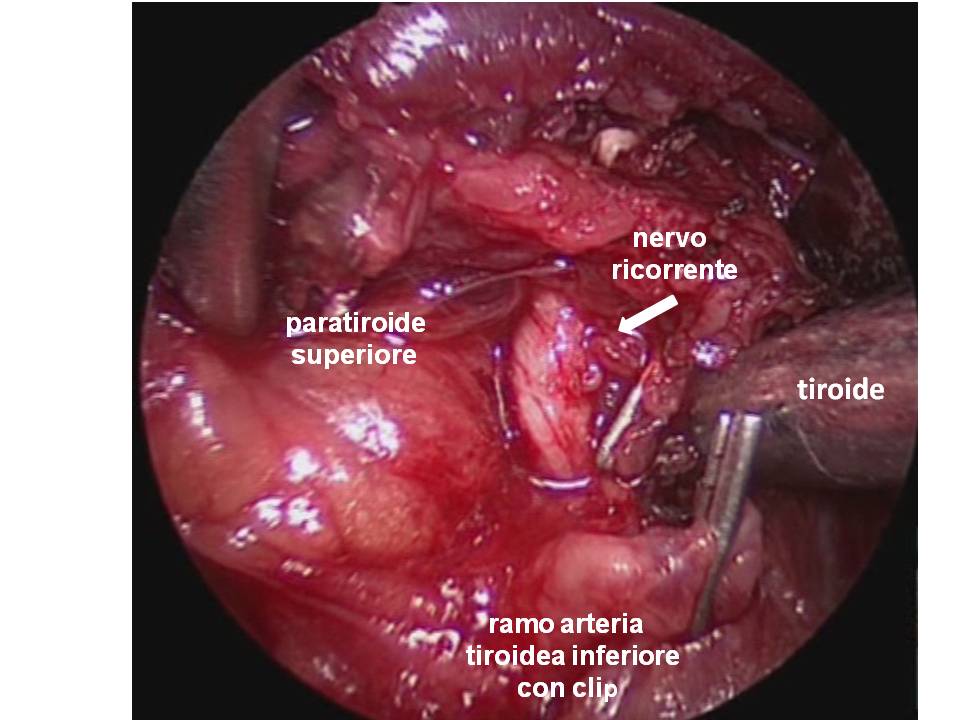
Figura 7: Panoramica finale del campo operatorio prima del completamento del distacco della tiroide dal piano tracheale
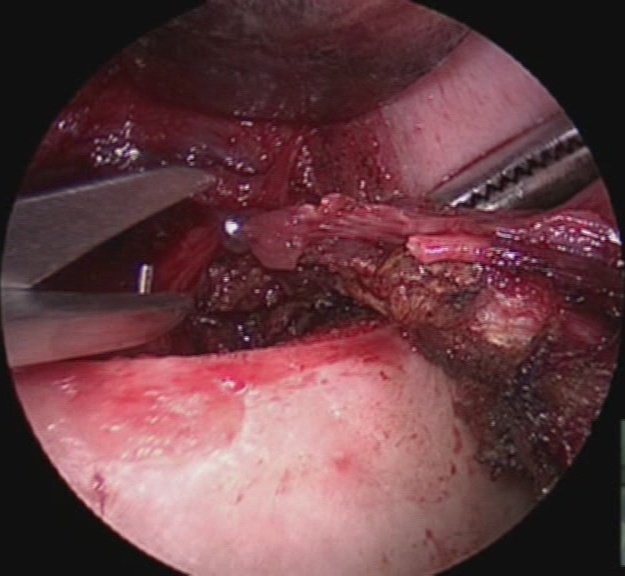
Figura 8: Estrazione del lobo tiroideo destro dalla mini-cervicotomia
Risultati
In una recente review Jao Liu ha analizzato i risultati di 9 studi prospettici randomizzati che hanno confrontato i risultati della chirurgia convenzionale con quelli della chirurgia mini-invasiva video-assistita della tiroide (6). La MIVAT ha presentato una percentuale di complicanze (emorragia post-operatoria, paralisi ricorrenzale, ipoparatiroidismo transitorio/definitivo) sovrapponibile a quella della chirurgia convenzionale. Si è invece resa evidente una superiorità della MIVAT in termini di risultato estetico e di dolore post-operatorio. Le incisioni cutanee sono risultate mediamente di 2 cm di lunghezza in confronto con i 5 cm delle cervicotomie tradizionali. Il dolore post-operatorio nelle prime 48 ore è apparso significativamente inferiore nella chirurgia mini-invasiva, mentre nel decorso post-operatorio successivo non sono emerse differenze tra le due procedure (7). La riduzione del dolore può essere giustificata dalla minore estensione della ferita chirurgica e da una dissezione all’interno della loggia tiroidea più focalizzata. Inoltre la MIVAT non necessita di un’iperestensione del capo sul tavolo operatorio, e questo può spiegare l’assenza di cervicalgie nelle ore immediatamente successive all’intervento. In tutti i Centri i tempi operatori sono risultati inizialmente superori a quelli della chirurgia “open”, ma sono andati progressivamente riducendosi col progredire dell’esperienza degli operatori (8).
L’unico “svantaggio” della MIVAT è rappresentato dai costi, che sono risultati superiori alla chirurgia tradizionale, soprattutto per la necessità di impiego di strumenti emostatici (bisturi ad ultrasuoni) utilizzabili per un solo intervento.
Nuove prospettive: chirurgia "scarless" e robotica
Negli ultimi anni la chirurgia mini-invasiva della tiroide si è orientata verso la ricerca di soluzioni tecniche che consentano di asportare la tiroide evitando ferite in sede cervicale (9-10). Questo indirizzo di ricerca è sostenuto soprattutto dai Paesi Orientali, dove la cicatrice nel collo è avvertita come motivo di disagio sociale, soprattutto dalle giovani donne. Sono state riproposte teniche endoscopiche, quindi con impiego di gas per ottenere una camera di lavoro, con approccio trans-mammario, realizzate mediante introduzione degli strumenti endoscopici in sede sternale ed in corrispondenza dell’areola mammaria. Altri studi, per lo più sperimentali, hanno applicato alla chirurgia della tiroide la tecnica NOTES (Natural Orifice Transluminal Endoscopic Surgery), chirurgia “senza cicatrici” che utilizza gli orifizi naturali per l’accesso degli strumenti chirurgici. La tiroidectomia viene realizzata con questo approccio per via trans-orale (11).
Una procedura che sta suscitando grande interesse, non solo nei Paesi Orientali, ma anche nel mondo Occidentale, è la tiroidectomia con accesso trans-ascellare realizzata con l’impiego del robot (12-14). Le indicazioni alla tiroidectomia robotica sono analoghe a quelle della MIVAT: lesioni uninodulari di diametro < 3 cm e volume della ghiandola < 30 mL. L’intervento è realizzato senza impiego di gas. La tecnica prevede un’incisione di circa 6 cm in corrispondenza del cavo ascellare omolaterale alla lesione tiroidea; viene quindi preparato un tragitto sottocutaneo fino al muscolo sterno-cleido-mastoideo, che consente agli strumenti chirurgici robotici di accedere alla loggia tiroidea. Inizia quindi l’intervento robotico vero e proprio, con il chirurgo operatore seduto alla consolle: le sue manovre vengono trasmesse dal robot alle braccia operative alle quali sono collegati gli strumenti chirurgici. Rispetto alla tecnica endoscopica i vantaggi sono rappresentati soprattutto dalla possibilità per l’operatore di effettuare movimenti molto precisi, a 360°, con visione tridimensionale del campo operatorio. L’intervento risulta ideale per lesioni tiroidee monolaterali, mentre appare più difficoltoso per le tiroidectomie totali, specie per l’exeresi del lobo controlaterale all’incisione. I risultati relativi a più di 700 tiroidectomie robotiche presentati da Woong Youn Chung, chirurgo coreano, attualmente il massimo esperto in questo campo, e studi multicentrici relativi al trattamento di più di 2000 casi sembrano dimostrare che la tiroidectomia robotica garantisce ottimi risultati, con bassa percentuale di complicanze, alti livelli di radicalità oncologica, e, in confronto con altre tecniche mini-invasive, maggiori vantaggi ergonomici per il chirurgo. Il vantaggio maggiore per il paziente, sempre rispetto alla MIVAT, è rappresentato dall’assenza di cicatrici a livello cervicale. La tiroidectomia robotica, tuttavia, non può essere considerata mini-invasiva in senso stretto, sia per l’entità dell’incisione cutanea che per l’estensione dell’area cruentata. I tempi operatori risultano maggiori rispetto alla MIVAT e le difficoltà della tecnica chirurgica impongono una curva di apprendimento più lunga. Non sono inoltre da trascurare i costi dell’intervento, correlati alla disponibilità del robot e all’acquisto di una sofisticata strumentazione, elementi, questi, che potrebbero ostacolarne la diffusione.
Bibliografia
- Samy AK, Ridgway D, Orabi A, et al. Minimally invasive, video-assisted thyroidectomy: first experience from the United Kingdom. Ann R Coll Surg Engl 2010, 92: 379-84.
- Kim AJ, Liu JC, Ganly I, et al. Minimally invasive video-assisted thyroidectomy: expanded indications in a tertiary care cancer center. Head & Neck 2011, 33: 1557-60.
- Miccoli P, Materazzi G, Berti P. Minimally invasive thyroidectomy in the treatment of well differentiated thyroid cancers: Indications and limits. Curr Opin Otolaryngol Neck Surg 2010, 18: 114-8.
- Miccoli P, Pinchera A, Materazzi G, et al. Surgical treatment of low and intermediate-risk papillary thyroid cancer with minimally invasive video-assisted thyroidectomy. J Clin Endocrinol Metab 2009, 94: 1618-22.
- Seybt MW, Terris DJ. Minimally invasive thyroid cancer surgery. Minerva Chir 2010, 65: 39-43.
- Liu J, Song T, Xu M. Minimally invasive video-assisted versus conventional open thyroidectomy: A systematic review of available data. Surg Today 2012, 42: 848-56.
- Alesina PF, Rolfs T, Ruhland K, et al. Evaluation of postoperative pain after minimally invasive video-assisted and conventional thyroidectomy: result of a prospective study. Langenbecks Arch Surg 2010, 395: 845-9.
- Del Rio P, Arcuri MF, Pisani P, et al. Minimally invasive video-assisted thyroidectomy (MIVAT): what is the real advantage? Langenbecks Arch Surg 2010, 395: 323-6.
- Papaspyrou G, Ferlito A, Silver CE, et al. Extracervical approaches to endoscopic thyroid surgery. Surg End 2011, 25: 995-1003.
- Linos D. Minimally invasive thyroidectomy: a comprehensive appraisal of existing techniques. Surgery 2011, 150: 17-24.
- Wilhelm T, Metzig A. Endoscopic minimally invasive thyroidectomy: first clinical experience. Surg End 2010, 24: 1757-8.
- Lee J, Woonng Y, Chung. Current status of robotic thyroidectomy and neck dissection using a gasless transaxillary approach. Curr Opin Oncol 2012, 24: 7-15.
- Rang Ryu H, Kang SW, Lee SH, et al. Feasibility and safety of a new robotic thyroidectomy through a gasless, transaxillary single-incision approach. J Am Coll Surg 2010, 211: e13-9.
- Lee J, Rang Ryu H, Park JH, et al. Early surgical outcomes comparison between robotic and conventional open thyroid surgery for papillary thyroid microcarcinoma. Surgery 2012, 151: 724-30.
Chirurgia robotica per la patologia tiroidea
Celestino Pio Lombardi
UO di Chirurgia Endocrina e Metabolica, Policlinico Gemelli, Roma
(aggiornato all'8 novembre 2016)
Nel corso degli ultimi decenni, in seguito alla descrizione della prima paratiroidectemia subtotale per via endoscopica da parte di Gagner nel 1996 e sulla scorta dell’esperienza maturata nel trattamento della patologia paratiroidea, sono stati descritti e sviluppati numerosi approcci mini-invasivi alla tiroidectomia (1,2). L’introduzione di questi approcci è stata motivata in primo luogo dalla volontà di ridurre al minimo il danno “estetico” della tiroidectomia, principio estremamente rilevante se si considera il fatto che la maggior parte dei pazienti portatori di patologia tiroidea è costituita da donne relativamente giovani, per le quali il risultato estetico è estremamente importante, soprattutto in una regione così “visibile” come il collo (1,2).
Sono state proposte tecniche che prevedono l’uso dell’endoscopio e tecniche senza l’uso dell’endoscopio (1,2). Ovviamente le seconde tendono a ridurre l’incisione cutanea, senza peraltro avere i vantaggi che l’ingrandimento offerto dall’endoscopio consente in termini di visualizzazione e dissezione delle strutture. Le tecniche che prevedono l’uso dell’endoscopio sarebbero quindi da preferire proprio per questo motivo.
Da un punto di vista puramente didattico, le differenti tecniche che utilizzano l’endoscopio possono essere suddivise in tecniche video-assistite e tecniche endoscopiche (fig 1).
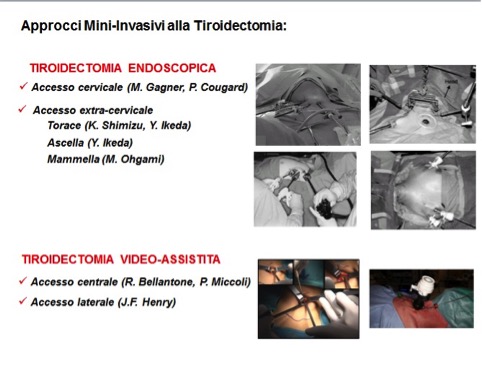
Figura 1 Approcci mini-invasivi alla tiroidectomia
La tiroidectomia video-assistita (VAT = video-assisted thyroidectomy), descritta per la prima volta nel 1999 (3), consiste in una tecnica totalmente gasless, che ripete tutti gli step della chirurgia convenzionale, in cui la telecamera rappresenta un ausilio tecnico che consente di eseguire lo stesso intervento attraverso un’incisione cutanea di 2 cm (3-7). Questa tecnica è quella che ha incontrato il maggior numero di consensi, in considerazione della sua riproducibilità e dei rilevanti vantaggi rispetto alla chirurgia convenzionale, soprattutto in termini di diminuzione del discomfort post-operatorio e del miglior risultato estetico (8,9). I dati di studi multicentrici effettuati su ampie casistiche hanno inoltre dimostrato che, in mani esperte, la tiroidectomia video-assistita rappresenta una metodica sicura, con complicanze post-operatorie sovrapponibili se non minori rispetto alla chirurgia convenzionale (6).
Gli approcci puramente endoscopici alla tiroidectomia comportano la necessità di insufflazione continua di CO2 o di sistemi meccanici esterni per mantenere lo spazio operatorio (2,10). Questi ultimi possono essere classificati in approcci diretti cervicali, che hanno avuto una limitata diffusione, e approcci indiretti extra-cervicali (toracico, mammario e ascellare) (2,10), introdotti al fine di eliminare qualsiasi cicatrice a livello cervicale. Poiché la via di accesso extra-cervicale di questi approcci comporta la necessità di un’estesa fase di dissezione per raggiungere la loggia tiroidea, essi non possono essere definiti mini-invasivi. Inoltre, la difficoltà della dissezione puramente endoscopica, dovuta soprattutto all’esiguo spazio di lavoro e alle limitazioni della strumentazione endoscopica e della visione bidimensionale, rappresenta un limite importante della tiroidectomia endoscopica con approccio extra-cervicale. Forse sono proprio questi limiti insiti nelle metodiche che hanno limitato la loro diffusione agli autori che le hanno proposte (10).
Al fine di superare i limiti della tiroidectomia endoscopica extra-cervicale, un gruppo dello Yonsei Medical Center di Seul in Corea del Sud ha introdotto e perfezionato l’applicazione nella pratica clinica della tecnologia robotica alla tiroidectomia (Tiroidectomia Robot-Assistita, TR) (11). Sin dalla sua introduzione, la TR è stata argomento di grande interesse sia negli Stati Uniti, che in altre parti del mondo (12-15). Tuttavia, nonostante l’entusiasmo iniziale, il reale impatto clinico della TR rimane controverso. Infatti, nel 2011 la FDA negli Stati Uniti ha revocato l’approvazione all’applicazione della tecnologia robotica alla tiroidectomia (16). Questo ha condotto diversi autori ad abbandonare la RT, dubitando dei reali benefici della tecnica (17,18). La particolare diffusione di questa tecnica nei Paesi Orientali, potrebbe essere attribuita a ragioni socioculturali, per le quali le popolazioni asiatiche rifiutano le cicatrici soprattutto a livello cervicale.
Seppur gravato da costi significativamente più elevati, il sistema chirurgico robotico Da Vinci (Intuitive Surgical) facilita la tiroidectomia con accesso extra-cervicale attraverso una visione tridimensionale ingrandita, un’enorme libertà di movimento degli strumenti chirurgici e la maggior precisione derivata dai software elettronici. La TR descritta da Chung prevede un approccio trans-ascellare, attraverso un’incisione praticata a livello del pilastro ascellare anteriore. Viene successivamente creato un tunnel sottocutaneo, seguendo il piano avascolare sulla fascia del muscolo grande pettorale, fino a raggiungere il muscolo sterno-cleido-mastoideo; a questo livello, i due capi del muscolo vengono separati e viene raggiunta la loggia tiroidea. Lo spazio operatorio viene mantenuto attraverso l’ausilio di un retrattore apposito, che consente di raggiungere la ghiandola tiroidea. A questo punto viene eseguito il tempo di docking, posizionando all’interno del tunnel 3 bracci, uno per l’ottica tridimensionale e gli altri due per gli strumenti operativi. La lobectomia omolaterale all’accesso chirurgico viene eseguita seguendo sostanzialmente gli stessi step della tiroidectomia convenzionale. Tuttavia, la lobectomia controlaterale all’accesso ascellare risulta tecnicamente più complessa per l’ostacolo rappresentato dalla trachea, che può non consentire un’adeguata visualizzazione delle strutture del campo operatorio controlaterale, in particolar modo identificazione e dissezione del nervo laringeo inferiore, soprattutto a livello del suo ingresso in laringe.
Le indicazioni per questa tecnica comprendono pazienti con tiroide di volume normale o lievemente aumentato, noduli maligni di piccole dimensioni (carcinoma papillare della tiroide a rischio basso o intermedio), noduli benigni fino a 5 cm.
Le principali controindicazioni comprendono la patologia infiammatoria della tiroide e il sospetto di neoplasia infiltrante o localmente avanzata (19). Ulteriori controindicazioni, in alcuni casi assolute, sono rappresentate da storia di pregressa chirurgia del collo e della mammella e/o precedenti trattamenti radioterapici del distretto cervico-facciale. Anche la presenza sottocutanea, in regione pettorale, di dispositivi elettromedicali per l’assistenza cardiaca (pace-maker, defibrillatori) controindica l’approccio robotico trans-ascellare per l’impossibilità di eseguire il tunnel sottocutaneo di accesso alla regione tiroidea (19). Controindicazioni relative potrebbero inoltre essere rappresentate da artrosi e/o pregressa chirurgia ortopedica dell’articolazione scapolo-omerale, che limitano il posizionamento in estensione dell’arto superiore richiesto da questo approccio.
Importanti sono anche le caratteristiche antropometriche dei pazienti. La creazione del tunnel sottocutaneo pettorale è più difficoltosa in soggetti con BMI > 30 e con una distanza > 15 cm tra l'incisione ascellare e il giugulo sternale (19).
La TR può essere inoltre eseguita attraverso un accesso ascellare e mammario combinato (20), con approccio trans-orale (21) e retro-auricolare (22).
Nonostante il grande interesse riscosso nella comunità chirurgica e l’ampia diffusione nei Paesi Orientali, la TR rimane, ad oggi, una procedura controversa nei Paesi Occidentali (17,18). Infatti, oltre al significativo aumento dei costi che tale procedura comporta, rimangono da chiarire rilevanti questioni inerenti la sicurezza dell’intervento. La tiroidectomia eseguita con tecnica convenzionale è una delle procedure chirurgiche più frequenti al mondo e presenta, in mani esperte, un profilo di rischio molto basso, rispetto al quale ogni nuovo approccio proposto deve essere confrontato. Infatti, in associazione con l’approccio robotico sono state riportate in letteratura, oltre alle comuni complicanze associate alla tiroidectomia, quali l’ipoparatiroidismo e le lesioni ricorrenziali, anche nuove e inconsuete complicanze legate sostanzialmente alla via di accesso, come il danno al plesso brachiale, lo sviluppo della sindrome di Horner, un aumentato rischio di lesioni tracheali e dei grossi vasi, inesistenti o rari nel corso dell’accesso cervicotomico. Ad oggi, i risultati della letteratura dimostrano che la TR si associa a tempi operatori significativamente più lunghi (circa 60 minuti) rispetto alla tecnica convenzionale, legati alla preparazione del lembo cutaneo e al tempo di docking robotico (23). Inoltre, recentemente è stato riportato un rischio significativamente più elevato di lesioni ricorrenziali temporanee (tre volte maggiore rispetto alla chirurgia convenzionale) (23). Per quanto riguarda inoltre la radicalità della resezione chirurgica e l’outcome oncologico, recenti evidenze dimostrano che la TR sembra meno efficace nella rimozione completa del tessuto tiroideo e nel numero di linfonodi asportati nel corso di linfoadenectomia del compartimento centrale (24).
In conclusione, il potenziale aumento del rischio di morbilità post-operatoria, il significativo aumento dei costi e dei tempi operatori e la necessità di follow-up a lungo termine dell’outcome oncologico della TR, rendono ad oggi controversa l’applicazione nella pratica clinica corrente di questa procedura. Sono essenziali studi prospettici eseguiti su ampie casistiche, al fine di chiarire ulteriormente i vantaggi e gli svantaggi dell’applicazione della tecnologia robotica alla tiroidectomia.
Bibliografia
- Duh QY. Presidential address: minimally invasive endocrine surgery – standard treatment of treatment or hype? Surgery 2003, 134: 849-57.
- Linos D. Minimally invasive thyroidectomy: a comprehensive appraisal of existing techniques. Surgery 2011, 150: 17-24.
- Bellantone R, Lombardi CP, Raffaelli M, et al. Minimally invasive, totally gasless video-assisted thyroid lobectomy. Am J Surg 1999, 177: 342-3.
- Miccoli P, Berti P, Bendinelli C, et al. Minimally invasive video-assisted surgery of the thyroid: a preliminary report. Langenbecks Arch Surg 2000, 385: 261-4.
- Bellantone R, Lombardi CP, Bossola M, et al. Video-assisted vs conventional thyroid lobectomy: a randomized trial. Arch Surg 2002, 137: 301-4.
- Miccoli P, Bellantone R, Mourad M, et al. Minimally invasive video-assisted thyroidectomy: multiinstitutional experience. World J Surg 2002, 26: 972-5.
- Lombardi CP, Raffaelli M, Princi P, et al. Safety of video-assisted thyroidectomy versus conventional surgery. Head Neck 2005, 27: 58-64.
- Lombardi CP, Raffaelli M, D'Alatri L, et al. Video-assisted thyroidectomy significantly reduces the risk of early postthyroidectomy voice and swallowing symptoms. World J Surg 2008, 32: 693-700.
- Miccoli P, Berti P, Raffaelli M, et al. Comparison between minimally invasive video-assisted thyroidectomy and conventional thyroidectomy: a prospective randomized study. Surgery 2001, 130: 1039-43. Erratum in: Surgery 2002, 131: 148.
- Slotema ET, Sebag F, Henry JF. What is the evidence for endoscopic thyroidectomy in the management of benign thyroid disease? World J Surg 2008, 32: 1325-32.
- Kang SW, Jeong JJ, Yun JS, et al. Robot-assisted endoscopic surgery for thyroid cancer: experience with the first 100 patients. Surg Endosc 2009, 23: 2399-406.
- Berber E, Siperstein A. Robotic transaxillary total thyroidectomy using a unilateral approach. Surg Laparosc Endosc Percutan Tech 2011, 21: 207-10.
- Nam KH, Owen R, Inabnet WB 3rd. Prevention of complications in transaxillary single-incision robotic thyroidectomy. Thyroid 2012, 22: 1266–74.
- Foley CS, Agcaoglu O, Siperstein AE, Berber E. Robotic transaxillary endocrine surgery: a comparison with conventional open technique. Surg Endosc 2012, 26: 2259-66.
- Materazzi G, Fregoli L, Manzini G, et al. Cosmetic result and overall satisfaction after minimally invasive video-assisted thyroidectomy (MIVAT) versus robot-assisted transaxillary thyroidectomy (RATT): a prospective randomized study. World J Surg 2014, 38: 1282-8.
- Inabnet WB 3rd. Robotic thyroidectomy: must we drive a luxury sedan to arrive at our destination safely? Thyroid 2012, 22: 988-90.
- Patel D, Kebebew E. Pros and cons of robotic transaxillary thyroidectomy. Thyroid 2012, 22: 1025-6.
- Perrier ND. Why I have abandoned robot-assisted transaxillary thyroid surgery. Surgery 2012, 152: 1025-6.
- Lee J, Chung WY. Robotic surgery for thyroid disease. Eur Thyroid J 2013, 2: 93-101.
- Kim WW, Jung JH, Park HY. A single surgeon's experience and surgical outcomes of 300 robotic thyroid surgeries using a bilateral axillo-breast approach. J Surg Oncol 2015, 111: 135-40.
- Clark JH, Kim HY, Richmon JD. Transoral robotic thyroid surgery. Gland Surg 2015, 4: 429-34.
- Byeon HK, Kim DH, Chang JW, et al. Comprehensive application of robotic retroauricular thyroidectomy: the evolution of robotic thyroidectomy. Laryngoscope 2015, 126: 1952–7.
- Lang BH, Wong CK, Tsang JS, et al. A systematic review and meta-analysis comparing surgically-related complications between robotic-assisted thyroidectomy and conventional open thyroidectomy. Ann Surg Oncol 2014, 21: 850-61.
- Lang BH, Wong CK, Tsang JS, et al. A systematic review and meta-analysis evaluating completeness and outcomes of robotic thyroidectomy. Laryngoscope 2015, 125: 509-18.
Terapia interventistica per le patologie tiroidee
Overview sulle tecniche ablative percutanee per la patologia nodulare tiroidea benigna
Roberto Novizio1, Chiara Carzaniga2, Enrico Papini3 & Rinaldo Guglielmi3
1UO Endocrinologia, Università Cattolica del Sacro Cuore, Fondazione Policlinico Universitario “A. Gemelli” IRCCS, Roma
2Istituto Auxologico Italiano, Milano
3Endocrinologia, Ospedale Regina Apostolorum, Albano Laziale (RM)
(aggiornato all’ottobre 2023)
1. PERCHÉ CONOSCERE – O SAPER EFFETTUARE – LA TERMO-ABLAZIONE TIROIDEA
I noduli tiroidei sono comuni, con prevalenza nell’adulto che arriva al 50% nelle donne e al 30% negli uomini. Benché la maggior parte di questi noduli sia benigna e non cresca sensibilmente nel tempo, circa il 10% ha una crescita costante e alcuni di questi noduli richiedono un trattamento per sintomi locali o problemi estetici (1-3).
Negli ultimi anni, c’è stato un aumento notevole del ricorso alla chirurgia tiroidea. La tiroidectomia, sebbene in mani esperte sia un intervento di routine, richiede successiva terapia sostitutiva con tiroxina e ha costi relativamente elevati; inoltre può dare complicanze che hanno impatto sulla qualità di vita. I pazienti, inoltre, possono essere preoccupati per la dipendenza da farmaci, l'aderenza alla terapia e gli effetti collaterali. Altre preoccupazioni non trascurabili sono l’ansia per l'intervento, l'anestesia, il dolore post-operatorio e la cicatrice del collo. Infine, l’impiego di risorse per un intervento chirurgico su una patologia accertatamente benigna sottrae disponibilità al più appropriato uso in ambito oncologico.
Per trattare i noduli tiroidei benigni divenuti sintomatici, negli ultimi vent'anni, dopo gli iniziali studi di fattibilità (4), sono state sviluppate tecniche termo-ablative sotto guida ecografica, che utilizzano fonti di energia diverse - laser, radiofrequenza, micro-onde e ultrasuoni focalizzati. Queste tecniche mirano a ridurre in modo clinicamente significativo il volume del nodulo, migliorando i sintomi ed evitando l’atto chirurgico. Ciò consente un ritorno più veloce alla vita quotidiana e un risparmio significativo per il sistema sanitario (5).
Per l’insieme di questi motivi, la termo-ablazione tiroidea potrebbe essere parte utile delle opzioni terapeutiche offerte dai centri ad alto flusso che si occupano di tireopatie.
2. PRINCIPI FISICI E STRUMENTI TECNICI
Obiettivo della termo-ablazione è causare un danno termico irreversibile al tessuto bersaglio. Le diverse tecniche impiegano differenti sorgenti di energia con il medesimo scopo di aumentare la temperatura nella lesione bersaglio (tab 1): a partire dai 46°C e fino a 60°C, inizia il processo di denaturazione delle proteine, che comporta danni irreversibili a carico del tessuto bersaglio, se mantenuto per un tempo adeguato. Ciò si differenzia dalle tecniche di ablazione chimica - ora applicate in ambito tiroideo solo per le lesioni cistiche - che prevedono invece la coagulazione del tessuto tramite l’iniezione di sostanze tossiche, come l’etanolo.
La temperatura ottimale per un'efficace ablazione tiroidea è compresa tra 60°C e 100°C, temperatura cruciale per indurre sia la necrosi cellulare che la coagulazione dei vasi sanguigni, un complesso di modifiche del tessuto comunemente definito necrosi coagulativa. L’incremento ulteriore della temperatura, fino a 200°C, provoca l'ebollizione dell'acqua presente in sede intra- ed extra-cellulare, determinando carbonizzazione tissutale e isolamento della fonte termica, con minore estensione della distruzione del tessuto circostante.
| Tabella 1 | |
| Temperatura (°C) | Effetto cellulare |
| < 40 | Non danno significativo |
| 40-46 | Danno cellulare reversibile |
| 47-60 | Denaturazione |
| 61-100 | Necrosi coagulativa |
| 100-200 | Essiccazione |
2.1. Laser
Il laser costituisce un raggio di luce monocromatico, condotto da una fibra ottica, in grado di generare calore quando entra in contatto con un tessuto.
Per raggiungere il tessuto nodulare, vengono utilizzati aghi mandrinati (tipo Chiba) di calibro 21G, all'interno dei quali, dopo aver rimosso il mandrino, viene inserita una fibra ottica del diametro di 300 micron. Attualmente si utilizzano generalmente sorgenti come ittrio-alluminio e neodimio, operanti a 1064 nanometri, oppure laser a diodi che operano a 820 nm (fig 1).
Figura 1
Ago mandrinato 21G, all’interno del quale, sfilato il mandrino, viene infilata la fibra ottica, che produce fasci laser.
A differenza delle tecniche di termo-ablazione con radio-frequenza o micro-onde, la zona ablativa si produce prevalentemente davanti alla fibra ottica, che costituisce la sorgente termica (fig 2).
Figura 2
Rispetto alle altre tecniche, l'energia erogata è inferiore (2-4 W), il che assicura maggiore precisione. In genere, vengono inserite due fibre ottiche per amplificare l'area ablativa, utilizzando due possibili approcci, trans-istmico o longitudinale. Gli applicatori vengono posizionati sullo stesso piano e distanziati di 8 mm per garantire un controllo sincrono delle fibre. L'ablazione inizia dalle zone più remote del nodulo rispetto al punto di ingresso della fibra ottica, ed è possibile completare l'ablazione mediante un movimento di retrazione delle fibre ("pull-back"), coinvolgendo in sequenza le aree prossimali (6).
La procedura viene eseguita in ambulatorio e richiede 15-30 minuti.
Il costo medio di un generatore laser a diodi, senza l'attrezzatura ecografica, è di circa € 30.000 (ma è spesso ceduto in comodato d'uso), mentre il costo del materiale mono-uso (fibra ottica e ago introduttore) varia da 300 a 500 €.
2.2. Radiofrequenza
Questa tecnica sfrutta una corrente elettrica alternata - con frequenza tra 200 e 1200 kHz - che riscalda un ago-elettrodo raffreddato internamente, che viene inserito nella lesione (fig 3).
Figura 3
Il raffreddamento interno protegge il tessuto sano circostante e agevola la diffusione del calore, riducendo l'impedenza del tessuto. La corrente alternata genera un movimento di ioni all'interno del tessuto che, seguendo il flusso alternato, produce calore per attrito (7) (fig 4).

Figura 4
A formare il circuito elettrico concorrono (fig 5):
- ago-elettrodo di 7-10 cm e 17-19 G
- generatore di corrente alternata
- piastre di messa a terra, posizionate su entrambe le cosce del paziente, che servono a chiudere il circuito elettrico.
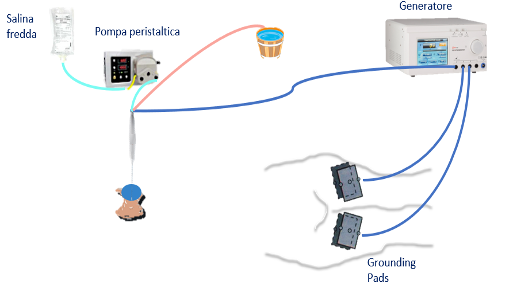
Figura 5
I portatori di pace-maker e le donne in gravidanza non sono pertanto candidabili a questa procedura.
La discrepanza tra la piccola superficie dell'ago e l'ampia area delle piastre di messa a terra fa sì che il calore generato sia concentrato attorno all'ago-elettrodo. Una pompa peristaltica spinge la soluzione salina fredda nell'ago per raffreddarlo, quindi l'acqua riscaldata viene scaricata.
La tecnica moving shot utilizza sempre un approccio trans-istmico. Il nodulo viene idealmente suddiviso in multiple piccole subunità ("unità di ablazione") e l’ago - inizialmente posizionato nell'unita più profonda e posteriore del nodulo – viene progressivamente retratto fino alle porzioni più superficiali. La comparsa di segnali iperecogeni vicino alla punta dell'elettrodo indica lo sviluppo di alterazioni tissutali, mentre un ripido aumento dell'impedenza del tessuto dimostra la realizzazione di necrosi tissutale.
Il trattamento viene eseguito in regime extra-ricovero e richiede 15-40 minuti.
Il costo medio di un generatore di onde di radio-frequenza varia da 20.000 a 35.000 €, mentre il costo del materiale mono-uso (ago-elettrodo) varia da 700 a 1200 €.
2.3. Micro-onde
Questa tecnica di ablazione si basa su un campo magnetico generato attorno al segmento radiante – un ago definito antenna - che induce la rotazione delle molecole di H2O a frequenze di 900-2500 MHz, generando quindi, come per la radio-frequenza, il calore per attrito (fig 6).
Figura 6
L’antenna è lunga nella maggior parte dei casi 10 cm, con diametro di 16-18 G. Non essendo un circuito elettrico chiuso, a differenza della radio-frequenza, non vi è controindicazione per pazienti gravide o portatori di pace-maker.
La tecnica utilizzata, chiamata modified multishot technique, segue anch’essa un approccio trans-istmico. L’antenna a micro-onde produce un’area di ablazione di diametro maggiore rispetto alla radio-frequenza. L’antenna viene quindi posizionata in profondità all’interno del nodulo e poi spostata con movimento “a ventaglio”, con un minor numero di riposizionamenti dell'ago.
Il trattamento viene eseguito in regime ambulatoriale e dura 10-20 minuti.
Il costo medio di un generatore di micro-onde varia da 20.000 a 25.000 €, mentre il costo del materiale mono-uso (ago-elettrodo) varia da 900 a 1300 €.
2.4. HIFU (High-Intensity Focused Ultrasound)
È l’unica tecnica ablativa completamente non invasiva e che non richiede la penetrazione di aghi attraverso la cute. Concentra ultrasuoni ad alta intensità su una specifica lesione bersaglio, inducendo necrosi coagulativa tramite la combinazione di danno meccanico e termico. L'effetto termico è raggiunto tramite la vibrazione del tessuto che genera, anche in questo caso, calore per frizione.
La procedura è guidata da un computer collegato a un elemento sia emittente che rilevante ultrasuoni (fig 7) e può essere eseguita, tramite uno schermo con funzione touch, da un operatore senza esperienza nell’ambito dell’interventistica tiroidea.
Figura 7
L’ingresso degli ultrasuoni attraverso la cute deve essere scarsamente collimato, per evitare la formazione di ustioni. Questo aspetto limita l’impiego dell’HIFU nelle lesioni molto superficiali o troppo profonde.
La procedura viene eseguita in ambulatorio e noduli di grandi dimensioni (> 5 cm) richiedono generalmente trattamenti multipli.
Il metodo è costoso (il costo medio di un generatore di onde supera i 250.000 €, mentre il kit di materiali mono-uso costa circa 500 €) e richiede un paziente praticamente immobile per tutta la durata della procedura, che per noduli di media dimensioni - ad esempio 15 mL - può arrivare anche a 20-40 minuti, oltre a una precisa definizione dell'area bersaglio da trattare che escluda le strutture critiche circostanti.
3. INDICAZIONI, CHECK-LIST, MOVING SHOT e FOLLOW-UP
3.1. Indicazioni
Le tecniche termo-ablative trovano la loro principale applicazione nella gestione dei noduli tiroidei benigni sintomatici. Le principali linee guida (LG) sulla termo-ablazione sono quelle Sudcoreane del 2017 (8), Europee del 2020 (9), la Consensus internazionale del 2021 (10) e un recentissimo Consensus Statement dell’American Thyroid Association (11).
Nell’ambito della patologia nodulare tiroidea benigna, la presenza di sintomi compressivi o problematiche estetiche costituisce l’indicazione al trattamento, dal momento che noduli di dimensioni simili possono causare sintomi variabili in pazienti diversi, in rapporto a:
- body mass index (BMI)
- circonferenza del collo
- localizzazione del nodulo (es. istmo)
- suscettibilità individuale.
Le LG coreane del 2017 (8) suggeriscono un diametro maggiore del nodulo non < 20-30 mm. Al contrario, non c'è un diametro massimo suggerito, anche se maggiori le dimensioni del nodulo, maggiore la probabilità che saranno necessari ulteriori trattamenti nel corso del tempo. La procedura può essere considerata anche in noduli di dimensioni > 20 mm che continuano a crescere in modo costante, anticipando la comparsa dei sintomi compressivi e delle problematiche estetiche.
Nel tentativo di standardizzare sintomi e cosmesi, i colleghi coreani hanno introdotto dei punteggi:
- il punteggio sintomatico può essere stabilito dal paziente, usando una scala visiva analogica (VAS), che va da 0 (nessun sintomo) a 10 (sintomi massimi);
- il punteggio estetico viene stabilito dal medico come dettagliato in tabella 2.
| Tabella 2 Punteggio cosmetico |
| 1. Massa non palpabile |
| 2. Massa palpabile senza problema estetico |
| 3. Problema estetico evidente solo con la deglutizione |
| 4. Evidente problema estetico |
L’European Thyroid Association (ETA) ha formulato nel 2020 le raccomandazioni per la termo-ablazione del nodulo tiroideo benigno al fine di colmare l’assenza di una LG europea, una delle principali cause di limitata diffusione delle tecniche termo-ablative (12).
La tabella 3 riporta le raccomandazioni riguardanti le indicazioni alla termo-ablazione che forniscono la guida per la pratica clinica.
| Tabella 3 Raccomandazioni delle linee guida ETA (1 = forte; 2 = debole o suggerimento) Evidenza di qualità: ØOOO molto bassa, ØØOO bassa, ØØØO moderata, ØØØØ alta |
|
| R 1 | Nei pazienti adulti con noduli benigni della tiroide che causano sintomi da compressione e/o disturbi di natura estetica e che rifiutano la chirurgia, la TA dovrebbe essere considerata come un'opzione con rapporto rischio-costo/beneficio efficace rispetto alla sola osservazione o al trattamento chirurgico (1, ØØOO). |
| R 2 | Sconsigliamo l'uso della TA per lesioni tiroidee benigne asintomatiche (1, ØØØO). |
| R 3 | È necessaria una diagnosi di citologia benigna del nodulo prima del trattamento con TA; è consigliata la ripetizione della citologia per noduli citologicamente benigni, ad eccezione dei noduli spongiformi e delle lesioni cistiche pure (EU-TIRADS classe 2); è comunque sconsigliata la TA per noduli con citologia benigna ma caratteristiche ecografiche di alto rischio (EU-TIRADS classe 5) (1, ØØØO). |
| R 4 | I pazienti devono essere accuratamente informati prima della TA, sia a voce che per iscritto, circa le diverse opzioni di trattamento, la loro potenziale efficacia e gli effetti collaterali, le alternative terapeutiche e la necessità di essere collaboranti durante il trattamento (1, ØOOO). |
| R 5 | Prima della TA devono essere valutate la funzione tiroidea e le corde vocali, le comorbilità e le contro-indicazioni al trattamento; la laringoscopia è raccomandata nei pazienti con raucedine, precedente chirurgia del collo, o con noduli vicino a strutture critiche (1, ØØOO). |
| R 6 | Prima della TA è raccomandata l’esecuzione di anestesia locale sotto-cutanea e peri-capsulare; può essere presa in considerazione lieve sedazione cosciente, specialmente in caso di trattamento con ultrasuoni focalizzati ad alta intensità (HIFU) (1,ØØOO). |
| R 7 | Al termine della procedura, si raccomanda valutazione clinica ed ecografica per escludere potenziali effetti avversi peri-procedurali e per definire l'estensione della zona ablata; nel caso compaiano dolore severo, tumefazione locale o febbre, i pazienti dovranno essere istruiti a tornare in anticipo per una valutazione clinica ed ecografica (1, ØØOO). |
| R 8 | Sono raccomandate valutazioni cliniche, biochimiche ed ecografiche a breve (3 mesi) e medio termine (6 e 12 mesi); in assenza di sintomi, è consigliato un follow-up a lungo termine ogni 1-2 anni al fine di rivelare un’eventuale ricrescita (1, ØØOO). |
| R 9 | Sulla base di studi di confronto diretto e di un bilancio tra efficacia ed effetti collaterali, laser (LTA) e radiofrequenza (RFA) sono raccomandate come modalità di trattamento TA di prima linea (ØØOO). |
| R 10 | Sulla base degli studi finora condotti, la TA con micro-onde (MWA) dovrebbe attualmente essere considerata una procedura di seconda linea in pazienti che rifiutano altre procedure di TA, o per i partecipanti a studi clinici (1, ØØOO). |
| R 11 | Sulla base della minore efficacia, dei costi più elevati e della limitata esperienza rispetto a RFA e LTA, HIFU dovrebbe essere considerata solo in casi selezionati di pazienti che non sono adatti o rifiutino altre procedure di TA e per i partecipanti a protocolli clinici (1, ØØOO). |
| R 12 | Nel gozzo multi-nodulare, a causa della mancanza di prove di efficacia e della probabile necessità di un trattamento ripetuto, la TA dovrebbe essere limitata ai pazienti con un nodulo dominante ben definito o a quelli che non sono candidati a chirurgia o a trattamento RAI, come opzione di terapia palliativa (1, ØØOO). |
| R 13 | A causa dei costi e della complessità più elevati, rispetto all'ago-aspirato e alla PEI, le procedure di TA non sono raccomandate come trattamento di prima linea per le lesioni cistiche pure o prevalentemente cistiche (1, ØØØO). |
| R 14 | LTA e RFA devono essere considerate opzioni terapeutiche per le lesioni cistiche che recidivano dopo PEI e per quei pazienti che restano sintomatici a causa di una rilevante componente solida residua (1, ØØØO). |
| R 15 | Sconsigliamo la TA come trattamento di prima linea per i noduli autonomi di grandi dimensioni; a causa del basso tasso di ripristino della normale funzione tiroidea, la TA dovrebbe essere considerata solo per i pazienti che rifiutano o non sono candidati a RAI o intervento chirurgico (1, ØØØO). |
| R 16 | La TA deve essere considerata nei giovani pazienti con noduli autonomi piccoli e soppressione incompleta del tessuto tiroideo peri-nodulare, data la maggiore probabilità di normalizzazione della funzione tiroidea e il vantaggio di evitare l'irradiazione e limitare il rischio di ipotiroidismo tardivo (1, ØØOO). |
| R 17 | Il trattamento combinato con LTA o RFA + RAI può essere considerato in pazienti selezionati con noduli autonomi di grandi dimensioni che causano sintomi da compressione locale, al fine di ottenere una più rapida riduzione del volume e l'uso di una minore attività RAI (2, ØØOO). |
3.2. Check-list pre-procedurale
Nonostante alcune discrepanze tra le diverse LG di riferimento, le check-list per la procedura di ablazione sono simili per la maggior parte degli elementi considerati.
La valutazione pre-procedurale del paziente deve includere la dimostrazione della natura benigna del nodulo, con due successivi esami citologici. Nel caso di noduli con chiare caratteristiche ecografiche di benignità - come quelli interamente cistici o spongiformi - e nei noduli iperfunzionanti è sufficiente un solo ago-aspirato (FNAB) con risultato benigno. La più recente Consensus internazionale prevede che l’ago-aspirato possa essere risparmiato nei noduli funzionalmente autonomi.
Gli esperti sudcoreani impiegano la core-needle biopsy (CNB) come metodo di valutazione micro-istologica dei noduli candidati alla termo-ablazione. Nella tabella seguente sono elencati altri elementi fondamentali che compongono la valutazione pre-procedurale (tab 4).
| Tabella 4 Valutazione pre-procedurale |
|
| Clinica | Punteggio sintomatico ed estetico. |
| Ecografia | Ecocolor-doppler tiroideo. |
| Laboratorio | Emocromo. Profilo coagulativo. Funzione tiroidea. |
| Citologia | Di regola ≥ 2 FNAB/CNB con risultato di benignità. Se lesione con caratteristiche altamente suggestive di benignità o nodulo funzionalmente autonomo ≥ 1 FNAB/CNB. |
| Valutazione ORL | Laringoscopia raccomandata se precedente chirurgia cervicale o anomalie fonatorie. |
| TC/RM | In casi selezionati. |
| Scintigrafia | Se sospetto nodulo iperfunzionante |
Terapia anti-aggregante/anti-coagulante
I pazienti in terapia anti-aggregante o anti-coagulante devono interromperla tempestivamente prima dell’ablazione. La tabella 5 riassume lo schema di sospensione (1,8,10,11). Nei giorni di sospensione della terapia orale, può essere presa in considerazione una terapia con eparina.
| Tabella 5 Anti-coagulanti e anti-aggreganti |
|
| Categoria | Sospensione prima della procedura (giorni) |
| Anti-aggreganti (ASA, clopidogrel) | 7-10 |
| Warfarin | 5 |
| NAO (apixaban, dabigatran, endoxaban, rivaroxaban) | 1-2 |
In assenza di complicanze, la terapia anti-coagulante può essere ripresa entro 24 ore dalla procedura.
Ecocolor-doppler della tiroide
Ha un ruolo fondamentale nella valutazione pre-trattamento.
L’esame deve valutare il volume iniziale del nodulo (per un trattamento efficace è consigliabile che non superi i 30 mL, sebbene operatori esperti possano trattare noduli fino a 100 mL) e fornisce il punto di riferimento per il follow-up.
La valutazione della vascolarizzazione fornisce indicazioni utili per alcune azioni tecniche, come l’ablazione del ramo arterioso principale, quando ben visibile, per interrompere l’apporto sanguigno al nodulo e ridurne la probabilità di ricrescita nel tempo. Anche l’ablazione delle vene marginali peri-nodulari, visibili all’eco-doppler durante la valutazione pre-procedurale, può ridurre in maniera drastica la ricrescita nodulare.
La localizzazione dei punti di repere anatomici riveste importanza cruciale per valutare la fattibilità dell'intervento. È necessario considerare un’adeguata distanza della zona da trattare dal solco tracheo-esofageo o dalla zona critica dove decorre il nervo laringeo ricorrente (danger triangle). Inoltre, è necessario individuare la vena giugulare anteriore, principale causa di ematomi se perforata, il nervo vago e la catena simpatica (fig 8). Queste informazioni consentono di pianificare e condurre la procedura in modo sicuro ed efficace.
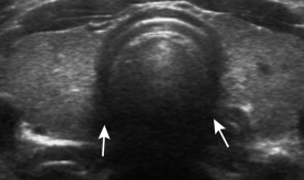
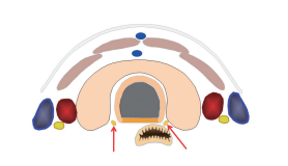
Figura 8
3.3. Approccio trans-istmico e moving-shot
Sono aspetti tecnici fondamentali per l’esecuzione dell’ablazione tramite radio-frequenza o micro-onde.
Per approccio trans-istmico si intende l'inserimento di un ago-elettrodo o antenna tramite l'istmo della tiroide, in direzione mediana-laterale. Tale approccio dà diversi vantaggi:
- in primo luogo, l'operatore può monitorare al meglio le posizioni dell'elettrodo, del nodulo bersaglio e del danger triangle;
- in secondo luogo, il parenchima istmico normale frapposto tra il nodulo bersaglio e il sito di inserimento dell'elettrodo crea un’area di sicurezza fra il bersaglio ablato caldo e l’area peri-tiroidea, riducendo complicanze ed effetti collaterali, quali l’ustione di cute e sottocute o il dolore;
- infine, la posizione dell'elettrodo rimane pressoché stabile anche qualora il paziente parlasse o tossisse.
La tecnica "moving shot" permette invece l’applicazione dinamica e controllata dell'energia termica. Differentemente dalla termo-ablazione utilizzata in altri organi come il fegato, dove la punta attiva dell'elettrodo resta fissa al centro del tumore bersaglio durante tutta la procedura, nei noduli tiroidei, che sono ellissoidali e spesso esofitici rispetto alla ghiandola tiroidea, utilizzare la tecnica fissa potrebbe sotto-trattare o sovra-trattare aree del nodulo e del tessuto circostante. Pertanto, il nodulo tiroideo viene suddiviso in diverse piccole unità di ablazione. Queste unità possono essere poi trattate singolarmente partendo da quelle più profonde, e cioè posizionando l’ago-elettrodo dapprima nella porzione più posteriore del nodulo e poi retraendolo via via (con movimenti definiti “moving shot”), ablando unità per unità, fino alle porzioni più superficiali (fig 9).
Figura 9
3.4. Check-list post-procedurale
La valutazione si concentra sul controllo ecografico post-ablazione, che può essere eseguito dopo 1-24 ore.
Nel sospetto di danno al nervo laringeo ricorrente, in seguito alla percezione di voce rauca o bitonale del paziente invitato a parlare, è fondamentale la valutazione foniatrica (tab 6).
Per il controllo del dolore peri- e post-procedurale sono utili FANS e paracetamolo per 24–48 ore. Antibiotici e steroidi non sono raccomandati in maniera routinaria, ma un breve ciclo di cortisone, per os o parenterale, può efficacemente ridurre l’edema dopo l’ablazione.
| Tabella 6 Dopo la procedura |
|
| Cosa | Quando, cosa e perché |
| Ecografia | Verificare area ablata (doppler, CEUS) per eventuali ri-trattamenti. Valutare potenziali effetti avversi precoci. |
| Impacco con ghiaccio | |
| Anti-dolorifici | FANS (sia prima che dopo la procedura). Paracetamolo nelle successive 24-48 h. Non indicati di routine steroidi e antibiotici. |
| Valutazione fonazione | Se si sospetta danno del nervo ricorrente. |
| Osservazione pre-dimissione |
Per 30-60 minuti per valutare eventuali effetti avversi precoci:
|
3.5. Follow-up e misure di efficacia del trattamento
Il beneficio in termini di riduzione volumetrica del nodulo non è immediato. A 24-48 ore dalla procedura è possibile un minimo incremento volumetrico del nodulo trattato, dovuto allo sviluppo di una quota infiltrativa-edematosa.
Nel corso dei mesi il volume del nodulo si riduce progressivamente, con un sensibile decremento già a tre mesi dalla procedura. La riduzione continua nel tempo, anche nel corso di alcuni anni (13) (fig 10).
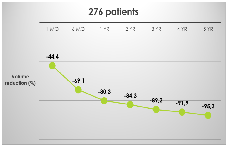
Figura 10
La procedura può essere ritenuta di successo se raggiunge una riduzione volumetrica (volume reduction rate, VRR) di almeno il 50%. A prescindere dalla riduzione volumetrica della lesione, la scomparsa dei sintomi compressivi e dei disturbi cosmetici costituisce un possibile parametro di esito della procedura.
Fra le misura di efficacia del trattamento, oltre al VRR e al miglioramento dei punteggi sintomatici ed estetici, è appropriato l’impiego di questionari di qualità della vita per pazienti tireopatici, come SF-36 o ThyPro/ThyPro39.
Nel corso del follow-up è necessario valutare ogni 6–12 mesi la funzione tiroidea (dosaggio di TSH e FT4), anche se il trattamento generalmente non la danneggia.
Nel follow-up dei noduli iperfunzionanti sottoposti a termo-ablazione considerare anche l’utilizzo della scintigrafia con 99Tc. Il raggiungimento dell’eutiroidismo o la riduzione del dosaggio dei farmaci anti-tiroidei possono ovviamente essere considerati una misura di efficacia (tab 7).
| Tabella 7 Procedure di follow-up per noduli benigni |
||||
| < 3 mesi | 3-6 mesi | ≈ 12 mesi | ||
| Non funzionanti | Volume nodulare (VRR) | x | x | x |
| Punteggio sintomatico | x | x | x | |
| Punteggio estetico | x | x | x | |
| Funzione tiroidea | x | x | ||
| TC/RM | x** | |||
| Funzionanti | Volume nodulare (VRR) | x | x | x |
| Punteggio sintomatico | x | x | x | |
| Funzione tiroidea | x | x | x | |
| Scintigrafia | x* | x* | ||
| *Da considerare, ma non obbligatorio **Solo in casi particolari |
||||
4. EFFETTI COLLATERALI E POSSIBILI COMPLICANZE
4.1. Curva di apprendimento
Requisito fondamentale prima di intraprendere la termo-ablazione tiroidea è una solida esperienza specifica nell'ambito dell'ecografia e dell'interventistica diagnostica tiroidea. È inoltre importante l’acquisizione di esperienza delle procedure di ago-aspirazione e alcoolizzazione con l'approccio trans-istmico.
Attualmente, data l'assenza di percorsi didattici validati e riconosciuti, è consigliabile partecipare regolarmente a workshop che offrano sessioni di "hands-on training", unitamente all'osservazione diretta di procedure eseguite da operatori esperti (11).
Le prime procedure devono essere eseguite sotto la guida di un collega esperto. È dimostrato che il tasso di complicanze è ridotto quando la procedura è eseguita da operatori esperti (14). Dati francesi dimostrano come con l’acquisizione di esperienza da parte dell’operatore il VRR aumenti dopo un anno dall’inizio dell’esecuzione delle procedure. Il cut-off è individuabile intorno alle 50 procedure eseguite (figura 11).
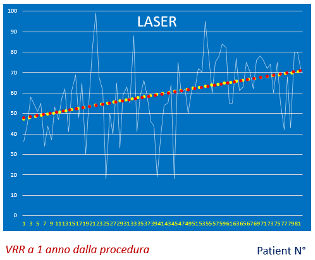
Figura 11
Il grafico mostra l’aumento del VRR (in ordinata) a un anno dal trattamento rispetto al numero di casi trattati (in ascissa) (dati di Gilles Russ, La Pitie-Salpetriere, Parigi).
4.2. Effetti collaterali e complicanze
La figura 12 presenta le principali complicanze ed effetti collaterali delle procedure di termo-ablazione, suddivisi in base al periodo di insorgenza.
La complicanza più frequente è la disfunzione laringea, causata dal danneggiamento (transitorio o, più raramente, permanente) del nervo laringeo ricorrente. Il danno porta alla paralisi dei muscoli intrinseci della laringe, eccetto i muscoli crico-tiroidei. Il paziente sperimenta raucedine e cambiamenti nel timbro vocale. Oltre al danno termico diretto durante la termo-ablazione, altri meccanismi possono contribuire alla sofferenza del nervo ricorrente, manifestandosi nelle ore successive alla procedura: lo "stunning" del nervo dovuto alla lidocaina, il suo stiramento/compressione in seguito alla formazione di un ematoma, l'infiammazione post-emorragica con la fibrosi che si sviluppa intorno al nervo.
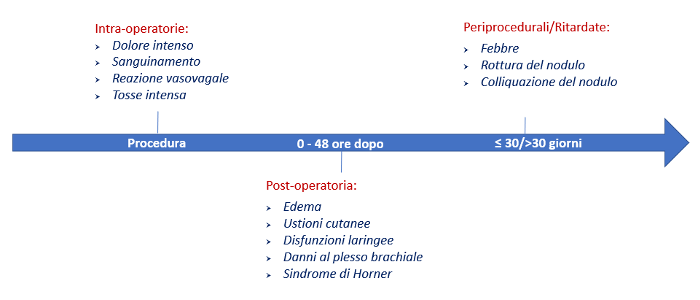
Figura 12
Queste complicanze si manifestano in circa il 5% dei pazienti: nella maggior parte dei casi sono transitorie, con recupero spontaneo dopo pochi mesi e senza speciali trattamenti.
In caso di noduli che si trovino a ridosso della zona di pericolo, per la protezione del nervo laringeo ricorrente è utile l’idro-dissezione mediante iniezione di destrosio 5% tra la “danger zone” e l'area da trattare (figura 13).
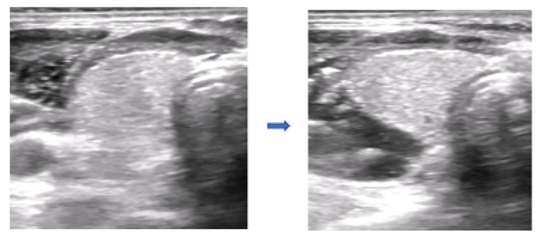
Figura 13
Idro-dissezione posteriore.
Per dimostrare l’entità del danno ricorrenziale è necessaria la laringoscopia. Il recupero può essere accelerato da cicli di prednisone e rieducazione foniatrica.
5. MODIFICAZIONI ISTOLOGICHE INDOTTE DAL TRATTAMENTO TERMO-ABLATIVO
Pochi studi hanno esaminato i cambiamenti istologici dei noduli tiroidei trattati con radio-frequenza. Spiccano la fibrosi (figura 14) e l’infiammazione cronica. Altri reperti possono includere reazione istiocitaria, infarto, emorragia, proliferazione di fibroblasti, accumulo di pigmento nero, calcificazioni, reazioni giganto-cellulari di tipo corpo estraneo, granulomi di colesterolo e formazione di cavità centrali. Questi aspetti sono circoscritti all'area sottoposta all'ablazione, mentre il parenchima tiroideo adiacente alla lesione e il resto della ghiandola mantengono la morfologia normale.
Figura 14
Effetto dell’ablazione con radio-frequenza su un nodulo follicolare benigno. Ialinizzazione cellulare densa (freccia nera) e lesione follicolare residua (freccia rossa) (colorazione con ematossilina-eosina ×40)
Non vi sono evidenze che la termo-ablazione possa avere un effetto cancerogeno sulla ghiandola tiroidea, come dimostrato dal follow-up a 10 anni dal trattamento.
6. INFORMAZIONI PER IL PAZIENTE E MODULO DI CONSENSO
Il paziente deve essere attentamente informato, oralmente e per iscritto, circa:
- le varie opzioni di gestione disponibili, tra cui l’osservazione, la termo-ablazione e l’intervento chirurgico;
- i vantaggi e limiti delle diverse procedure;
- le modalità tecniche del trattamento termo-ablativo e la necessità di compliance;
- le potenziali complicanze;
- la diminuzione prevista delle dimensioni del nodulo, solitamente senza completa scomparsa;
- l’eventuale ricrescita nel tempo, con necessità di ulteriori trattamenti (termo-ablativi o chirurgici);
- la necessità di follow-up a lungo termine.
Un modello di consenso informato, che integra le indicazioni delle LG europee con quelle dell’ultima consensus internazionale (1,10) è scaricabile a questo link.
7. FENOTIPI TIROIDEI E RISULTATI DELLA TERMO-ABLAZIONE
7.1. NODULI SOLIDI
LTA
Efficacia: è stata documentata a breve e lungo termine in una serie di studi che riportano una riduzione media del volume tra il 59% e l’84% a 12 mesi e del 51-58% a 36 mesi. Una minoranza (5-9%) di noduli trattati mostra una significativa ricrescita entro 3 anni. Come per le altre tecniche di TA, la struttura del nodulo (totalmente vs prevalentemente solido, ben delimitato vs sfumato) può influenzare i risultati a lungo termine: i risultati più favorevoli sono descritti nei noduli spongiformi e misti, rispetto ai noduli completamente solidi. La LTA porta al miglioramento dei problemi estetici e dei sintomi locali nella maggior parte dei pazienti.
Complicanze. La tollerabilità è buona: nel 12-30% delle procedure si sono verificati effetti collaterali auto-limitanti (per lo più transitorio dolore al collo). Sono state raramente (0.5%) osservate complicanze maggiori, più frequenti quando il nodulo bersaglio è localizzato in una "zona di pericolo", vicino alla porzione infero-mediale del lobo tiroideo. Questa zona della tiroide, vicina alla trachea, dovrebbe essere accuratamente evitata durante il trattamento. Complicanze minori (ematomi sub-capsulari e peri-tiroidei e ustioni cutanee) sono riportate nello 0.5% dei pazienti. È stato descritto un caso di "rottura del nodulo", dato dalla rottura della capsula tiroidea anteriore, con formazione di una raccolta di liquido nella parte anteriore del collo, che può potenzialmente richiedere un drenaggio chirurgico. Anomalie della funzione tiroidea post-trattamento sono state riportate solo aneddoticamente.
Qualità di vita (QoL): non vi sono numerosi studi a proposito, ma in quelli disponibili ne è stato dimostrato il miglioramento.
RFA
Efficacia: la riduzione media di volume è del 68-78% a 12 mesi e del 67% a 5 anni. Come regola generale, più piccolo è il nodulo trattato, maggiore è la riduzione di volume e, come per la LTA, rispondono meglio i noduli spongiformi e misti. La RFA migliora sia i sintomi da compressione che quelli cosmetici.
Complicanze: quelle gravi sono rare, così come la "rottura del nodulo"; ematomi, ustioni cutanee, dolore persistente, reazioni vagali e vomito sono le complicanze minori più frequentemente descritte. Anomalie della funzione tiroidea post-trattamento sono state riportate solo aneddoticamente.
QoL: è stato dimostrato un miglioramento anche vs chirurgia.
MWA
Sono disponibili meno lavori, che comunque descrivono 75-90% di riduzione media dopo un anno. Attualmente, la MWA sembra associata a rischio più elevato di complicanze (maggiori e minori) rispetto a LTA e RFA per la maggiore potenza della tecnica e la difficoltà a definire con precisione l’area di ablazione nel corso della procedura.
HIFU
Efficacia: ancor meno sono gli studi con questa tecnica, che riportano una riduzione media del volume dal 43% al 70% a 24 mesi. È stata riportata una correlazione inversa tra il volume iniziale del nodulo e la sua percentuale di riduzione. Un recente studio multicentrico ha dimostrato una riduzione media a un anno pari al 35% circa.
Complicanze: non ne sono state riportate di importanti. Gli effetti collaterali più comuni sono dolore, che di solito diminuisce rapidamente, arrossamento della pelle e gonfiore sottocutaneo protratto. La funzione tiroidea non risulta influenzata. Il trattamento è talora mal tollerato per la durata prolungata e la necessità di immobilità.
QoL: gli studi sono limitati.
Confronto dei risultati delle diverse tecniche di TA per noduli tiroidei solidi benigni non funzionanti
I risultati delle procedure sono notevolmente influenzati dall'abilità specifica e dal periodo di formazione dei medici che le eseguono.
Gli studi che confrontano RFA e LTA suggeriscono efficacia clinica e sicurezza quasi similare delle 2 tecniche: alcuni lavori mostrano una simile riduzione media di volume dei noduli trattati a 6 e 12 mesi, mentre altri hanno mostrato una moderata superiorità di RFA.
Anche per quanto riguarda il confronto tra MWA e RFA, le 2 tecniche sono apparse altrettanto efficaci, con una lieve superiorità della RFA, ma la MWA è stata associata a un maggiore tasso di complicanze.
Non ci sono né studi prospettici randomizzati né studi di valutazione dell'efficacia e tollerabilità dell'HIFU rispetto alle altre tecniche.
7.2. NODULI CISTICI
La PEI è raccomandata come trattamento di prima linea per noduli tiroidei benigni cistici, basandosi su dati retrospettivi e studi prospettici che hanno dimostrato una riduzione del volume dei noduli dal 50% al 98%, parallelamente al miglioramento dei sintomi locali. Questi risultati favorevoli persistono fino a 5 anni. I principali fattori che influenzano negativamente l'efficacia tecnica della PEI sono:
- l’aumento delle dimensioni sia della parte solida che della componente cistica;
- il contenuto emorragico, che si riforma rapidamente dopo il drenaggio;
- la presenza di più camere cistiche all’interno del nodulo;
- il volume iniziale del nodulo > 10 mL;
- la vascolarizzazione crescente della lesione.
Per le lesioni cistiche recidivanti dopo PEI possono essere utilizzate, come seconda linea, LTA, RFA e MWA, previo drenaggio della componente fluida, di solito eseguita durante la stessa sessione. Non sono comunque disponibili molti studi riguardo l’utilizzo specifico di queste tecniche nei noduli cistici.
L'uso combinato di PEI più LTA o RFA si è dimostrato efficace in noduli cistici molto grandi e per quei noduli il cui trattamento risulterebbe incompleto con il solo utilizzo della PEI.
HIFU si basa su un approccio non invasivo che non consente il drenaggio delle raccolte di fluidi.
7.3. NODULI BENIGNI DELLA TIROIDE CON AUTONOMIA FUNZIONALE
I dati sulle TA nei noduli autonomi si basano principalmente sulle procedure di LTA e RFA. Le TA normalizzano quasi completamente la funzione tiroidea nei noduli di piccole dimensioni (ad esempio volume < 10 mL), con una notevole riduzione del volume (> 80%). Al contrario, la funzione tiroidea è controllata solo in una piccola percentuale dei noduli più grandi di questo cut-off.
Le tecniche TA sono quindi da considerarsi appropriate nei pazienti con noduli autonomi piccoli che rifiutano o non sono candidati alla chirurgia o alla terapia con RAI (per comorbilità, saturazione iodica o gravidanza).
Interessante è l’uso combinato di TA e RAI nei noduli autonomi di grandi dimensioni, con più rapido miglioramento dei sintomi locali, riduzione maggiore del volume nodulare e utilizzo di dose inferiore di RAI. Pertanto, la TA può essere utilizzata per gli adenomi tossici di grandi dimensioni soltanto per ottenere una riduzione di volume prima del trattamento RAI.
L’HIFU è meno efficace di RAI per il controllo dei noduli iperfunzionanti.
8. BIBLIOGRAFIA
- Papini E, Hegedüs L. Minimally invasive ablative treatments for benign thyroid nodules: current evidence and future directions. Thyroid 2023, 33: 890–3.
- Durante C, Costante G, Lucisano G, et al. The natural history of benign thyroid nodules. JAMA 2015, 313: 926-35.
- Linea guida su gestione del nodulo benigno della tiroide causa di sintomi locali. LG 174 del 6 aprile 2022. (versione breve).
- Pacella CM, Bizzarri G, Guglielmi R, et al. Thyroid tissue: US-guided percutaneous interstitial laser ablation - A feasibility study. Radiology 2000, 217: 673-7.
- Papi G, Novizio R, Brunetti M, Mauri G. Impact of the introduction of minimally invasive treatments of the thyroid (MITT) for benign thyroid nodules in an Italian hospital: a cost-minimization analysis. Endocrine 2023, 82: 126-33.
- Valcavi R, Riganti F, Bertani A, et al. Percutaneous laser ablation of cold benign thyroid nodules: a 3-year follow-up study in 122 patients. Thyroid 2010, 20: 1253-61.
- Goldberg SN. Radiofrequency tumor ablation: principles and techniques. Eur J Ultrasound 2001, 13: 129–47.
- Kim JH, Baek JH, Lim HK, et al. 2017 Thyroid radiofrequency ablation guideline: Korean Society of Thyroid Radiology. Korean J Radiol 2018, 19: 632-55.
- Papini E, Monpeyssen H, Frasoldati A, Hegedüs L. 2020 European Thyroid Association clinical practice guideline for the use of image-guided ablation in benign thyroid nodules. Eur Thyroid J 2020, 9: 172-85.
- Orloff LA, Noel JE, Stack BC, et al. Radiofrequency ablation and related ultrasound‐guided ablation technologies for treatment of benign and malignant thyroid disease: an international multidisciplinary consensus statement. Head Neck 2022, 44: 633–60.
- Sinclair CF, Baek JH, Hands KE, et al. General principles for the safe performance, training and adoption of ablation techniques for benign thyroid nodules: an American Thyroid Association statement. Thyroid 2023, DOI: 10.1089/thy.2023.0281.
- Hegedüs L, Frasoldati A, Negro R, Papini E. European Thyroid Association survey on use of minimally invasive techniques for thyroid nodules. Eur Thyroid J 2020, 9: 194–204.
- Jung SL, Baek JH, Lee JH, et al. Efficacy and safety of radiofrequency ablation for benign thyroid nodules. A prospective multicenter study. Korean J Radiol 2018, 19: 167-74.
- Baek JH, Lee JH, Sung JY, et al. Complications encountered in the treatment of benign thyroid nodules with us-guided radiofrequency ablation: a multicenter study. Radiology 2012, 262: 335-42.
Alcoolizzazione dei noduli tiroidei
Rinaldo Guglielmi1 & Andrea Frasoldati2
1Endocrinologia, Ospedale Regina Apostolorum, Albano Laziale (RM)
2Endocrinologia, Arcispedale S. Maria Nuova, Reggio Emilia
INTRODUZIONE
Da oltre 20 anni la sclerosi percutanea con alcool (PEI) viene impiegata nella terapia delle lesioni nodulari della tiroide (1-4); negli anni la metodica, considerabile un'estensione dell’agoaspirato ecoguidato, si è sempre più diffusa, dapprima in Europa e successivamente negli USA, tanto che attualmente è universalmente individuata come il trattamento non chirurgico di prima linea nella gestione delle cisti della tiroide (5,6). Inizialmente era stata introdotta nella pratica clinica per la scleroterapia delle cisti renali e delle lesioni maligne del fegato (7-10).
L’efficacia della tecnica è legata alla capacità dell’etanolo di provocare la sclerosi attraverso la disidratazione del tessuto trattato e la denaturazione proteica, che in ultima analisi portano alla necrosi coagulativa e alla trombosi dei vasi della zona interessata. Da questo quadro infiammatorio deriva l’infarcimento emorragico della zona trattata e la successiva fibrosi (11).
All’inizio del suo impiego nella pratica clinica, la PEI era stata proposta sia per la terapia dei noduli cistici della tiroide che dei noduli funzionalmente autonomi (AFTN); come vedremo nel paragrafo relativo quest’ultima indicazione nel tempo si è molto affievolita (6). L’alcool non è stata l’unica sostanza che è stata individuata per la sclerosi delle cisti; infatti, alcuni autori hanno proposto le tetracicline e agenti sclerosanti specifici (12,13). I risultati riportati sono abbastanza promettenti, ma l’uso di tali sostanze è rimasto confinato ai pochi centri che le hanno proposte.
La PEI viene suggerita anche in altre patologie che interessano il collo, come le cisti del dotto tireoglosso, le paratiroidi ingrandite e i linfonodi metastatici. Tali impieghi sono meno accettati e sono confinati a pochi centri.
NODULI CISTICI DELLA TIROIDE
I noduli prevalentemente cistici o francamente cistici rappresentano le lesioni nodulari ideali da trattare (5,6). La necessità del trattamento delle cisti è dovuto alla recidiva nella maggior parte dei casi di quelle sottoposte al semplice drenaggio (percentuale di successo dopo drenaggio: < 10%) (14).
Precauzioni
Non ci sono ulteriori precauzioni rispetto a quelle previste per l’agoaspirato tiroideo ecoguidato (FNAUS); il rischio di emorragia intra-parenchimale tiroidea è sostanzialmente lo stesso dell’FNAUS, per cui è necessario sospendere la terapia anti-coagulante per almeno 3-5 giorni prima dell’esame o nel caso in cui non sia possibile sospendere tale terapia, è necessario eseguire la procedura in corso di eparina a basso peso molecolare. Non è necessario il digiuno e può essere assunta qualsiasi altra terapia farmacologica. E’ buona pratica avere a disposizione due esami citologici negativi per malignità della lesione nodulare da trattare; in caso di noduli misti e pseudocistici bisogna avere l’accortezza di campionare la porzione solida e di inviare la porzione liquida al laboratorio di citologia, affinchè possa essere eseguita una valutazione citologica su sedimento del liquido drenato. L’esame convenzionale prevede il drenaggio della componente liquida e poi la puntura della porzione solida; questa tecnica porta ad un alto tasso di emorragia all’interno del nodulo e quindi ad un alto tasso di inadeguati citologici. Al fine di migliorare l’accuratezza dell’esame, sono state proposte varianti che prevedono prima la puntura della porzione solida e poi il drenaggio della componente liquida oppure l’impiego di aghi dedicati. Secondo tali autori, con tali accorgimenti viene riportata una percentuale di adeguatezza (94%) del tutto simile a quella dei noduli solidi (15).
Metodica
E' necessario far distendere il paziente in posizione supina con il capo iperesteso, inserendo un cuscino al di sotto del collo: si tratta della stessa posizione che viene suggerita per eseguire l’FNAUS. Prima della manovra viene ripetuto un esame ecografico della regione, per la valutazione volumetrica della lesione da trattare, dei suoi rapporti anatomici e per programmare la sede d’ingresso favorevole e il percorso dell’ago. Confermata l’indicazione alla procedura, bisogna disinfettare la cute e disporre un telo sterile a livello cervicale, lasciando libero spazio per la sonda ecografica e per l’ingresso di un ago. La sterilità deve essere assicurata anche per la sonda ecografica (applicare gel e coprire con parafilm) e per gli operatori (si consiglia l’uso di guanti sterili).
Se disponibili, è opportuno far indossare al paziente occhiali protettivi per evitare possibile contatto degli occhi con alcool.
In genere non è necessaria l’anestesia, salvo che non si tratti di condizioni in cui è necessario utilizzare aghi di grandezza superiore ai 22 gauge (18-19). Questa condizione si verifica in presenza di colloide troppo densa e difficile da drenare con i normali aghi utilizzati per l’agoaspirato.
Una volta eseguita la scansione ecografica, l’inserimento dell’ago (montato su siringa) può essere ecoguidato (necessità di “device” specifico) o ecoassistito (inserimento a mano libera sotto controllo ecografico). I dati disponibili al momento non permettono di chiarire se un approccio è superiore all’altro: è consigliabile pertanto utilizzare l’approccio con cui si ha maggiore familiarità nella propria esperienza di agoaspirazione. L’estrazione della componente liquida può essere facilitato dalla suzione utilizzando una pistola dedicata (es. Cameco). Prima che la cavità diventi virtuale e sia difficile visualizzare la punta dell’ago, bisogna terminare il drenaggio. A questo punto inizia l’inserimento dell’alcool sterile (fiale da 10 mL di alcool al 95%), che viene iniettato con pressione lenta; si visualizza la nuvola iperecoica dovuta al flusso dell’acool che lentamente riempie la cisti. La quota di alcool introdotta corrisponde solitamente al 25-50% del volume iniziale del nodulo, con un massimo di 10 mL. Una volta terminata l’infusione di alcool, prima di estrarre l’ago, si sostituisce la siringa con l’alcool con una siringa con 5 mL di lidocaina, che viene lentamente infusa nell’atto di retrarre l’ago, in modo tale da impedire la retrodiffusione dell’alcool nel parenchima tiroideo ed evitare il dolore conseguente.
Alcuni autori suggeriscono il drenaggio dell’alcool, dopo alcuni minuti dalla manovra, al fine di evitare possibili spandimenti dell’alcool al di fuori della cisti, mentre altri preferiscono che l’alcool sia mantenuto all’interno della cisti al fine di prolungare l’effetto sclerosante. Non ci sono evidenze che un tipo di trattamento consenta risultati migliori dell'altro (16).
Bisogna avere alcune accortezze durante la manovra e più precisamente:
- il monitoraggio ecografico deve essere costante e stretta sorveglianza deve essere posta al punto di diffusione dell’alcool all’interno della cisti
- bisogna evitare l’inserimento troppo profondo dell’ago all’interno della cisti o il drenaggio del liquido fino a rendere virtuale la cavità. Tale precauzione consente di evitare il contatto dell’ago con la parete della cisti ed i possibili danneggiamenti della stessa con creazione di una possibile strada attraverso la quale, l’alcool possa defluire al di fuori dalla cisti
- se si incontrano resistenze durante l’infusione dell’alcool, si può fare un tentativo di riposizionamento dell’ago e, nel caso persista la difficoltà, è consigliabile sospendere la manovra.
Effetti collaterali
Gli effetti collaterali sono abbastanza contenuti e ben descritti in letteratura.
Il dolore è minimo e può essere contenuto da banali analgesici nelle 12-24 h successive al trattamento. La maggior parte dei pazienti, se interrogati sulla manovra, affermano che la tecnica è assolutamente tollerabile e si dicono disponibili, se fosse necessario, per ulteriori manovre (17). Adottando le precauzioni suddescritte, il rischio che l’alcool si espanda al di fuori della cisti è ridotto, grazie alla presenza frequente di capsula fibrosa che circonda la cisti e che funge da barriera (18). Inoltre il rischio si riduce ancora di più se l’alcool infuso viene drenato dopo alcuni minuti. Quando l’evento si verifica, la conseguenza maggiore è la fibrosi intorno alla cisti che può rendere più difficoltosa una successiva chirurgia. Nel caso la cisti sia posteriore, può aumentare il rischio di ipoparatiroidismo e di lesione dei nervi ricorrenti per contato diretto dell’alcool con le relative strutture anatomiche. Il rischio di paralisi transitoria del ricorrente è estremamente raro nel trattamento delle cisti.
Risultati
Le cisti vere e proprie sono molto rare (< 1%), mentre la maggior parte sono pseudocisti: per ottenere una riduzione significativa sarebbe auspicabile trattare lesioni con componente cistica pari ad almeno il 40-50% del volume totale. Il numero di trattamenti varia da 1 a 4, con mediana di 2 (17).
La riduzione media di volume varia dal 60 al 90%, con un tasso mediano di successo dell’85%. Oltre che in termini volumetrici, i risultati sono stati valutati come riduzione dei disturbi compressivi locali e come miglioramento dell’aspetto estetico. Molte sono state le scale di valutazione utilizzate per rendere il più oggettiva possibile la valutazione, ma da un punto di vista pratico si può dire che il miglioramento di tali parametri correla in modo abbastanza lineare con la riduzione volumetrica del nodulo (19). Analogamente a quanto accade per le dimensioni delle lesioni pseudocistiche, anche per i disturbi cosmetici la probabilità di successo è sporadica con il semplice drenaggio della cisti (20, 21).
La possibilità di successo è elevata anche in lesioni molto grandi (> 30 mL). Infatti, anche se i risultati tra cisti di diverse grandezze non sono completamente sovrapponibili, il volume finale non correla precisamente con il volume iniziale della lesione cistica. Fattori che più influenzano la risposta in termini volumetrici sono la percentuale di componente solida e la pluriconcameralità. La pluriconcameralità porta a un tasso di successo non superiore al 60-65% vs un tasso di circa il 90% delle lesioni “francamente” cistiche(17, 22).
Da un punto di vista pratico possiamo dire che tanto maggiore è la porzione liquida del nodulo (e quindi drenabile) e tanto maggiore sarà la riduzione del volume della lesione.
Altro fattore determinante è la viscosità della componente liquida: questa si riflette sulla possibilità di un completo drenaggio della cisti. In genere questa caratteristica viene registrata in fase preparatoria (durante l’agoaspirato); alcuni autori hanno suggerito di trattare comunque queste cisti mediante l’inserimento di piccolissime quantità di alcool, in una fase preparatoria, al fine di modificare le caratteristiche fisiche, riducendo la densità e la viscosità del liquido. In una successiva sessione a distanza di 15-20 giorni è possibile, nella maggioranza di tali cisti, aspirare quasi completamente la componente fluida ed eseguire la manovra (23).
Il risultato è stabile nel tempo ed il tasso di recidiva della cisti è inferiore al 10% (15,18).
NODULI TIROIDEI FUNZIONALMENTE AUTONOMI (AFTN)
Inizialmente la PEI era stata proposta in alternativa alla chirurgia e al trattamento con radioiodio per gli AFTN (2-4), ma con l’accumularsi di dati controversi in letteratura l’interesse per questo tipo di impiego si è notevolmente ridotto ed al momento le indicazioni sono molto limitate (6,7).
Preparazione: sovrapponibile a quella per i noduli cistici
Metodica
Gli AFTN di solito sono solidi e quando c’è una conponente liquida, è abbastanza limitata. La tecnica è del tutto sovrapponibile a quella descritta precedentemente quando si tratta la porzione liquida, mentre le differenze sono dovute al trattamento della porzione solida: si incontra una maggiore resistenza nell'infusione di alcool e nelle singole sessioni la quantità di alcool infusa, rispetto al volume del nodulo, è percentualmente minore che nei noduli francamente cistici. Questo dato porta ad un numero sostanzialmente più elevato di sessioni per ottenere una riduzione significativa del volume e della funzione del nodulo. La valutazione del successo viene definita con criteri dimensionali e con la dosabilità del TSH. Di aiuto può essere la valutazione con color-doppler post-terapia, che mostra scomparsa del segnale presente prima della manovra nelle aree trattate (4, 24). Il numero riportato di sessioni va da 2 a 7 con una mediana doppia (4 sessioni) rispetto ai noduli cistici (17).
Risultati
A metà degli anni '90 lo studio multicentrico italiano (24) dimostrò che il tasso di successo era maggiore nei noduli pretossici (83%) che non nei noduli francamente tossici (66%) e tali dati sono stati confermati negli studi successivi (17).
A differenza di quanto accade per i noduli cistici, il risultato finale è influenzato in modo significativo dal volume iniziale degli AFTN (2-4,17,24,26,27).
Problema clinico significativo è il volume critico al di sotto del quale proporre la tecnica; su tale argomento gli autori hanno dato risposte non univoche e la maggior parte ha riportato risultati positivi con noduli dai 14 ai 40 mL (24, 26,27), mentre qualche autore italiano ha riportato tassi di successo molto elevati in noduli fino a 90 mL di volume (28).
Una delle difficoltà maggiori nella valutazione dell’efficacia della tecnica negli AFTN è stata rappresentata dalla disponibilità solo di studi con follow-up troppo breve (in genere < 1 anno). Un anno è un periodo troppo breve per esprimere un giudizio sul rischio di recidiva in noduli trattati con successo. Dai pochi studi in cui c’è un follow-up abbastanza lungo, dai 36 ai 60 mesi di mediana, emergono dati conflittuali (17,22,29,30).
Un altro importante limite alla diffusione della metodica negli AFTN è stata rappresentata dalla mancata standardizzazione del trattamento. Punti di maggiore controversia sono:
- numero di sessioni necessarie
- quantità di alcool inserita per ciascuna sessione
- quantità di alcool totale inserita
- intervalli temporali tra le diverse sessioni.
La struttura del nodulo sembra influenzare l’outcome: nello studio retrospettivo in cui tale caratteristica è stata analizzata su 112 noduli pretossici, dopo una mediana di osservazione di 60 mesi il mantenimento della riduzione del volume e un TSH dosabile è stato più elevato nei noduli ad ecostruttura mista in cui la componente liquida era maggiore del 30%, indipendentemente dalle condizioni funzionali di base (ipertiroidismo franco o subclinico) (17).
Un utilizzo clinico interessante, emerso negli ultimi anni, è quello in combinazione con 131I nel trattamento di AFTN di grandi dimensioni, in pazienti non idonei o non disponibili alla chirurgia. Questo approccio sembra combinare gli effetti positivi di un numero ridotto di sessioni di PEI ed una dose di 131I gestibile ambulatorialmente: con tale approccio viene riportato un elevato tasso di successo e di soddisfazione del paziente (31).
Effetti collaterali
Una percentuale bassa ma non trascurabile di disfonia viene riportata negli AFTN trattati con PEI (3.9%) (27). La complicanza è dovuta alla possibilità che quantità variabili di alcool, a causa dell'interruzione della capsula del nodulo (già presente o provocata dalla manovra), possano retrodiffondere e venire a contatto con il nervo laringeo. Come conseguenza, si ha una paralisi del nervo da irritazione chimica. La disfonia è transitoria e in genere regredisce nello spazio di alcune settimane, spontaneamente o più efficacemente dopo un breve periodo di terapia cortisonica. La complicanza è operatore-dipendente e avviene con una frequenza ridotta (circa < 2%) se l’operatore è molto esperto (29,30). Le precauzioni più utili per minimizzare tale rischio sono: inserimento di alcool con pressione lieve e monitoraggio ecografico continuo, con controllo costante della sede di diffusione dell’alcool.
Altri effetti collaterali più gravi, ma riportati in modo episodico, sono: ematomi (intra-parenchimali e/o sottocutanei), trombosi della giugulare, complicanze settiche, sindrome di Bernard-Horner a seguito dell’interessamento della catena cervicale, comparsa di Graves a distanza (32,33).
Utilità clinica
I dati disponibili in letteratura evidenziano un buon taso di successo della metodica nel breve periodo.
Le limitazioni più significative sono fornite dalla necessità di trattamenti ripetuti, dal rischio di effetti collaterali non trascurabili e soprattutto dall’incertezza dei risultati a distanza (17).
Queste considerazioni sembrano rendere meno appetibile questa metodica, soprattutto se confrontata con il radioiodio o la chirurgia per noduli di grandi dimensioni.
Per tale motivo, le indicazioni della PEI negli AFTN sono legate a quelle condizioni cliniche in cui il trattamento è necessario e per altri motivi, medici e non, non è possibile eseguire terapia radiometabolica o chirurgica (6).
NODULI SOLIDI
Alcuni autori hanno suggerito l’uso della metodica in noduli solidi, freddi e benigni alla citologia. I risultati riportati sono incoraggianti e dimostrano come la PEI sia più efficace della levo-tiroxina nel ridurre le dimensioni dei noduli trattati. La riduzione delle dimensioni è di circa il 40-50% e questo si traduce spesso in un miglioramento della sintomatologia lamentata dai pazienti, quando presente (34,35).
L’uso di tale metodica non è molto diffuso, a causa di alcune delle considerazioni che sono già emerse nell'illustrazione della tecnica nel trattamento dei noduli cistici e degli AFTN:
- la tecnica dovrebbe essere presa in considerazione per noduli solidi che necessitano di essere trattati (grandi e sintomatici)
- i noduli solidi rispondono meno di quelli con componente cistica al trattamento con PEI (36). Nel paragrafo dedicato agli AFTN abbiamo visto come la risposta in termini di riduzione dimensionale sia correlata alla componente liquida e quindi inversamente correlata con la porzione solida
- c’è il rischio non completamente trascurabile che una patologia maligna non sia diagnosticata alla citologia (37), anche se questo rischio può essere minimizzato con l’esecuzione di almeno due esami citologici prima della manovra.
ALTRE LESIONI DEL COLLO
Cisti del dotto del tireoglosso
Il trattamento con PEI delle cisti del dotto tireoglosso è stato proposto, ma l’indicazione di prima scelta per tale patologia, anche per il possibile rischio di trasformazione maligna delle lesioni, rimane la chirurgia (38). I risultati riportati sono incoraggianti, perché viene riportata una percentuale di successo di circa l’80%. La limitazione più importante sembra essere la difficoltà nell’evacuare le cisti a causa dell'elevata viscosità del contenuto (39). Questa limitazione può essere superata utilizzando aghi di calibro maggiore e la tecnica potrebbe essere pertanto presa in considerazione in soggetti che rifiutano la chirurgia, una volta attentamente esclusa la malignità.
Cisti delle paratiroidi
Le cisti delle paratiroidi sono abbastanza infrequenti e nella maggior parte dei casi possono essere scambiate per cisti della tiroide. Nelle casistiche autoptiche il riscontro di degenerazione cistica di ghiandole paratiroidee non è infrequente ed è possibile arguire che la degenerazione cistica sia il risultato finale di una graduale ritenzione idrica all’interno della ghiandola (40).Per la diagnosi differenziale è necessario il dosaggio del PTH sul liquido di lavaggio della siringa-ago utilizzata per l’agoaspirato (41).
In considerazione della recidiva post-drenaggio delle cisti delle paratiroidi, è stata proposta la PEI. La PEI è stata utilizzata con successo nelle forma di iperplasia paratiroidea conseguenti ad insufficienza renale cronica e recidivanti dopo chirurgia parziale (42) e nell’adenoma singolo (43).
La difficoltà maggiori alla diffusione della tecnica sono legate alla particolare localizzazione delle paratiroidi: essendo infatti la loro localizzazione molto profonda, la manovra può essere più difficoltosa, provocare più dolore e soprattutto l’interessamento del ricorrente è quasi automatico in caso di fuoriuscita di alcool. Quest’ultimo effetto collaterale è legato anche alla particolare conformazione delle lesioni da trattare che, a differenza dei noduli della tiroide, sono circondati da un sottilissimo strato di parenchima sano.
Metastasi linfonodali cervicali da carcinoma papillifero della tiroide
La tecnica è stata proposta dai colleghi interventisti della Mayo Clinic negli anni novanta (44,45). Ci sono alcune considerazioni che possono favorire un approccio di questo tipo:
- il reintervento chirurgico è spesso un'incognita, a causa della difficoltà a localizzare la lesione
- il tasso elevato di complicanze (lesioni del ricorrente, asportazione delle paratiroidi, danno estetico del collo) del reintervento (46)
- il decorso delle metastasi linfonodali è spesso indolente
Sfortunatamente i dati riportati in letteratura non sono omogenei e le percentuali di successo variano tra il 15 ed il 70% (47-50). In tutti gli studi viene riportato il controllo totale della malattia nel periodo osservato.
Utilità clinica: la PEI può essere proposta nelle recidive linfonodali cervicali da carcinoma differenziato della tiroide una volta che, valutati attentamente gli effetti benefici ed i potenziali rischi della chirurgia, il reintervento venga giudicato molto rischioso o rifiutato dal paziente (48).
BIBLIOGRAFIA
- Rozman B, Benze-Zigman Z, Tomic-Brzac H, et al. Sclerosation of thyroid cysts by ethanol. Period Biol 1989, 91: 1116 -8.
- Livraghi T, Paracchi A, Ferrari C, et al. Treatment of autonomous thyroid nodule with percutaneous ethanol injection: preliminary results. Radiology 1990, 175: 827-9.
- Martino E, Murtas MI, Loviselli A, et al. Percutaneous intranodular ethanol injection for treatment of autonomously functioning thyroid nodules. Surgery 1992, 112: 1161-5.
- Papini E, Panunzi C, Pacella CM, et al. Percutaneous ultrasound-guided ethanol injection: a new treatment of toxic autonomously functioning thyroid nodules? J Clin Endocrinol Metab 1993, 76: 411-6.
- Cooper DS, Doherty GM, Haugen BR, et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2009, 19: 1167-214.
- Gharib H, Papini E, Paschke R, et al. American Association of Clinical Endocrinologists, Associazione Medici Endocrinologi, and European Thyroid Association Medical Guidelines for Clinical Practice for the Diagnosis and Management of Thyroid Nodules. Endocr Pract 2010, 16 Suppl 1: 1-43.
- Bean WJ. Renal cysts: treatment with alcohol. Radiology 1981, 138: 329-31.
- Solbiati L, Giangrande A, DePra L, et al. Percutaneous ethanol injection of parathyroid tumors under US guidance: treatment for secondary hyperparathyroidism. Radiology 1985, 155: 607-10.
- Livraghi T, Giorgio A, Marin G, et al. Hepatocellular carcinoma and cirrhosis in 746 patients: long term results of percutaneous ethanol injection. Radiology 1985, 197: 101-8.
- Rossi R, Savastano S, Tommasselli AP, et al. Percutaneous computer tomography-guided ethanol injection in aldosterone-producing adrenal adrenocortical adenoma. Eur J Endocrinol 1995, 132: 302-5.
- Crescenzi A, Papini E, Pacella CM, et al. Morphological changes in a hyperfunctioning thyroid adenoma after percutaneous ethanol injection: histological, enzymatic and sub-microscopical alterations. J Endocrinol Invest 1996, 19: 371-6.
- Treece GL, Georgitis WJ, Hofeldt FD. Resolution of Recurrent Thyroid Cysts With Tetracycline Instillation. Arch Intern Med 1983, 143: 2285-7.
- Hang-Seok Chang, Jong Ho Yoon, Woung Youn Chung, et al. Sclerotherapy with OK-432 for Recurrent Cystic Thyroid Nodules. Yoinsei Med J 1998, 39: 367-71.
- Monzani F, Lippi F, Goletti O, et al. Percutaneous aspiration and ethanol sclerotherapy for thyroid cysts. J Clin Endocrinol Metab 1994, 78: 800-2.
- Braga M, Cavalcanti MT, Collac LM, et al. Efficacy of Ultrasound-Guided Fine-Needle Aspiration Biopsy in the Diagnosis of Complex Thyroid Nodules. J Clin Endocrinol Metab 2001, 86: 4089–91.
- Kim DW, Rho MH, Kim HJ, et al. Percutaneous ethanol injection for benign cystic thyroid nodules: is aspiration of ethanol-mixed fluid advantageous? AJNR Am J Neuroradiol 2005, 26: 2122-7.
- Guglielmi R, Pacella CM, Bianchini AP, et al. Percutaneous ethanol injection treatment in benign thyroid lesions: role and efficacy. Thyroid 2004, 14: 125-31.
- Del Prete S, Caraglia M, Russo D, et al. Percutaneous ethanol injection efficacy in the treatment of large symptomatic thyroid cystic nodules: ten-year follow-up of a large series. Thyroid 2002, 12: 815-21.
- Sung JY, Kim YS, Choi H, et al. Optimum first-line treatment technique for benign cystic thyroid nodules: ethanol ablation or radiofrequency ablation AJR Am J Roentgenol 2011, 196: W210-4.
- Bennedbaek FN, Hegedus L. Treatment of recurrent thyroid cysts with ethanol: a randomized double blind controlled trial. J Clin Endocrinol Metab 2003, 88: 5773-7.
- Valcavi R, Frasoldati A. Ultrasound-guided percutaneous ethanol injection therapy in thyroid cystic nodules. Endocr Pract 2004, 10: 269-75.
- Lee SJ, Ahn I-M. Effectiveness of percutaneous ethanol injection therapy in benign nodular and cystic thyroid disease: long-term follow-up experience. Endocr J 2005, 52: 455-62.
- Ziele?nik W, Kawczyk-Krupka A, Barlik MP, et al. Modified percutaneous ethanol injection in the treatment of viscous cystic thyroid nodules. Thyroid 2005, 15: 683-6.
- Lippi F, Ferrari C, Manetti L, et al. Treatment of solitary autonomous thyroid nodules by percutaneous etanol injection. Results of an Italian multicenter study. J Clin Endocrinol Metab 1996, 81: 3261-4.
- Cho YS, Lee HK, Ahn IM, et al. Sonographically guided ethanol sclerotherapy for benign thyroid cysts: results in 22 patients. AJR Am J Roentgenol 2000, 174: 213-6.
- Di Lelio A, Rivolta M, Casati M, et al. Treatment of autonomous thyroid nodules: value of percutaneous ethanol injection. AJR 1995, 164: 207–13.
- Ferrari C, Reschini E, Paracchi A. Treatment of the autonomous thyroid nodule: a review. Eur J Endocrinol 1996, 135: 383-90.
- Tarantino L, Francica G, Sordelli I, et al. Percutaneous ethanol injection of hyperfunctioning thyroid nodules: long-term follow-up in 125 patients. AJR Am J Roentgenol 2008, 190: 800-8.
- Del Prete S, Russo D, Caraglia M, et al. Percutaneous ethanol injection of autonomous thyroid nodules with a volume larger than 40 ml: three years of follow-up. Clin Radiol 2001, 56: 895-901.
- Yano Y, Sugino K, Akaishi J, et al. Treatment of autonomously functioning thyroid nodules at a single institution: radioiodine therapy, surgery, and ethanol injection therapy. Ann Nucl Med 2011, 25: 749-54.
- Pacini F. Role of percutaneous ethanol injection in management of nodular lesions of the thyroid gland. J Nucl Med 2003, 44: 211-2.
- Pishdad GR, Pishdad P, Pishdad R. Horner's syndrome as a complication of percutaneous ethanol treatment of thyroid nodule. Thyroid 2011, 21: 327-8.
- Regalbuto C, Le Moli R, Muscia V, et al. Severe Graves' Ophthalmopathy After Percutaneous Ethanol Injection in a Nontoxic Thyroid Nodule. Thyroid 2012, 22: 210-3.
- Bennedbaek FN, Nielsen LK, Hegedus L. Effect of percutaneous ethanol injection therapy versus suppressive doses of l-thyroxine on benign solitary sold cold nodules: a randomized trial. J Clin Endocrinol Metab 1998, 83: 830-5.
- Bennendbaek FN, Hegedus L. Percutaneous ethanol injection therapy in benign solitary cold thyroid nodules: a randomized trial comparing one injection with three injections. Thyroid 1999, 9: 225-33.
- Kim JH, Lee HK, Lee JH, et al. Efficacy of sonographically guided percutaneous ethanol injection for treatment of thyroid cysts versus solid thyroid nodules. AJR 2003, 180: 1623-6.
- Monzani F, Caraccio N, Basolo F, et al. Surgical and pathological changes after percutaneous ethanol injection therapy of thyroid nodules. Thyroid 2000, 10: 1087-92.
- Baskin HJ. Percutaneous ethanol injection of thyroglossal duct cysts. Endocr Pract 2006, 12: 355-7.
- Kim SM, Baek JH, Kim YS, et al. Efficacy and Safety of Ethanol Ablation for Thyroglossal Duct Cysts. AJNR Am J Neuroradiol 2011, 32: 306-9.
- Ippolito G, Fausto Palazzo F, Sebag F, et al. A single institution 25-year review of true parathyroid cysts. Lagenbecks Arch Surg 2006, 391: 13-8.
- Frasoldati A, Valcavi R. Challenges in neck ultrasonography: lymphadenopathy and parathyroid glands. Endocr Pract 2004, 10: 261-8.
- Chen HH, Lin CJ, Wu CJ, et al. Chemical ablation of recurrent and persistent secondary hyperparathyroidism after subtotal parathyroidectomy. Ann Surg 2011, 253: 786-90.
- Harman CR, Grant CS, Hay ID, et al. Indications, technique and efficacy of alcohol injection of enlarged parathyroid glands in patients with primary hyperparathyroidism. Surgery 1998, 124: 1011-20.
- Hay ID, Charboneau JW. The coming of age of ultrasound-guided percutaneous ethanol ablation of selected neck nodal metastases in well-differentiated thyroid carcinoma. J Clin Endocrinol Metab 2011, 96: 2717-20.
- Lewis BD, Hay ID, Charboneau JW, et al. Percutaneous ethanol injection for treatment of cervical lymph node metastases in patients with papillary thyroid carcinoma. AJR 2002, 178: 699-704.
- Monchik JM, Donatini G, Iannuccilli J, et al. Radiofrequency ablation and percutaneous ethanol injection treatment for recurrent local and distant well-differentiated thyroid carcinoma. Ann Surg 2006, 244: 296-304.
- Lim CY, Yum JS, Lee J, et al. Percutaneous ethanol injection therapy for locally recurrent papillary thyroid carcinoma Thyroid 2007, 17: 347-50.
- Kim BM, Kim MJ, Kim EK, et al. Controlling recurrent papillary thyroid carcinoma in the neck by ultrasonography-guided percutaneous ethanol injection. Eur Radiol 2008, 18: 835-42.
- Sohn YM, Hong SW, Kim EK, et al. Complete eradication of metastatic lymph node after percutaneous ethanol injection therapy: pathologic correlation. Thyroid 2009, 19: 317-9.
- Heilo A, Sigstad E, Fagerlid KH, et al. Efficacy of ultrasound-guided percutaneous ethanol injection treatment in patients with a limited number of metastatic cervical lymph nodes from papillary thyroid carcinoma. J Clin Endocrinol Metab 2011, 96: 2750-5.
Radiofrequenza nella patologia nodulare tiroidea
Maurilio Deandrea, Alberto Mormile, Piero Paolo Limone
Endocrinologia e Centro per le Malattie della Tiroide, Ospedale Mauriziano "Umberto I", Torino
(aggiornato al 28 agosto 2020)
Premesse
Il nodo tiroideo è un problema clinico comune per l’endocrinologo, in quanto si presenta come lesione palpabile nel 5% delle donne e nell'1% degli uomini nelle zone iodo-carenti (1,2), mentre la prevalenza nella popolazione generale aumenta al 70% con l’impiego dell’ecografia (1-3).
La maggioranza dei nodi tiroidei è di natura benigna, e quando la malignità è stata esclusa con l’impiego dell’ago-aspirato, le opzioni terapeutiche possibili sono differenti. I nodi tiroidei benigni asintomatici generalmente non necessitano di trattamento e i pazienti possono semplicemente essere controllati a distanza nel tempo. Quando invece compaiono sintomi correlati al gozzo nodulare, possono essere proposte opzioni terapeutiche specifiche (4-6). La terapia chirurgica ha rappresentato nel tempo l’opzione principale, sebbene non sia scevra di complicanze, tra le quali le principali sono l’ipoparatiroidismo transitorio o definitivo, il danno al nervo ricorrente, l’ipotiroidismo post-chirurgico, la cicatrice e le complicanze dell’anestesia generale, che anche nei centri specializzati sono presenti del 2-10% dei casi. Inoltre, la chirurgia è costosa e non rappresenta un’opzione proponibile per pazienti a elevato rischio chirurgico (4-8). Per queste ragioni un aspetto fondamentale ai giorni nostri è ridurre il rischio di effetti collaterali permanenti in pazienti affetti da patologia nodulare benigna.
Negli ultimi due decenni sono stati ottenuti importanti miglioramenti con le tecniche ablative eco-guidate ed eco-assistite quali il Laser (LTA), la Radiofrequenza (RFA), l’HIFU (terapia con ultrasuoni focalizzati ad alta intensità) e le Microonde (MWA). I nodi tiroidei benigni normo-funzionanti con effetto compressivo o danno estetico hanno rappresentato da subito un ambito di indicazione terapeutica ideale, mentre l’utilizzo di queste tecniche per il trattamento dei nodi caldi iperfunzionanti è in fase di crescita e di ottimizzazione (9). Tra tutte le tecniche citate, LTA e RFA sono quelle maggiormente utilizzate, con maggiore efficacia ed effetti collaterali trascurabili.
Tecnica
Gli aghi hanno punta e camicia fredda, che evita danni alla cute e permette di posizionarsi vicini alla capsula del nodulo senza causare effetti collaterali alle strutture circostanti. L’ago coreano presenta calibro minore rispetto a quello multi-ansa (attualmente 18 G rispetto ai 14 G) e risulta quindi più maneggevole e meno traumatico, ma prevede di utilizzare una tecnica di movimento progressivo nel corso del trattamento (“moving shot”), più impegnativa per l'operatore. Il movimento continuo dalle porzioni più profonde e distali del nodulo a quelle più prossimali richiede infatti un controllo ecografico continuo della posizione della punta e del percorso dell'ago, per raggiungere tutte le porzioni del nodulo, rispettando contemporaneamente le strutture extra-nodulari. L'ago multi-ansa, invece, dopo micro-incisione della cute con bisturi, prevede il posizionamento della punta, la stabilizzazione della posizione con l’estrazione delle anse e la diffusione successiva del calore mediante perfusione con soluzione fisiologica iniettata da pompa peristaltica collegata al generatore. La possibilità di estrazione delle anse fino a 4 cm permette di trattare noduli di volume importante in una sola seduta, con eventuale spostamento dell’ago nel corso della stessa seduta, se ritenuto necessario dall’operatore.
Risultati
Grazie a importanti studi osservazionali e a qualche studio randomizzato e controllato, le tecniche termo-ablative sono state inserite in alcune linee guida internazionali per il trattamento di pazienti selezionati con problemi compressivi dovuti alla presenza di un nodo tiroideo benigno solido (10-13). I parametri utilizzati per verificare l’efficacia del trattamento sono attualmente il successo tecnico, definito come riduzione volumetrica del 50% rispetto al volume basale (VRR), e il successo clinico, definito come risoluzione dei sintomi riferiti dal/la paziente (14). Alla luce di questi parametri, una metanalisi pubblicata nel 2019 (15) ha preso in esame i maggiori studi pubblicati sui risultati di LTA e RFA, evidenziando un’efficacia importante della RFA, sia per quanto riguarda il successo tecnico che per il successo clinico (tabelle 1 e 2).
| Tabella 1 Caratteristiche degli studi inclusi nella metanalisi (modif da 15) |
||||
| Autore (anno) | Paese | Disegno | N noduli benigni non funzionanti | Area solida |
| Spiezia (2009) | Italia | Prospettico coorte | 66 | > 70% |
| Huh (2012) | Corea | RCT | 30 | > 50% |
| Lim (2013) | Corea | Retrospettivo coorte | 81 | > 50% |
| Cesareo (2015) | Italia | RCT | 42 | > 70% |
| Deandrea (2015) | Italia | RCT | 40 | > 70% |
| Valcavi (2015) | Italia | Retrospettivo coorte | 40 | > 80% |
| Aysan (2016) | Turchia | Prospettico coorte | 51 | > 80% |
| Yue (2017) | Cina | Retrospettivo coorte | 102 | > 50% |
| Pacella (2017) | Italia | Retrospettivo coorte | 152 | > 70% |
| Cervelli (2017) | Italia | Prospettico coorte | 51 | > 75% |
| Deandrea (2019) | Italia | Prospettico coorte | 337 | > 70% |
| Guang (2019) | Cina | Retrospettivo coorte | 194 | > 80% |
| Tabella 2 VRR dei noduli tiroidei benigni (modif da 15) |
||||||||
| A 6 mesi | A 12 mesi | A 24 mesi | A 36 mesi | |||||
| Noduli (studi) | VRR (%) | Noduli (studi) | VRR (%) | Noduli (studi) | VRR (%) | Noduli (studi) | VRR (%) | |
| Dati complessivi sulle termo-ablazioni | ||||||||
| Tutti | 1479 (19) | 60 | 2960 (17) | 66 | 598 (7) | 62 | 370 (5) | 53 |
| Singola sessione | 1123 (16) | 57 | 1034 (12) | 59 | 323 (5) | 51 | 289 (4) | 44 |
| RFA | ||||||||
| Tutti | 1120 (11) | 68* | 1023 (8) | 75* | 315 (3) | 87* | - | - |
| Singola sessione | 779 (8) | 67* | 631 (4) | 71* | - | - | - | - |
| LTA | ||||||||
| Tutti | 359 (8) | 48 | 1937 (9) | 52 | 283 (4) | 45 | 289 (4) | 44 |
| Singola sessione | 344 (8) | 47 | 403 (8) | 49 | 283 (4) | 45 | 289(4) | 44 |
| * p < 0.05 vs LTA alla stessa epoca | ||||||||
In particolare, sono stati confermati i dati pubblicati dal nostro gruppo circa l’efficacia in termini di VRR del 71% a un anno dopo un solo trattamento di nodi solidi di volume < 30 mL (16,17).
Per poter proporre la RFA come opzione davvero risolutiva, è necessario definire la durata dell’efficacia nel tempo e la percentuale di recidiva o ricrescita. I due studi pubblicati sull’argomento dal gruppo di Baek e dal nostro gruppo (18,19) sono confortanti, sia in termini di recidiva o non risposta del nodo dopo il trattamento (5% circa) che in termini di persistenza dell’efficacia fino a 5 anni. Un’analisi di tutti i dati pubblicati sull’argomento in un recente studio multicentrico (20) ha segnalato un’efficacia ancora più importante della RFA in termini di VRR (85% dei nodi con VRR > 50%), con una percentuale di recidiva tuttavia più frequente (20%) in nodi più grandi e con un trattamento meno intensivo in termini di energia erogata per volume.
I dati fin qui pubblicati sono stati analizzati attraverso il metodo del Machine Learning (21), che ha permesso di mettere in evidenza le caratteristiche predittive di una risposta ottimale (figura): in particolare, dallo studio emerge che rispondono meglio i nodi di volume < 25 mL, con ecostruttura spongiforme e vascolarizzazione vivace.
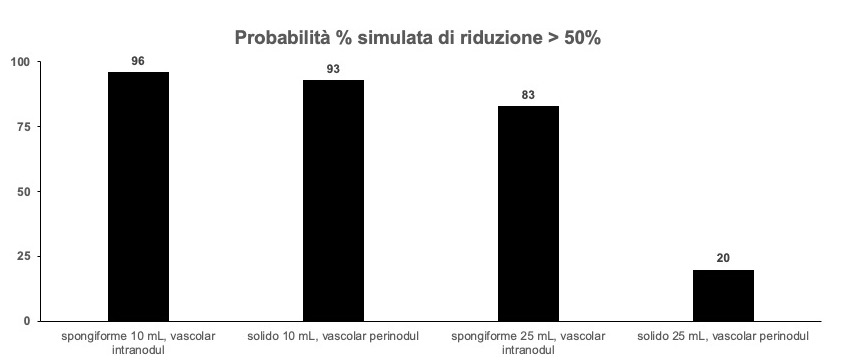
Un secondo aspetto da prendere in considerazione nell’ottica di un’ottimizzazione del trattamento eco-guidato con RFA è il ruolo dell’energia erogata per volume basale del nodo, oggetto di una segnalazione recente fatta alla luce della correlazione esistente tra questa e il VRR dopo il trattamento (22). Sono in corso studi per verificare e approfondire quanto questo aspetto sia condizionante il risultato finale e se sia possibile identificare una soglia di energia da erogare per avere un risultato terapeutico significativo.
In ultimo nei paesi asiatici (Cina e Corea), dati preliminari descrivono l’utilizzo della RFA nel trattamento del carcinoma tiroideo primitivo unifocale come alternativa alla chirurgia: al momento non è stato ancora chiarito se vi sia un’effettiva ablazione completa del tessuto neoplastico dopo il trattamento e quale sia il comportamento della neoplasia a seconda dell’istotipo e dei rapporti rispetto alla capsula (23,24). Anche per quest’ambito, un eventuale ruolo terapeutico potrà essere chiarito da ulteriori studi con follow-up adeguato. Al contrario, il trattamento palliativo dei linfonodi metastatici non operabili è un’indicazione accettata dalla comunità scientifica, visto il beneficio loco-regionale descritto, laddove non siano praticabili soluzioni più radicali o risolutive (25).
Conclusioni
I vantaggi del trattamento termo-ablativo con RFA sono:
- il risparmio del tessuto ghiandolare extra-nodulare;
- l'applicabilità su tutti i noduli visualizzabili correttamente con l'ecografia;
- l'utilizzo di una semplice anestesia locale nella sede di iniezione dell'ago;
- l’assenza di ospedalizzazione.
I limiti sono rappresentati da:
- la difficoltà di ottenere un'ablazione completa nel caso di noduli iperfunzionanti se di grandi dimensioni;
- la presenza di grossolane calcificazioni che generano un cono d'ombra posteriore, in grado di impedire una buona diffusione del calore;
- la difficoltà di trattare noduli situati in posizione profonda retro-sternale o in pazienti con difficoltà di estensione del capo;
- pazienti con emopatie o disturbi importanti della coagulazione o con stato ansioso non compensato dalla terapia farmacologica in corso.
Alla luce dell'esperienza personale e dei risultati pubblicati, il trattamento di termo-ablazione eco-guidata con RFA risulta indicato in pazienti affetti da nodulo tiroideo unico o prevalente nell'ambito di un gozzo pluri-nodulare, normo-funzionante o tossico, causa di sintomi compressivi o estetici, in presenza di contro-indicazione o rifiuto al trattamento chirurgico o radio-metabolico.
Il trattamento va eseguito dopo un'adeguata informazione relativa a vantaggi e svantaggi delle varie procedure e alle modalità della seduta di trattamento.
Risultati ottimali con VRR 50% sono attesi in nodi di volume intermedio (< 30 mL), con ecostruttura micro-cistica o spongiforme, con vascolarizzazione vivace (preferibilmente elastici all’elastosonografia), trattati con un’erogazione di energia di almeno 1500 Joule/mL (alla luce della nostra esperienza personale); gli studi in corso sull’argomento forniranno nel prossimo futuro un’evidenza più solida per poter standardizzare sia i criteri di selezione che la metodologia di trattamento adeguata.
Bibliografia
- Vander JB, Gaston EA, Dawber TR. The significance of nontoxic thyroid nodules. Final report of a 15-year study of the incidence of thyroid malignancy. Ann Intern Med 1968, 69: 537–40.
- Tunbridge WM, Evered DC, Hall R, et al. The spectrum of thyroid disease in a community: the Whickham survey. Clin Endocrinol 1977, 7: 481–93.
- Guth S, Theune U, Aberle J, et al. Very high prevalence of thyroid nodules detected by high frequency (13 MHz) ultrasound examination. Eur J Clin Invest 2009, 39: 699–706.
- Hegedüs L, Bonnema SJ, Bennedbaek FN. Management of simple nodular goiter: current status and future perspectives. Endocr Rev 2003, 24: 102–32.
- Hegedüs L. Clinical practice. The thyroid nodule. N Engl J Med 2004, 351: 1764–71.
- Filetti S, Durante C, Torlontano M. Nonsurgical approaches to the management of thyroid nodules. Nat Clin Pract Endocrinol Metab 2006, 2: 384–94.
- Bergenfelz A, Jansson S, Kristoffersson A, et al. Complications to thyroid surgery: results as reported in a database from a multicenter audit comprising 3,660 patients. Langenbecks Arch Surg 2008, 393: 667–73.
- Nygaard B, Hegedüs L, Nielsen KG, et al. Long-term effect of radioactive iodine on thyroid function and size in patients with solitary autonomously functioning toxic thyroid nodules. Clin Endocrinol 1999, 50: 197–202.
- Cesareo R, Palermo A, Benevenuto D, et al. Efficacy of radiofrequency ablation in autonomous functioning thyroid nodules. A systematic review and meta-analysis. Rev Endocr Metab Disord 2019, 20: 37–44.
- Gharib H, Papini E, Garber JR, et al. American Association of Clinical Endocrinologists, American College of Endocrinology, and Associazione Medici Endocrinologi medical guidelines for clinical practice for the diagnosis and management of thyroid nodules 2016. Endocr Pract 2016, 22: 622–39.
- Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American Thyroid Association Guidelines task force on thyroid nodules and differentiated thyroid cancer. Thyroid 2016, 26: 1–133.
- Mauri G, Pacella CM, Papini E, et al. Proceedings of the first Italian conference on thyroid minimally invasive treatments and foundation of the Italian research group for thyroid minimally invasive procedures. Int J Hyperth 2018, 34: 603–5.
- Kim JH, Baek JH, Lim HK, et al. 2017 Thyroid radiofrequency ablation guideline: Korean Society of Thyroid Radiology. Korean J Radiol 2018, 19: 632–55.
- Mauri G, Pacella CM, Papini E, et al. Image-guided thyroid ablation: proposal for standardization of terminology and reporting criteria. Thyroid 2019, 29: 611–8.
- Trimboli P, Castellana M, Sconfienza LM, et al. Efficacy of thermal ablation in benign non-functioning solid thyroid nodule: a systematic review and meta-analysis. Endocrine 2020, 67: 35-43.
- Deandrea M, Sung JY, Limone P, et al. Efficacy and safety of radiofrequency ablation versus observation for nonfunctioning benign thyroid nodules: a randomized controlled international collaborative trial. Thyroid 2015, 25: 890–6.
- Deandrea M, Garino F, Alberto M, et al. Radiofrequency ablation for benign thyroid nodules according to different ultrasound features: an Italian multicentre prospective study. Eur J Endocrinol 2019, 180: 79–87.
- Lim HK, Lee JH, Ha EJ, et al. Radiofrequency ablation of benign non-functioning thyroid nodules: 4-year follow-up results for 111 patients. Eur Radiol 2013, 23: 1044–9.
- Deandrea M, Trimboli P, Garino F, et al. Long term efficacy of a single session of RFA for benign thyroid nodules: a longitudinal 5-year observational study. J Clin Endocrinol Metab 2019, 104: 3751-6.
- Bernardi S, Giudici F, Cesareo R, et al. Five-year results of radiofrequency and laser ablation of benign thyroid nodules: a multicenter study from the Italian minimally invasive treatments of the thyroid group. Thyroid 2020, DOI: 10.1089/thy.2020.0202.
- Negro R, Rucco M, Creanza A, et al. Machine learning prediction of radiofrequency thermal ablation efficacy: a new option to optimize thyroid nodule selection. Eur Thyroid J 2020, 9: 205-12.
- Trimboli P, Deandrea M. Treating thyroid nodules by radiofrequency: the delivered energy should be correlated with the volume reduction rate. Endocrine 2020, 69: 682-7.
- Kim JH, Baek JH, Sung JY, et al. Radiofrequency ablation of low-risk small papillary thyroid carcinoma: preliminary 41 results for patients ineligible for surgery. Int J Hyperthermia 2017, 33: 212-9.
- Zhang M, Luo Y, Zhang Y, Tang J. Efficacy and safety of ultrasound-guided radiofrequency ablation for treating low-risk papillary thyroid microcarcinoma: a prospective study. Thyroid 2016, 26: 1581-7.
- Na DG, Lee JH, Jung SL, et al. Radiofrequency ablation of benign thyroid nodules and recurrent thyroid cancers: consensus statement and recommendations. Kor J Radiol 2012, 13: 117-25.
Trattamento laser percutaneo nella patologia nodulare benigna della tiroide
Claudio M Pacella
Ospedale Regina Apostolorum, Albano Laziale (RM)
(26 marzo 2012)
- Per la descrizione dei principi di base e delle caratteristiche tecniche dell’ablazione laser si rimanda alla “Overview sulle tecniche ablative percutanee”.
- Per le applicazioni della tecnica di ablazione laser nella patologia maligna primitiva e secondaria della tiroide si rinvia al capitolo su “Le tecniche mini-invasive per la citoriduzione delle recidive di neoplasia tiroidea”
- In questo capitolo tratteremo le indicazioni, la tecnica e i risultati della metodica di ablazione mediante energia laser nelle lesioni benigne della tiroide
Introduzione
Dopo lo studio di fattibilità ex vivo su pezzi operatori di tessuto tiroideo e la descrizione di due volontari affetti da nodulo tiroideo autonomo (> 40 mL) trattati per via percutanea con termoablazione laser (1), sono apparsi numerosi lavori, sia come case report (2-5) che come studi di coorte monocentrici non randomizzati (6-14)e randomizzati (15-18). In alcune di queste casistiche sono stati inclusi anche noduli funzionanti (3, 4, 7, 8, 14, 19, 20). Per un’analisi di questi lavori è bene conoscere i parametri riferibili all’agente fisico usato e quelli riferibili alle caratteristiche fisiche, morfologiche e biologiche dei noduli sottoposti ad ablazione termica.
Metodi
Esistono differenti tipi di sorgente laser e differenti modalità di cessione dell’energia al tessuto bersaglio:
- energia da laser a diodo ad onda continua di 980 nm con potenze variabili da 3 a 10 W e aghi di 22 G con fibre ottiche di quarzo di 400 µm (3, 11, 14),
- lunghezze d’onda di 810 nm con potenze di 3-5 W e aghi da 21 G (2, 20, 21)
- sorgenti a diodo di 820 nm con potenze di uscita di 1.5-3.5 W e aghi da 18 G e fibre da 0.4 mm (4, 6, 15, 18, 22).
La sorgente più usata è quella al Nd:YAG ad onda continua di 1064 nm, con potenze di uscita di 3 W e fibre ottiche di quarzo a punta piatta di 300 µm. L’energia viene portata nel tessuto con aghi di 21 G (7-9, 12, 13, 16, 17).
Per la cessione dell’energia alcuni autori muovono la fibra durante la manovra di ablazione nel corso di una (13, 16, 23) o più sessioni (11, 14), mentre altri mantengono fissa la sorgente e terminano la procedura quando l’area di ecogenicità generata nell’area bersaglio rimane stazionaria (4, 6, 15, 18, 22, 24). In questo caso il criterio per la fine del trattamento non è pianificato, ma varia in base all'ecogenicità che si sviluppa nel nodulo attorno alla punta della sorgente di calore, sia fissa che in movimento.

Figura 1: la fotografia mostra l'ago sottile centimetrato da 21 G, da cui fuoriesce per 5 mm la fibra ottica di quarzo di 300 µm a punta piatta
La tecnica seguita dalla maggioranza degli operatori - il 90% dei centri italiani - impiega aghi da 21 G (fig 1) con sorgente laser al Nd:YAG (8). Essa consiste nel posizionare lungo l’asse maggiore del nodulo uno o più aghi sottili (fino a 4) ed eseguire una o più illuminazioni (fino a 3). Posizionato sotto guida ecografica l’ago nella parte centrale (in caso di nodulo sferico) o nella parte distale (in caso di nodulo lenticolare), si procede all’inserimento nel lume dell’ago, liberato dal mandrino, della fibra di quarzo a punta piatta di 300 µm. Quindi la punta dell’ago viene retratta di 5 mm, in modo che la fibra nuda entri direttamente in contatto con il tessuto da ablare. La punta della fibra deve essere a una distanza di sicurezza di almeno 15 mm dalle strutture critiche del collo, quali vasi epi-aortici e trachea. Questo criterio di sicurezza deve essere accuratamente controllato mediante scansioni ecografiche biplanari.
L’uso degli aghi sottili consente di posizionare uno o più aghi in rapporto alle dimensioni, alla forma e alla sede del nodulo. Si possono usare più sorgenti, posizionandole a distanza di 1 cm fra loro, in maniera da personalizzare il trattamento in rapporto alla morfologia e alla volumetria del nodulo. Per ottimizzare i risultati (massima area di coagulazione in tempi brevi), la disposizione spaziale e il numero delle sorgenti sono scelte dall’operatore di volta in volta, in maniera da avere un'uniforme distribuzione dell’energia nel contesto del nodulo (25). Le energie variano da 1200 Joules a 1800 Joules per sorgente. In caso di noduli di piccole dimensioni (fino a 5 mL), è possibile usare una singola fibra ed eseguire una singola illuminazione o più raramente due illuminazioni retraendo cranialmente l’ago e la fibra di 1.5 cm (pull-back) dalla prima zona trattata, in modo da depositare energia, con la seconda illuminazione, nella parte ancora non trattata situata posteriormente alla precedente. Per i noduli più grandi di 5 mL e fino a 30 mL, si usano due aghi, distanziati fra loro di 1 cm, disposti l’uno accanto all’altro sullo stesso piano o meglio, per poter controllare in simultanea e in tempo reale le due sorgenti, l’uno sull’altro. Si impostano usualmente 3 W di potenza d’uscita e si cedono energie fino a 1800 Joules per sorgente. I tempi in gioco sono pari a 400-600 sec (1W x 1 sec = 1 Joule).
I volumi calcolati con la formula dell’ellissoide sono utili per definire il rapporto fra il volume iniziale dei noduli, il volume delle aree di coagulazione e il volume finale dopo ablazione. Alla fine del trattamento, non appena gran parte del gas da ebollizione legato alle alte temperature (più di 120-130°C alla punta della fibra) è scomparso, è possibile eseguire un controllo dell’area coagulativa (è improprio parlare di area di necrosi) usando mezzo di contrasto ultrasonografico di seconda generazione (SonoVue), che consente la valutazione della reale estensione della zona distrutta. La manovra ablativa ha avuto successo quando l’area “ablata” ha un volume almeno pari al 40% del volume iniziale del nodulo. La massima estensione dell’area ablata si ottiene a 72 ore dal trattamento (26), in ragione del fatto che il danno cellulare continua nei giorni successivi al trattamento, anche, ma non solo, per ischemia da fenomeni trombotici dei piccoli e medi vasi che irrorano il tessuto tiroideo. Con questa tecnica è possibile ottenere risultati utili ed importanti con una singola sessione. Nei noduli > 30 mL è possibile sia eseguire più illuminazioni nella stessa sessione (fino a 3 ma non più di 3) sia pianificare due sessioni a distanza variabile di alcune settimane o di 3-6 mesi.
Prima di posizionare gli aghi-diffusori che vanno messi secondo piani il più possibile paralleli al piano orizzontale del nodulo, deve essere eseguita sotto guida ecografica un'anestesia locale con lidocaina o naropina al 2%, scollando con un ago sottile (23-27 G) i piani sub-capsulari dai piani superficiali sottocutanei, in modo da creare un cuscinetto liquido perifericamente al lobo in cui è situato il nodulo da sottoporre a trattamento di ablazione. Il trattamento è eseguito sotto sedazione cosciente, iniettando endovena diazepam (2-10 mg) o midazolam (2-5 mg) in una singola dose o in dosi frazionate (13). Taluni preferiscono non sottoporre il paziente a sedazione, per meglio controllare, durante la procedura, le reazioni del paziente che, da sveglio, può avvertire l’operatore di qualsiasi effetto molesto durante l’erogazione dell’energia termica. Infatti, basta smettere di erogare energia perché qualsiasi disturbo cessi all’istante (16).
Indicazioni
I noduli da sottoporre a trattamento ablativo devono essere uniformemente o prevalentemente solidi, con non più del 20% di contenuto liquido distribuito nel contesto del parenchima. Percentuali più alte vanno valutate dall’operatore, che può aspirare la componente liquida prima della termo-ablazione del restante parenchima solido o sottoporre la componente liquida ad alcolizzazione mirata e solo dopo a termoablazione. I noduli “spongiformi”, rari e con aspetto a “spugna” per microcisti disseminate nel nodulo e componente liquida superiore al 60% dovrebbero essere preferenzialmente trattati con alcol.
Criteri di eligibilità sono:
- età del paziente > 18 anni;
- nodulo singolo o nodulo dominante ben identificabile ecograficamente e clinicamente nell’ambito di un gozzo;
- ecostruttura solida o prevalentemente solida con componente liquida ≤ 20% del volume totale;
- lesione non iperfunzionante (mancata captazione alla scintigrafia con 99mTc);
- TSH ed ormoni tiroidei sierici nei limiti della norma;
- 2 esami citologici negativi per sospetto di neoplasia (classe TIR 2 della Classificatione SIAPEC) (VPN del 99.8%) non antecedente a più di sei mesi;
- sintomi di compressione locale (senso di costrizione alla gola e/o difficoltà alla deglutizione);
- “danno” cosmetico;
- inoperabilità per rischio anestesiologico o cardiovascolare, non resecabilità o rifiuto dell’intervento chirurgico.
Criteri di esclusione (oltre a quelli che sono l'opposto dei sovrariportati criteri di inclusione)
- storia familiare di cancro della tiroide;
- pregresso trattamento radiante del collo.
Necessaria la sospensione di eventuale trattamento anti-coagulante per 48 ore o anti-aggregante per 72 ore. I pazienti devono essere sottoposti a visita laringoscopica diretta preliminare.
Risultati clinici
I dati disponibili riportano riduzioni volumetriche ad un anno comprese fra il 43% e l‘82% (17, 21)(tab 1).
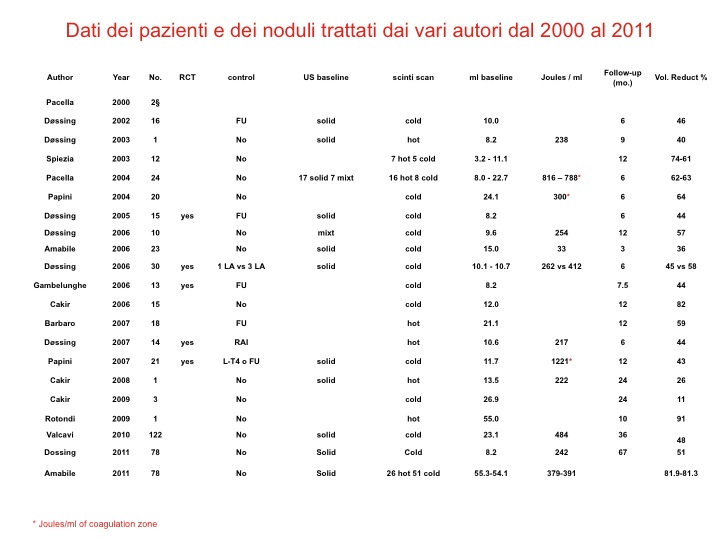
Sono disponibili dati a tre (13) e a 5 anni (18), con valori rispettivamente del 48% e del 51%, a testimonianza della persistenza della riduzione volumetrica nel tempo.
E’ stata segnalata una percentuale di ricrescita del 9% (11/122 casi) a tre anni (13), ma questo dato non è stato confermato da una casistica a 5 anni (18).
E’ stata segnalata una sola complicanza maggiore, costituita dalla perforazione della trachea, suturata 4 settimane dopo l’evento (27), e dovuta all’errato posizionamento della sorgente in contiguità con il tubo tracheale durante la fase iniziale di apprendimento dell’operatore. La paralisi transitoria delle corde vocali è riportata solo da alcuni centri, con percentuali variabili dallo 0.8% (8) all’1.6% (13).
Durante il trattamento il dolore locale o irradiato è relativamente frequente nei pazienti senza sedazione cosciente e/o nel periodo di apprendimento (13). La persistenza di dolore lieve o moderato per qualche giorno dopo la procedura è poco frequente ed è comunque ben controllato con analgesici.
Aspetti in corso di definizione
Recenti comunicazioni da studi prospettici monocentrici (28) e da RCT multicentrici (in fase di pubblicazione) confortano la scelta della tecnica degli aghi multipli sottili. Devono essere ancora stabilite sia le modalità di esecuzione che il ruolo di questa procedura nell’iter terapeutico dei noduli benigni della tiroide.
Alcuni problemi aperti:
- alla luce della stretta correlazione fra la lunghezza d’onda usata e le proprietà ottiche del tessuto irradiato resta incerto quale sorgente sia più efficace. Alcuni studi sono a favore delle sorgenti a diodo con lunghezza d’onda di 980 nm (29), altri a favore delle sorgenti al Nd:YAG con lunghezza d’onda di 1064 nm (30). La sorgente a diodo presenta vantaggi di penetrazione nel tessuto con tempi di esposizione ridotti rispetto alla sorgente al Nd:YAG. Allo stato attuale, però, non esistono dati comparativi tra le due sorgenti;
- circa le modalità di cessione dell’energia, muovere la sorgente durante la procedura (in pratica retrarre l’ago e la fibra in senso caudo-craniale lungo l’asse lungo del nodulo) rappresenta un sistema di cessione della luce laser molto elaborato (13, 14, 23). Questa metodologia è operatore-dipendente e può esporre il tessuto dell’area bersaglio a temperature non idonee ad ottenere la morte delle cellule. Infatti il valore della temperatura in cui si ottiene la morte cellulare è legato al tipo di tessuto e a fattori multipli (31, 32). Nell’area target i valori della temperatura variano in rapporto al tempo, alle modalità di “cottura” e alla sede. Alla periferia della zona di ablazione, infatti, il valore della temperatura varia da 30° a 77°C in caso di tessuto normale e tra 41° e 64°C in caso di tumore (31). Per indurre un danno irreversibile alle cellule, è necessario mantenere per almeno 4-6 minuti una temperatura di 50-54°C e muovendo la punta della fibra non si rimane un tempo sufficiente ad ottenere livelli di temperatura utili a distruggere le cellule. Questo metodo unisce alla complessità di esecuzione anche una possibile incompleta distruzione delle cellule bersaglio, che pertanto soffrono solo di un danno funzionale e possono ricrescere nel tempo (1)(fig 2).
Figura 2: microfotografia di una sezione congelata colorata per l'enzima succinico-deidrogenasi, che documenta riduzione dell'attività dell'enzima nelle cellule situate alla periferia (frecce) della zona di coagulazione (in alto a sinistra). Le cellule hanno subito solo un danno funzionale. Le temperature nella zona critica (margine esterno della zona di coagulazione) non hanno indotto un danno cellulare irreversibile (morte)(Pacella CM, et al. Radiology 2000, 217: 673-7)
- usare la stazionarietà dell’area ecogena attorno alla punta della fibra come criterio per giudicare la fine del trattamento (4, 6, 15, 18, 24) è empirico. L’area ecogena che si sviluppa durante il trattamento può assumere forma e volume non prevedibili. Talora si allarga con gradualità intorno alla punta della fibra fino ad assumere forma e volume irregolari a margini mal definiti e rimanere stabile entro un periodo di tempo variabile, talora si può diffondere e distribuire in maniera non uniforme sull’intero volume del nodulo sottoposto a trattamento, in altri casi ancora l’area ecogena appare filiforme e circonda l’asse lungo della fibra radiante o l’asse maggiore dell’ago. Quindi la forma e le dimensioni dell’area ecogena sono solo una guida grossolana dell’entità del danno termico indotto (1).
Alla luce di quanto sopra, è necessario pianificare in anticipo il trattamento di ablazione, stabilendo tempi e modi di cessione dell’energia. Nel caso di lesione tumorale, l’unico criterio valido è la completa distruzione del tumore con un ampio margine di sicurezza soprattutto nel caso di metastasi, ma noi dobbiamo ottenere solo un debulking del nodulo, il più grande possibile, per quel determinato nodulo di quel determinato volume per ottenere una riduzione di almeno il 50% del volume basale. Le variabili in gioco sono molte: tipo di energia e di sorgente, lunghezza d’onda, potenza di uscita, tempo di irradiazione, modalità di cessione, tipo di tessuto e sue proprietà ottiche e termiche legate alla morfologia dei noduli, alla loro vascolarizzazione, alla quantità di colloide e alla componente fibrosa. Pertanto, l’entità della riduzione volumetrica risulta non prevedibile e questo spiega anche la variabilità dei valori di energia per millilitro di tessuto riportati dai vari autori (tab. 1).
L’entità della riduzione volumetrica dipende da fenomeni reattivi al danno termico indotto, variabili di tessuto a tessuto e da paziente a paziente (corredo genetico delle cellule tiroidee ed eventuale mutazione somatica alla base del loro indice di proliferazione). Questo spiega, accanto agli altri fattori sopra esposti, la mancata correlazione statistica tra riduzione volumetrica e quantità di energia depositata documentata da alcuni autori (6, 15, 22). Esistono dati clinici, confermati anche da dati sperimentali (33, 34), a supporto di una correlazione significativa tra volume di coagulazione indotta ed energia ceduta (8, 10, 16, 17) e ancora tra energia ceduta e volume iniziale del nodulo, mentre esiste una correlazione non significativa tra energia ceduta e riduzione volumetrica (dati personali non pubblicati).
Alla luce di quanto finora detto, dobbiamo tenere invariati i parametri legati all’agente fisico in uso per conoscere il comportamento delle variabili legate alla morfologia, alla struttura e alla biologia dei noduli. La tecnica degli aghi multipli sottili risponde, almeno in parte, a queste esigenze, mantenendo fissi il tipo di sorgente, le potenze, i tempi di esposizione e il rapporto tra numero di sorgenti e volumi dei noduli.
Confronto fra tecniche di ipertermia
La tecnica a radiofrequenza è stata definita “sligtly superior to laser ablation in terms of efficacy and milder adverse effects” (35) da parte dei cultori della tecnica a radiofrequenza “ moving shot”. In realtà, le popolazioni messe a confronto non sono confrontabili, sia per i volumi iniziali (17.9 ±12.6 mL nel caso del laser vs 8.7±4.8 mL nel caso della radiofrequenza con ago raffreddato), sia per il contenuto “cistico” dei noduli sottoposti alle manovre di ablazione. Infatti, i pazienti sottoposti alla tecnica laser hanno noduli solidi o prevalentemente solidi (con componente cistica ≤ 20% della componente solida) (3, 6-9, 11, 13-18, 21, 22, 36), mentre i pazienti sottoposti a radiofrequenza con moving shot hanno noduli con componente solida variabile da 0 a 100% (37-39).
Non sono disponibili dati sulla percentuale di pazienti con noduli cistici rispetto a quelli con noduli solidi nella popolazione sottoposta a RF. Una comparazione può essere tentata con la radiofrequenza con ago da 14 G (40, 41), che arruola noduli mediamente più grandi per il grande calibro dell’ago usato e l’espansione degli uncini. In questo caso i volumi medi iniziali tra le due tecniche sono comparabili (17.9±12.6 mL per il laser vs 19.8±4.8 mL per la RF con ago uncinato), ma nel caso della RF viene riportata una componente solida > 30%, il che significa che esiste una significativa componente cistica che gioca un ruolo non trascurabile nella percentuale di riduzione volumetrica. A conferma di quanto discusso sono i dati non ancora pubblicati dell’analisi uni- e multivariata della popolazione sottoposta allo studio RCT multicentrico italiano. Gli unici fattori predittivi condizionanti l’entità della riduzione volumetrica sono il volume iniziale dei noduli e la presenza della componente liquida. Stiamo parlando di una popolazione con noduli solidi o prevalentemente solidi e quindi con componente liquida ≤ 20% sottoposti ad ablazione laser. Questo dato conferma che più i noduli sono piccoli, più si riducono e in presenza di una modesta componente liquida, come appunto quella del 20%, si riducono ancor più facilmente.
Conclusioni
Il trattamento ablativo con ipertermia trova la sua indicazione nei casi di nodulo singolo o dominante ben identificabile ecograficamente e clinicamente e a carattere non iperfunzionante (scintigrafia con 99mTc e TSH e ormoni tiroidei sierici nei limiti della norma).
Sono necessari due esami citologici negativi per malignità (classe TIR 2 della classificatione SIAPEC) non antecedenti più di sei mesi.
Il trattamento è reso appropriato dalla presenza di sintomi di compressione locale (senso di costrizione alla gola e/o difficoltà alla deglutizione), “danno” cosmetico o crescita progressiva senza caratteri di sospetto clinico.
E’ opportuno eseguire la sola terapia ipertermica nel caso di noduli solidi o prevalentemente solidi. Nei casi con componente cistica compresa tra il 20 e il 50% è opportuno effettuare una PEI prima della termoablazione (42). Opportuno eseguire la sola PEI nei casi con vasta componente liquida (> 50%).
Bibliografia
- Pacella CM, Bizzarri G, Guglielmi R, et al. Thyroid tissue: US-guided percutaneous interstitial laser ablation-a feasibility study. Radiology 2000, 217: 673-7.
- Cakir B, Topaloglu O, Gul K, et al. Ultrasound-guided percutaneous laser ablation treatment in inoperable aggressive course anaplastic thyroid carcinoma: the introduction of a novel alternative palliative therapy--second experience in the literature. J Endocrinol Invest 2007, 30: 624-5.
- Rotondi M, Amabile G, Leporati P, et al. Repeated laser thermal ablation of a large functioning thyroid nodule restores euthyroidism and ameliorates constrictive symptoms. J Clin Endocrinol Metab 2009, 94: 382-3.
- Dossing H, Bennedbaek FN, Hegedus L. Ultrasound-guided interstitial laser photocoagulation of an autonomous thyroid nodule: the introduction of a novel alternative. Thyroid 2003, 13: 885-8.
- Cakir B, Gul K, Ersoy R, et al. Subcapsular hematoma complication during percutaneous laser ablation to a hypoactive benign solitary thyroid nodule. Thyroid 2008, 18: 917-8.
- Dossing H, Bennedbaek FN, Karstrup S,et al. Benign solitary solid cold thyroid nodules: US-guided interstitial laser photocoagulation--initial experience. Radiology 2002, 225: 53-7.
- Spiezia S, Vitale G, Di Somma C, et al. Ultrasound-guided laser thermal ablation in the treatment of autonomous hyperfunctioning thyroid nodules and compressive nontoxic nodular goiter. Thyroid 2003, 13: 941-7.
- Pacella CM, Bizzarri G, Spiezia S, et al. Thyroid tissue: US-guided percutaneous laser thermal ablation. Radiology 2004, 232: 272-80.
- Papini E, Guglielmi R, Bizzarri G, et al. Ultrasound-guided laser thermal ablation for treatment of benign thyroid nodules. Endocr Pract 2004, 10: 276-83.
- Cakir B, Topaloglu O, Gul K, et al. Effects of percutaneous laser ablation treatment in benign solitary thyroid nodules on nodule volume, thyroglobulin and antithyroglobulin levels, and cytopathology of nodule in 1 yr follow-up. J Endocrinol Invest 2006, 29: 876-84.
- Amabile G, Rotondi M, De Chiara G, et al. Low-energy interstitial laser photocoagulation for treatment of nonfunctioning thyroid nodules: therapeutic outcome in relation to pretreatment and treatment parameters. Thyroid 2006, 16: 749-55.
- Valcavi R, Bertani A, Pesenti M, et al. Laser and Radiofrequency ablation procedures. In: Baskin HJ, Duick DS, Levine RA eds. Thyroid ultrasound and ultrasound guided FNA biopsy. Second Edition. New York: Springer 2008: 191-218.
- Valcavi R, Riganti F, Bertani A, et al. Percutaneous laser ablation of cold benign thyroid nodules: a 3-year follow-up study in 122 patients. Thyroid 2010, 20: 1253-61
- Amabile G, Rotondi M, Pirali B, et al. Interstitial laser photocoagulation for benign thyroid nodules: time to treat large nodules. Lasers Surg Med 2011, 43: 797-803.
- Dossing H, Bennedbaek FN, Hegedus L. Effect of ultrasound-guided interstitial laser photocoagulation on benign solitary solid cold thyroid nodules - a randomised study. Eur J Endocrinol 2005, 152: 341-5.
- Gambelunghe G, Fatone C, Ranchelli A, et al. A randomized controlled trial to evaluate the efficacy of ultrasound-guided laser photocoagulation for treatment of benign thyroid nodules. J Endocrinol Invest 2006, 29: RC23-6.
- Papini E, Guglielmi R, Bizzarri G, et al. Treatment of benign cold thyroid nodules: a randomized clinical trial of percutaneous laser ablation versus levothyroxine therapy or follow-up. Thyroid 2007, 17: 229-35.
- Dossing H, Bennedbaek FN, Hegedus L. Long-term outcome following interstitial laser photocoagulation of benign cold thyroid nodules. Eur J Endocrinol 2011, 165: 123-8.
- Barbaro D, Orsini P, Lapi P, et al. Percutaneous laser ablation in the treatment of toxic and pretoxic nodular goiter. Endocr Pract 2007, 13: 30-6.
- Cakir B, Gul K, Ugras S, et al. Percutaneous laser ablation of an autonomous thyroid nodule: effects on nodule size and histopathology of the nodule 2 years after the procedure. Thyroid 2008, 18: 803-5.
- Cakir B, Topaloglu O, Gul K,et al. Effects of percutaneous laser ablation treatment in benign solitary thyroid nodules on nodule volume, thyroglobulin and anti-thyroglobulin levels, and cytopathology of nodule in 1 yr follow-up. J Endocrinol Invest 2006, 29: 876-84.
- Dossing H, Bennedbaek FN, Hegedus L. Effect of ultrasound-guided interstitial laser photocoagulation on benign solitary solid cold thyroid nodules: one versus three treatments. Thyroid 2006, 16: 763-8.
- Valcavi R, Frasoldati A. Ultrasound-guided percutaneous ethanol injection therapy in thyroid cystic nodules. Endocr Pract 2004, 10: 269-75.
- Dossing H, Bennedbaek FN, Bonnema SJ, et al. Randomized prospective study comparing a single radioiodine dose and a single laser therapy session in autonomously functioning thyroid nodules. Eur J Endocrinol 2007, 157: 95-100.
- Pacella CM, Bizzarri G, Francica G, et al. Percutaneous laser ablation in the treatment of hepatocellular carcinoma with small tumors: analysis of factors affecting the achievement of tumor necrosis. J Vasc Interv Radiol 2005, 16: 1447-57.
- Nikfarjam M, Muralidharan V, Malcontenti-Wilson C, et al. Progressive microvascular injury in liver and colorectal liver metastases following laser induced focal hyperthermia therapy. Lasers Surg Med 2005, 37: 64-73.
- Di Rienzo G, Surrente C, Lopez C, et al. Tracheal laceration after laser ablation of nodular goitre. Interac Cardiovasc Thorac Surg 2012, 14: 115-6.
- Achille G, Grammatica L. Percutaneous Ultrasound-Guided Laser Ablation in Cold Benign Thyroid Nodules: A prospective Study on 68 Patients Treated at "Istituto Giovanni Paolo II" of Bari. 2012 work in progress.
- Ahrar K, Gowda A, Javadi S, et al. Preclinical assessment of a 980-nm diode laser ablation system in a large animal tumor model. J Vasc Interv Radiol 2010, 21: 555-61.
- Jayasree RS, Gupta AK, Bodhey NK, et al. Effect of 980-nm diode laser and 1064-nm Nd:YAG laser on the intervertebral disc--in vitro and in vivo studies. Photomed Laser Surg 2009, 27: 547-52.
- Mertyna P, Hines-Peralta A, Liu ZJ, et al. Radiofrequency ablation: variability in heat sensitivity in tumors and tissues. J Vasc Interv Radiol 2007, 18: 647-54.
- Nikfarjam M, Muralidharan V, Christophi C. Mechanisms of focal heat destruction of liver tumors. J Surg Res 2005, 127: 208-23.
- Ritz JP, Lehmann KS, Zurbuchen U, et al. Ex vivo and in vivo evaluation of laser-induced thermotherapy for nodular thyroid disease. Lasers Surg Med 2009, 41: 479-86.
- Ritz JP, Lehmann KS, Schumann T, et al. Effectiveness of various thermal ablation techniques for the treatment of nodular thyroid disease--comparison of laser-induced thermotherapy and bipolar radiofrequency ablation. Lasers Med Sci 2011, 26: 545-52.
- Huh JY, Baek JH, Choi H, et al. Symptomatic Benign Thyroid Nodules: Efficacy of Additional Radiofrequency Ablation Treatment Session--Prospective Randomized Study. Radiology 2012, 263: 909-16.
- Cakir B, Ugras NS, Gul K, et al. Initial report of the results of percutaneous laser ablation of benign cold thyroid nodules: evaluation of histopathological changes after 2 years. Endocr Pathol 2009, 20: 170-6.
- Kim YS, Rhim H, Tae K, et al. Radiofrequency ablation of benign cold thyroid nodules: initial clinical experience. Thyroid 2006, 16: 361-7.
- Jeong WK, Baek JH, Rhim H, et al. Radiofrequency ablation of benign thyroid nodules: safety and imaging follow-up in 236 patients. Eur Radiol 2008, 18: 1244-50.
- Baek JH, Kim YS, Lee D, et al. Benign predominantly solid thyroid nodules: prospective study of efficacy of sonographically guided radiofrequency ablation versus control condition. AJR Am J Roentgenol 2010, 194: 1137-42.
- Deandrea M, Limone P, Basso E, et al. US-guided percutaneous radiofrequency thermal ablation for the treatment of solid benign hyperfunctioning or compressive thyroid nodules. Ultrasound Med Biol 2008, 34: 784-91.
- Spiezia S, Garberoglio R, Di Somma C, et al. Efficacy and safety of radiofrequency thermal ablation in the treatment of thyroid nodules with pressure symptoms in elderly patients. J Am Geriatr Soc 2007, 55: 1478-9.
- Dossing H, Bennedbaek FN, Hegedus L. Beneficial effect of combined aspiration and interstitial laser therapy in patients with benign cystic thyroid nodules: a pilot study. Br J Radiol 2006, 79: 943-7.
Termo-ablazione con micro-onde nella patologia tiroidea
Daniele Barbaro & Raffaella Forleo
UO Endocrinologia, ASL Nordovest Toscana
(aggiornato al febbraio 2024)
Introduzione e principi fisici
Negli ultimi 30 anni, dopo i primi lavori pionieristici con la termo-ablazione laser (LA), le tecniche mini-invasive non chirurgiche eco-guidate in ambito tiroideo hanno acquisito un’enorme rilevanza (1). In particolare le metodiche di termo-ablazione rappresentano quelle più ampiamente impiegate in campo tiroideo, anche se recentemente vi sono studi con metodiche diverse quali la crio-ablazione.
Il principio della termo-ablazione è che il calore applicato per un certo periodo di tempo può determinare un danno tissutale irreversibile. Le metodiche impiegate da più tempo e per le quali esiste una più ampia letteratura scientifica sono la LA e la radiofrequenza (RF). Oltre a queste si ricorda l’High Frequency Ultrasonography (HIFU) e l’ablazione con micro-onde (MWA), della quale andremo a trattare nello specifico. Vale la pena di ricordare che l’HIFU, per la quale vi era stato un iniziale interesse in quanto totalmente non intrusiva (nessun uso di aghi o antenne inserite per via percutanea), ha mostrato un’efficacia apparentemente inferiore alle altre metodiche, pur in presenza di notevole componente dolorosa durante l’esecuzione.
Il principio della MWA (1) si basa sul particolare effetto delle radiazioni elettro-magnetiche (RE) con la materia organica e dipende dalla lunghezza d’onda e relativa frequenza. Come noto, lo spettro elettro-magnetico è l'insieme di tutte le possibili frequenze della RE: comprende la parte di spettro visibile, che occupa la sezione centrale per frequenza e lunghezza d’onda e che costituisce la luce percepita dai nostri occhi. In rapporto allo spettro visibile, avremo dunque RE a frequenza minore e maggiore. Le onde di frequenza minore (e dunque di lunghezza d’onda più ampia), vanno dall’infrarosso alle onde radio. Esse hanno minore energia, risultando scarsamente dannose per gli organismi viventi, con effetto termico in caso di vicinanza alla fonte di emissione. Viceversa, come noto, le radiazioni a frequenza elevata, dall'ultravioletto ai raggi gamma, hanno un effetto ionizzante e producono danni biologici.
Nell’ambito delle RE, le micro-onde sono RE nello spettro con frequenza più bassa rispetto al visibile, in particolare nella parte a più alta frequenza fra le radiofrequenze (fig 1).
Figura 1
In sostanza, dunque, le micro-onde fanno parte delle radiofrequenze e hanno una frequenza compresa tra 300 MHz e 300 GHz (corrispondenti a lunghezze d’onda tra 1 m e 1 mm). L’effetto biologico è comunque diverso fra RF e MWA. Nei cosiddetti trattamenti con RF (lunghezza d’onda > 1 mm e frequenza < 300 MHz), il campo elettro-magnetico oscillante riesce a spostare gli ioni, dando origine all'assorbimento di energia sotto forma di calore, fenomeno relativamente lento. A frequenze più elevate, cioè con MWA, il tipo di interazione con la materia cambia e non si ha più spostamento di ioni a causa della loro inerzia. In sostanza le micro-onde interagiscono con i dipoli (e l’acqua è un dipolo naturale), che si mettono a oscillare in sintonia con il campo elettro-magnetico. È il movimento dei dipoli che genera sempre per "attrito" l'assorbimento di energia da parte del tessuto e quindi la formazione di calore, fenomeno più rapido rispetto al movimento di ioni che avviene nelle RF (fig 2).
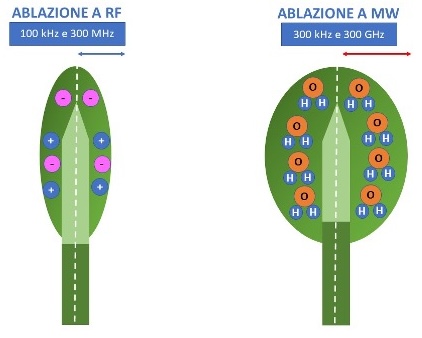
Figura 2
Per le loro caratteristiche fisiche, dunque, le micro-onde sembrerebbero l’energia elettro-magnetica ideale per l’applicazione clinica nelle termo-ablazioni, in particolare, per la possibilità di raggiungere temperature elevate in tempi molto rapidi. Come vedremo dopo, anche altri parametri rappresentano aspetti clinico/pratici di fondamentale importanza, tra cui il monitoraggio dell’energia erogata e il momento in cui spostare l’antenna nella tecnica “moving shot”.
Il trattamento in pratica
La MWA ha notevoli analogie con la RF più propriamente detta. Vi è un generatore con modalità specifica per la tiroide e un display di controllo. Gli aghi, più specificatamente chiamati antenne, hanno diametri variabili a secondo delle ditte produttrici (14-17 G per la tiroide). Le antenne vengono inserite all’interno del nodulo sotto guida ecografica (quelle da 16-17 G non necessitano di pre-incisione). Per noduli piuttosto piccoli l’antenna può essere mantenuta ferma all’interno del nodulo, mentre per noduli di maggiori dimensioni si esegue l’approccio trans-istmico e il “moving shot”, spostando l’antenna allorché compare la tipica iperecogenicità indicativa di danno tissutale irreversibile (1,3,4).
La MWA differisce dalla RF, in quanto il monitoraggio non dipende dall’impedenza evidenziata dalla macchina, ma dall’aspetto ecografico della singola area trattata: dunque è lo stesso monitoraggio ecografico che determina il movimento dell’ago. Nella MWA il calore per induzione non viene penalizzato dai grossi vasi e il volume trattato è più omogeneo. Una peculiarità della MWA è inoltre che l’ipertermia non si sviluppa in modo totalmente anteriore rispetto all’estremità dell’antenna, ma tende a estendersi un po' anche posteriormente, come riportato in figura 2. Certamente la MWA appare di grande interesse, seppur può essere di gestione un po' più difficile: infatti, poiché il calore non risente dei dissipatori fisiologici, quali i vasi sanguigni, e dell’eventuale carbonizzazione, è potenzialmente più rischiosa a livello tiroideo, dove vi sono strutture contigue particolarmente delicate. La durata del trattamento dipende dai Watt erogati e dal tempo, i quali determinano il volume della conseguente ipertermia generata dall’antenna (tabella) e ovviamente dal volume globale del nodulo, comunque nell’ordine della decina di minuti.
| Tempo | Potenza | ||
| 20 W | 25 W | 30 W | |
| 15 sec | 5 x 8 mm | 5 x 8.5 mm | 5 x 9 mm |
| 20 sec | 5 x 9 mm | 5.5 x 9 mm | 5.5 x 9.5 mm |
| 25 sec | 5.5 x 9 mm | 6 x 9.5 mm | 6 x 10 mm |
| 30 sec | 6 x 9.5 mm | 6.5 x 10 mm | 6.5 x 10.5 mm |
Indicazioni alla MWA, efficacia e complicanze
Le indicazioni in ambito tiroideo sono sostanzialmente le stesse delle altre tecniche di termo-ablazione, in particolare noduli tiroidei benigni (BTN) sintomatici, a cui si è aggiunta la recente possibile indicazione per i carcinomi tiroidei di piccole dimensioni.
La letteratura è certamente meno ricca rispetto a quella sulle tecniche più usate, quali LA e RF: al momento della scrittura dell’articolo digitando su PubMed “microwaves, thyroid ablation” si trovano 234 lavori contro i 524 lavori su LA e i 736 per RF (per contro, per HIFU i lavori sono meno di 100).
Una sintesi della letteratura, con particolare riferimento ai lavori più significativi, mostra che la MWA può rappresentare un’opzione in campo tiroideo. Una prima metanalisi nel 2018 (3), comprendente 9 studi per un totale di 1461 pazienti, aveva mostrato buona efficacia e una percentuale di complicanze maggiori di circa il 5% (danno ricorrenziale, rottura del nodulo, altri danni nervosi). In questa metanalisi era stata inoltre valutata la differenza fra l’utilizzo di MWA con antenna raffreddata e non: i dati circa il comfort del paziente e le complicanze minori (in particolare il dolore) erano nettamente a favore dell’antenna raffreddata, mentre non vi era differenza per le complicanze maggiori. Nello studio con più ampia casistica (115 pazienti) di comparazione con altre metodiche, sono stati valutati in tutto 144 noduli (con componente solida > 75%) utilizzando la tecnica “moving shot”. I risultati erano sovrapponibili a quelli della RF: la variazione del volume a 1, 3, 6, 9 e 12 mesi è stata del 30.5%, 56.0%, 69.3%, 76.6% e 84.7% (4).
Globalmente considerati, i lavori sembrano dunque indicare una sostanziale sovrapposizione dei risultati fra RF e MWA, anche se una più recente recente metanalisi che ha esaminato 5 studi, per un totale di 899 pazienti con 956 BTN trattati con RF e 869 pazienti con 938 BTN trattati con MWA, sembra leggermente a favore della RF (5). Non vi era differenza a 3 e 6 mesi, mentre la riduzione volumetrica a 12 mesi era maggiore con RF (86.2% vs 80.0%, p = 0.036). Nessuna differenza viceversa è stata notata in termini di complicazioni maggiori o minori. La RF dunque, secondo questa metanalisi, potrebbe avere un miglior risultato a lungo termine. Peraltro, come accennato, parametri quali dimensioni dei noduli e ipervascolarizzazione possono costituire un bias, influendo nella preferenza verso una delle metodiche e dunque anche nei risultati.
Più recentemente la varie metodiche di termo-ablazione son state proposte e utilizzate anche in campo oncologico tiroideo. Vi è evidenza dell’ottima efficacia della MWA su carcinomi papillari di piccole dimensioni. In uno fra i primi studi su 15 pazienti (21 noduli con diagnosi citologica di carcinoma papillare) la MWA ha ottenuto una riduzione del volume a 36 mesi del 98.8 ± 5.6%. Durante il periodo di follow-up (36-48 mesi), 20 dei 21 noduli hanno mostrato un completo riassorbimento e non è stato trovato alcun nodulo con tendenza alla ricrescita. Questo studio aveva utilizzato un’antenna da 16 G con finestra di diffusione da 3.5 mm e basse potenze (20 Watt) (6).
Sempre in campo oncologico vi sono studi di confronto MWA vs RF. In un recentissimo studio retrospettivo (gennaio 2021-dicembre 2022) su 512 pazienti, 346 trattati con RF e 166 con MWA, i risultati erano uguali in termini di scomparsa delle lesioni e mancata recidiva (7). Inoltre, sono recentemente comparsi lavori circa l’impiego con successo di MWA anche in carcinomi papillari multi-focali e nelle metastasi latero-cervicali (7-10). L’impiego in campo oncologico per tutte le termo-ablazioni rappresenta a nostro giudizio una possibilità da tener presente solo in casi particolari.
Conclusioni
La MWA utilizza una frequenza più alta nell’ambito delle radiofrequenze che viene generata da un’antenna. L’interazione avviene con l’acqua (dipoli naturali) ed è rapida.
La metodica è eco-guidata e richiede esperienza. A parità di potenza, il diametro della necrosi è maggiore di quello ottenuto con RF.
Indicazioni e attenzioni speciali sono simili a quelle delle altre termo-ablazioni, in particolare della RF, con cui c’è la maggiore affinità. Andrà definito se alcune caratteristiche dei noduli debbano orientare preferibilmente verso MWA piuttosto che RF.
MWA merita forse una speciale attenzione, dovuta al fatto che il riscaldamento si estende un po' posteriormente e non è bloccato da carbonizzazione né dissipato da componenti liquide.
Le possibili complicanze maggiori non sembrano più frequenti rispetto alla RF.
Bibliografia
- Hu QL, Kuo JH. Choice in ablative therapies for thyroid nodules. J Endocr Soc 2023, 7: bvad078.
- Goldberg SN. Radiofrequency tumor ablation: principles and techniques. Eur J Ultrasound 2001, 13: 129-47.
- Zheng BW, Wang JF, Ju JX, et al. Efficacy and safety of cooled and uncooled microwave ablation for the treatment of benign thyroid nodules: a systematic review and meta-analysis. Endocrine 2018, 62: 307-17.
- Yue W, Wang S, Wang B, et al. Ultrasound guided percutaneous microwave ablation of benign thyroid nodules: safety and imaging follow-up in 222 patients. Eur J Radiol 2013, 82: e11-6.
- Wu W, Gong X, Zhou Q, et al. Ultrasound-guided percutaneous microwave ablation for solid benign thyroid nodules: comparison of MWA versus control group. Int J Endocrinol 2017, 2017: 9724090.
- Guo DM, Chen Z, YX, Hong-Hui S. Comparison of radiofrequency ablation and microwave ablation for benign thyroid nodules: a systematic review and meta-analysis. Clin Endocrinol (Oxf) 2021, 95: 187-96.
- Teng D, Sui G, Liu C, et al. Long-term efficacy of ultrasound-guided low power microwave ablation for the treatment of primary papillary thyroid microcarcinoma: a 3-year follow-up study. J Cancer Res Clin Oncol 2018, 144: 771-9.
- Li N, Dong Y, Ding Y, et al. Comparison of the efficacy and safety of ultrasound-guided radiofrequency ablation and microwave ablation for the treatment of unifocal papillary thyroid microcarcinoma: a retrospective study. Int J Hyperthermia 2024, 41: 2287964.
- Zhou HD, Yu XY, Wei Y, et al A preliminary study on the microwave ablation of multifocal papillary thyroid microcarcinoma. Acad Radiol 2024, DOI: 10.1016/j.acra.2024.01.007.
- Zhang S, Liu Y, Zhou B, Xu H. Efficacy and safety of percutaneous ultrasound-guided thermal ablation in the treatment of cervical metastatic lymph nodes from papillary thyroid carcinoma. Clin Hemorheol Microcirc 2024, DOI: 10.3233/CH-231998.

