Anestesia in pazienti con patologie endocrino-metaboliche
Saul Collini
Dipartimento di Scienze Medico-Chirurgiche e Medicina Traslazionale, Università Sapienza di Roma
(aggiornamento al 13 dicembre 2019)
INTRODUZIONE
Con il termine di anestesia si intende la possibilità di garantire l’analgesia e il controllo dello stato di coscienza al paziente che deve essere sottoposto a manovre diagnostiche e/o chirurgiche potenzialmente dolorose. Tale condizione può essere raggiunta utilizzando metodiche di anestesia loco-regionale e generale.
Nell’ambito dell’anestesia loco-regionale, possiamo distinguere tecniche diverse di blocco crescente sulle fibre nervose: anestesia locale per infiltrazione, anestesia plessica, anestesia extra-durale o epidurale e anestesia intra-durale o subaracnoidea. A ognuna di queste metodiche corrisponde una distribuzione territoriale più estesa dell’analgesia, che risulta inversamente proporzionale, dalla periferia al midollo, al quantitativo di anestetico locale impiegato. Il dosaggio equi-analgesico, dalla periferia al centro va da 1:10 fino a 1:100: gli stessi 2-3 mL di anestetico locale infiltrato per via sottocutanea per l’asportazione di una piccola neoformazione sono in grado, a livello subaracnoideo, di determinare la completa analgesia e il blocco motorio della regione sotto-ombelicale dell’organismo.
Gli anestetici locali sono in grado di provocare un blocco reversibile della conduzione dell’impulso dolorifico e motorio, per blocco dei canali del Na. Dal punto di vista chimico, si dividono in esteri (procaina, clorprocaina, tetracaina) e amidi (lidocaina, mepivacaina, bupivacaina, prilocaina, etidocaina, ropivacaina). Entrambe le classi sono costituite da tre porzioni: un polo idrofilo, che condiziona la diffusione della forma non ionizzata e la ionizzazione; un polo lipofilo, che controlla la fissazione alle proteine plasmatiche e quindi l’attività dell’anestetico locale; una catena intermedia, che identifica il legame esterico o amidico della molecola. Le caratteristiche chimiche degli agenti anestetici locali determinano l’inizio dell’effetto, la durata e il grado di blocco analgesico e motorio. L’associazione di un vaso-costrittore (adrenalina) riduce il riassorbimento ematico e quindi incrementa la sua durata.
L’anestesia generale consta di tre momenti: l’induzione, il mantenimento e il risveglio. I farmaci impiegati servono essenzialmente a indurre e mantenere lo stato di sonno, l’analgesia e, in caso di necessità, il blocco neuro-muscolare. La moderna anestesia generale fa riferimento a una tecnica di somministrazione dei farmaci totalmente endovenosa. Dal concetto di TIVA (total intravenous anesthesia) si è passati a quello di TCI (target control infusion): i farmaci sono i medesimi, il risultato diverso. La TIVA viene impostata, utilizzando i farmaci a un dosaggio controllato manualmente dall’anestesista, mentre con la TCI la concentrazione plasmatica del farmaco impiegato viene mantenuta costante, grazie all’utilizzo di pompe infusionali dotate di un software basato su età e peso del paziente. Questo avanzamento tecnico ha permesso di poter garantire il quantitativo di ipno-induttore del sonno, di analgesico o di agente di blocco neuromuscolare alla concentrazione scelta dall’anestesista (il cosiddetto sito effettore). Nella fase che precede il risveglio, interrompendo la somministrazione del farmaco, il software è in grado di identificare, con discreta precisione, l’intervallo di tempo necessario per recuperare lo stato di coscienza del paziente.
I farmaci dell’anestesia generale possono essere suddivisi in tre categorie:
- induttori del sonno (propofol, midazolam, dexmedetomidine);
- analgesici oppioidi (fentanyl, alfentanyl, remifentanyl, sufentanyl);
- bloccanti neuro-muscolari (cis-atracurium, bromuro di pancuronio, rocuronio).
La combinazione dei farmaci delle prime due categorie, tramite le medesime pompe infusionali continue, con dosaggi diversificati, permette di realizzare gradi diversi di sedazione cosciente, incosciente, fino ad arrivare ad una condizione di anestesia generale. Il blocco neuro-muscolare, indispensabile durante tutti gli interventi chirurgici in video-laparoscopia, a rischio di fenomeni estremamente pericolosi di curarizzazione residua nell’immediato post-operatorio, è stato risolto grazie alla disponibilità del sugammadex (Bridion®), antagonista selettivo dei miorilassanti, che ingloba e rende inattivo il farmaco residuo in circolo.
Il monitoraggio dei parametri vitali finora conosciuti e di quelli comparsi recentemente sulla scena, ha permesso di realizzare la condizione identificata dal concetto di “closed-loop-anesthesia”. Questo termine indica la capacità, sempre più sofisticata, di modulare la somministrazione dei farmaci per la sedazione o l’anestesia generale, monitorando una serie di parametri (dalla semplice pressione arteriosa, alla saturazione di ossigeno periferica, fino alla contrattilità muscolare e al monitoraggio neurologico). Quest’ultimo, tramite il BIS (Bispectral Index) o l’AEP (Auditory Evoked Potential), i potenziali evocati acustici, permette di identificare il livello di addormentamento del paziente, evitando un sovraccarico inutile di farmaci per la sedazione e l’analgesia.
La valutazione pre-operatoria del paziente chirurgico rappresenta la tappa fondamentale per la scelta della metodica anestesiologica più adeguata. La visita pre-anestesiologica identifica tutte quelle criticità fisiopatologiche, che potrebbero riverberarsi sia sulla fase intra-operatoria che sul recupero dall’anestesia e sul periodo post-operatorio. Per la valutazione dell'eventuale difficiltà di intubazione si usano la scala di Mallampati (fig 1) e l'indice di rischio di el-Ganzouri (tab 1).
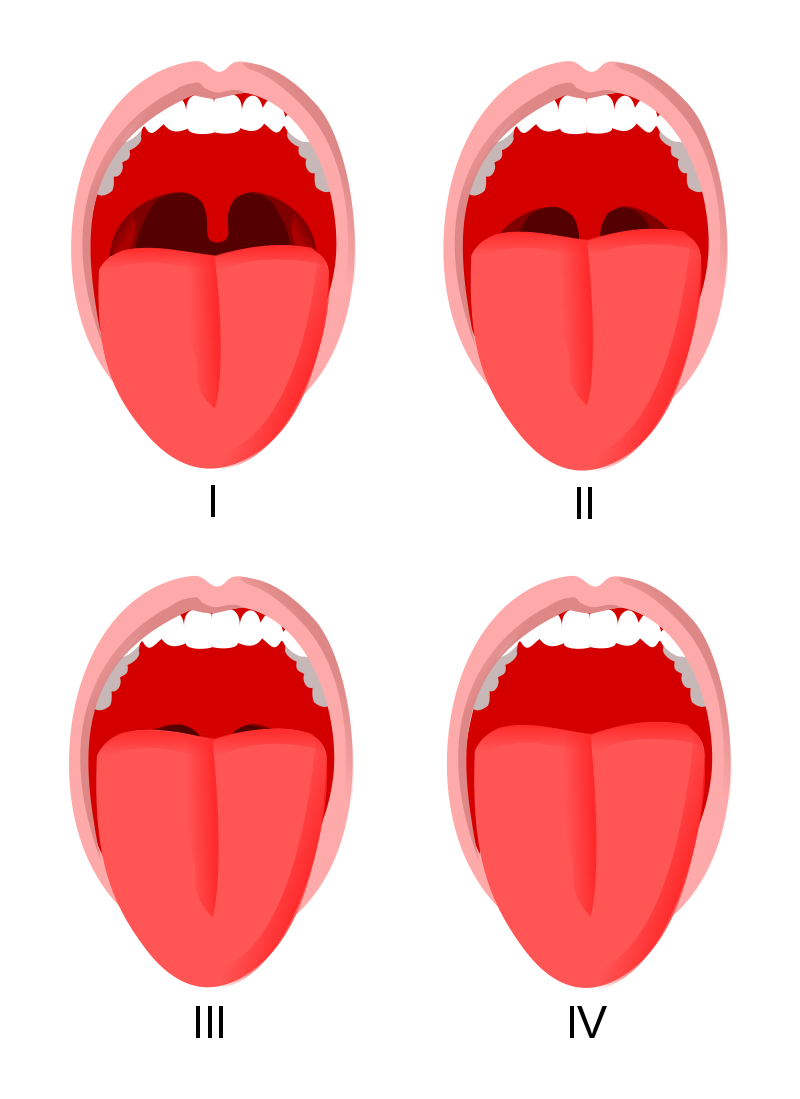
Figura 1.
Scala di Mallampati:
classe I: palato molle, ugola e pilastri visibili;
classe II: palato molle e ugola visibili;
classe III: palato molle e base dell'ugola visibili;
classe IV: solo il palato duro è visibile.
| Tabella 1 Indice di rischio di el-Ganzouri |
||
| Variabile | Valutazione | Punteggio |
| Apertura della bocca (cm) | ≥ 4 | 0 |
| < 4 | 1 | |
| Distanza tiro-mentoniera (cm) | > 6.5 | 0 |
| 6.0-6.5 | 1 | |
| < 6 | 2 | |
| Scala di Mallampati | I | 0 |
| II | 1 | |
| III-IV | 2 | |
| Movimento del collo | > 90° | 0 |
| 80-90° | 1 | |
| < 80° | 2 | |
| Prognatismo | Sì | 0 |
| No | 1 | |
| Peso corporeo (kg) | < 90 | 0 |
| 90-110 | 1 | |
| > 110 | 2 | |
| Anamnesi di intubazione difficile | Nessuna | 0 |
| Dubbia | 1 | |
| Certa | 2 | |
|
Punteggio:
|
||
Le patologie d’organo endocrino-metaboliche, indipendentemente dal fatto che rappresentino l’indicazione chirurgica stessa, richiedono una diagnosi accurata perché possono essere associate a manifestazioni su altri organi bersaglio. Sono note, ad esempio, le patologie correlate al diabete (cardiache, renali, neuropatie periferiche), che devono essere identificate, valutate e armonizzate con il protocollo anestesiologico.
La preparazione del paziente chirurgico affetto da patologie delle ghiandole surrenali (s. di Cushing, s. di Conn, feocromocitoma), necessita di una collaborazione molto stretta tra specialisti (endocrinologo, chirurgo, radiologo, anestesista). La visita pre-operatoria da parte dell’anestesista richiede conoscenze specifiche di queste sindromi e delle loro interferenze con i farmaci dell’anestesia, alcune ad elevato rischio.
Anche se il trattamento chirurgico non riguarda gli organi endocrini, le malattie endocrine possono rappresentare una delle patologie delle quali il paziente è portatore, alla pari con una patologia cardiaca o vascolare. Pertanto, le eventuali terapie seguite dal paziente (cortico-steroidi, anti-diabetici, sostituti ormonali, ecc.) devono essere gestite per tutta la durata della fase peri-operatoria, in collaborazione con l’endocrinologo. La routine diagnostica pre-operatoria dovrà essere integrata da indagini ed esami ematochimici, al fine di precisare il quadro clinico complessivo e prendere le decisioni più adatte alla preparazione del paziente.
Attualmente, con l’avanzare dell’età media della popolazione, sono aumentati gli interventi chirurgici proponibili ed eseguibili; mentre fino a non molti anni fa l’età e le patologie associate scoraggiavano il ricorso alla chirurgia, attualmente le indicazioni e soprattutto le aspettative dei pazienti contribuiscono a spostare continuamente l’asticella del possibile. In questo scenario, le patologie endocrino-metaboliche presentano ricadute sia sulle misure prettamente anestesiologiche, indipendentemente dal trattamento chirurgico proposto, che sulla gestione peri-operatoria della chirurgia sugli organi endocrini; il diabete, ad esempio, richiede una preparazione specifica del paziente, così come la procedura anestesiologica nella chirurgia del feocromocitoma richiede un monitoraggio cruento della pressione arteriosa e il costante trattamento farmacologico intra-operatorio dei valori troppo elevati. Pertanto, prendendo in esame le principali patologie endocrine, dovremo tener conto sia delle interferenze endocrinologiche sulla condotta anestesiologica che sulle sindromi ormonali deprivative post-chirurgiche (tiroidectomia, asportazioni parziali dell’ipofisi, ecc).
IPOFISI
Ipofisi anteriore
La chirurgia dell'ipofisi può essere riferita quasi esclusivamente al trattamento degli adenomi ipofisari intra-sellari: tale patologia può determinare cefalea e compressione delle vie di conduzione dello stimolo visivo, con compromissione della funzione visiva. L’alterazione del tessuto sano dell’ipofisi può determinare modificazioni pressorie (ipotensione), ipoglicemia e ipotermia. Poiché l’accrescimento dell’adenoma è lento, la comparsa dei segni clinici può essere protratta nel tempo; solo in alcuni casi più rari l’esordio può essere quello di un’emorragia meningea, con i relativi sintomi da apoplessia ipofisaria.
Tra gli adenomi secernenti, i somatotropi determinano un quadro dismorfico, che può rendere difficile la gestione anestesiologica (vie aeree difficili).
Durante la valutazione pre-operatoria del paziente da sottoporre a chirurgia endoscopica per adenoma ipofisario, le principali criticità anestesiologiche sono legate alla storia cardio-vascolare del paziente e alla gestione delle vie aeree difficili, nei pazienti con OSAS (Obstructive Sleep Apnoea Syndrome), affetti da acromegalia o malattia di Cushing. A tale proposito, la valutazione pre-operatoria delle vie aeree è fondamentale per la scelta dei presidi più adatti per l’intubazione. I moderni video-laringoscopi hanno reso la manovra più agevole e meno traumatica, anche in condizioni di scarsa apertura della rima orale (< 2 cm). In condizioni di difficoltà prevista, si procede all’intubazione in condizioni di sedazione profonda, con respiro spontaneo conservato; l’utilizzo congiunto del fibro-broncoscopio permette l’intubazione oro-tracheale nei casi a rischio più elevato (grado 4 scala di Mallampati, punteggio ≥ 4 dell’indice di rischio di el-Ganzouri).
La pre-medicazione deve tacitare la reattività emotiva del paziente senza comprometterne la stabilità emodinamica e la funzione respiratoria; per tale motivo, è consigliabile ricorrere al midazolam, benzodiazepina idro-solubile a breve durata d’azione, mantenendo ogni eventuale terapia anti-ipertensiva personale.
I farmaci dell’anestesia generale, in questo caso, sono i medesimi degli interventi neurochirurgici maggiori, al fine di garantire un controllo ottimale della pressione endo-cranica, dei parametri emodinamici e delle complicanze legate alla posizione semi-seduta del paziente (embolia gassosa). Altre possibili complicanze sono la disregolazione della temperatura corporea, il deficit di steroidi (1,2), l’iposodiemia da alterata secrezione dell’ormone anti-diuretico (ADH). Tra i corticoidi naturali, quelli più utilizzati nel periodo intra-operatorio sono i derivati dell’idrocortisone (Flebocortid®), insieme al metilprednisolone succinato (Solu-Medrol®). La stabilità emodinamica è assicurata da un’anestesia generale totalmente endovenosa (TIVA) o con target controllato (TCI), con propofol® e remifentanil®, quale agente analgesico intra-operatorio principale (3,4).
Ipofisi posteriore
I disordini da deficit di ADH (diabete insipido) o da eccessiva secrezione di ADH rendono necessaria una valutazione specifica pre-operatoria e un trattamento pre-operatorio.
Le cause del diabete insipido possono essere molteplici (traumatiche, neoplastiche, infettive, vascolari); è noto poi l’effetto inibente di fenitoina, clorpromazina e litio sul rilascio dell’ADH e quello favorente di sulfaniluree (clorpropamide), clofibrato, carbamazepina. Dal punto di vista anestesiologico, al paziente con diabete insipido completo sarà sufficiente somministrare la dose intra-nasale o endovenosa di vasopressina, utilizzando esclusivamente soluzioni isotoniche intra-operatorie. In caso di marcato aumento dell’osmolarità plasmatica (> 290 mOsm/L), sarà necessario somministrare soluzioni ipotoniche e aumentare la dose di ADH al di sopra di 200 mU/h.
L’iperincrezione di ADH si accompagna a iponatremia, in presenza di osmolarità urinaria maggiore di quella plasmatica. Questa produzione di ADH è secondaria alla presenza di neoplasie (carcinomi a piccole cellule del polmone) o di patologia infiammatoria del polmone, insufficienza surrenalica o ipotiroidismo. L’inversione del rapporto osmolarità urinaria/plasmatica necessita di monitoraggio continuo della pressione venosa centrale, dell’osmolarità e dell’iponatremia, anche nel periodo post-operatorio.
Per quanto riguarda la condotta anestesiologica, non esistono contro-indicazioni all’utilizzo dei consueti farmaci per l’anestesia generale.
TIROIDE
La condotta anestesiologica non richiede il ricorso a farmaci particolari (5), ma è utile evitare, se possibile, la somministrazione di atropina solfato, a causa dell’effetto tachicardizzante ed è necessaria un’approfondita valutazione delle vie aeree, in caso di gozzo particolarmente voluminoso.
Ipertiroidismo
Le manifestazioni cliniche di interesse anestesiologico sono essenzialmente quelle cardiologiche (tachicardia, aritmia, fibrillazione atriale).
La preparazione del paziente in attesa di tiroidectomia totale può prevedere la somministrazione pre-operatoria, per circa 10 giorni, di litio carbonato, il quale blocca la proteolisi e gli ormoni di riserva, e desametasone, mentre i composti iodati (ioduro di potassio) non sembrano avere un’indicazione specifica (6).
Normalmente questi pazienti assumono farmaci β-bloccanti per ridurre la tachicardia da ipertiroidismo; in caso di emergenza, durante la fase intra-operatoria, il farmaco di scelta è l’esmololo (7), infuso in pompa endovenosa con dosaggio compreso tra 50-500 µg/kg, in assenza di scompenso cardiaco congestizio. Il propranololo, altro agente β-bloccante, è indicato in casi selezionati, a causa del suo effetto depressore sul miocardio (8).
Un’attenzione particolare va dedicata al monitoraggio della funzione neuro-muscolare, a causa di una predisposizione maggiore di questi soggetti alla miastenia; attualmente il problema è completamente risolto dalla disponibilità di flumazenil, antagonista selettivo degli agenti di blocco neuromuscolare (vecuronio bromuro, rocuronio), in grado di spiazzare e incapsulare ogni residuo della molecola miorilassante.
Una novità recente, con ricadute in campo anestesiologico, riguarda il monitoraggio del nervo ricorrente tramite un sistema dedicato, il quale rende necessario il posizionamento endo-tracheale di un tubo specifico, dotato di un sensore, subito al di sopra della cuffia, da posizionare correttamente a livello delle corde vocali. Mentre il sensore è interno al materiale siliconico del tubo, i fili che collegano il sensore all’apparecchiatura esterna per il monitoraggio escono dal tubo oro-tracheale e devono essere collocati con attenzione, all’interno e all’esterno della cavità buccale, per evitare lesioni delle mucose e delle labbra.
Ipotiroidismo
Nei casi di mixedema conclamato bisogna tener presente che questi pazienti potrebbero avere tempi di recupero prolungati dall’anestesia generale, tali da richiedere un’assistenza respiratoria protratta (9). L’ipotiroidismo può essere associato a patologia coronarica, a volte mascherata dalla malattia tiroidea; pertanto, è importante riconoscere l’emergenza coronarica vera, per attuare la terapia di rivascolarizzazione precoce (10).
Poiché l’ipotiroideo ha una risposta inadeguata alle modificazioni di temperatura, è importante, nella fase intra- e post-operatoria immediata, provvedere a riscaldare il paziente, sia utilizzando soluti a temperatura corporea sia con l’impiego di sistemi di riscaldamento della superficie corporea ad aria o con materassini a liquido.
PARATIROIDI
Dal punto di vista clinico, in presenza di un alterato funzionamento delle paratiroidi, possiamo identificare due condizioni: l’ipercalcemia e l’ipocalcemia.
Ipercalcemia
Il paziente chirurgico portatore di iperparatiroidismo primario deve essere attentamente valutato pre-operatoriamente, poiché le ripercussioni di tale sindrome possono interessare sia il cuore, con un accorciamento dell’intervallo PR o QT all’ECG, sia il rene, con aumento dell’eliminazione urinaria del calcio. La contemporanea somministrazione di fosfati, soluzioni isotoniche e diuretici può determinare ipomagnesiemia e ipopotassiemia; qualora subentri un’insufficienza renale acuta, l’unica misura di controllo è rappresentata dalla dialisi.
Gli anomali livelli di calcio, oltre che con il controllo ematico, possono essere valutati indirettamente mediante il monitoraggio del QT corretto (o QTc), normalmente compreso tra 0.30 e 0.45 sec. Pur essendo un parametro abbastanza grossolano, il suo confronto intra-operatorio con quello rilevato all’ECG pre-operatorio, può essere considerato significativo quando il QT è inferiore a metà dell’intervallo RR (fig. 2).
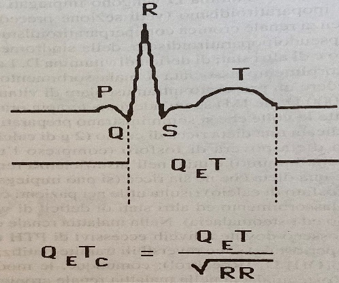
Figura 2. Da Hensel P, Roizen MF. Patients with disorders of parathyroid function. Anesthesiol Clin North Am 1987, 5: 284.
L’urgenza chirurgica nel paziente ipercalcemico deve minimizzare i rischi di bronco-aspirazione, a causa dello stato di coscienza alterato e del possibile stomaco pieno; il controllo radiografico della colonna cervicale può evidenziare instabilità del rachide e quindi consigliare una metodica di intubazione meno invasiva possibile (video-laringoscopia, fibro-broncoscopia) (11).
I farmaci impiegati per la conduzione di un’anestesia generale non differiscono da quelli per le più comuni procedure in chirurgia generale, con la possibilità, in questi ultimi anni, di poter superare le problematiche del recupero neuromuscolare al risveglio dall’anestesia generale, grazie all’utilizzo del sugammadex (Bridion®), antagonista selettivo degli agenti di blocco come il rocuronium (Esmeron®).
L’anestesia generale e l’intubazione tracheale sembrano provocare un aumento significativo del PTH nei pazienti con iperparatiroidismo primario, a differenza degli adulti normali (12). In alcune recenti pubblicazioni scientifiche, per incompatibilità dell’anestesia generale con le condizioni cliniche del paziente sono stati eseguiti trattamenti chirurgici mini-invasivi, in anestesia locale per infiltrazione o blocco del plesso cervicale, con blanda sedazione (12-14). L’utilizzo dell’ecografia intra-operatoria, dopo scintigrafia pre-operatoria, ha contribuito alla possibilità di escissione dell’adenoma in anestesia locale con sedazione (15).
Tra le complicanze post-operatorie più temute, dobbiamo annoverare la tetania ipocalcemica e la lesione bilaterale del nervo laringeo ricorrente, che rendono entrambe imperativa l’intubazione oro-tracheale.
Ipocalcemia
La sintomatologia clinica dell’ipocalcemia è correlata alla ridotta soglia di eccitazione nervosa, con manifestazioni parestesiche al volto e alle estremità, seguite da spasmi muscolari che possono interessare i muscoli laringei, fino a un vero e proprio stato di tetania e crisi convulsive. Tutto ciò impone una correzione pre-operatoria adeguata dell’ipocalcemia, tramite somministrazione di calcio gluconato per via endovenosa (10-20 mg al 10%); è necessario ricordare che l’effetto clinico è di breve durata, pertanto l’infusione dovrà essere protratta per alcune ore. Anche la concentrazione ematica di fosfato e magnesio deve essere monitorata nel post-operatorio.
SURRENE
Sindrome di Cushing, sindrome di Conn e feocromocitoma possono rappresentare il motivo del ricorso all’asportazione chirurgica della ghiandola surrenale, così come possono essere una patologia associata al quadro clinico del paziente, che deve essere sottoposto ad intervento chirurgico di altra natura. In entrambi i casi la preparazione del paziente è assolutamente prioritaria, al fine di un risultato soddisfacente e a basso rischio.
Sindrome di Cushing
Il trattamento pre-operatorio viene generalmente realizzato dall’endocrinologo, il quale rappresenta un aiuto insostituibile per l’anestesista che deve predisporre l’anestesia generale. Il management anestesiologico peri-operatorio inizia con la pre-medicazione e prosegue con la gestione delle vie aeree, spesso a rischio, per continuare con il posizionamento di sicurezza sul letto operatorio, la fase intra-operatoria e quella post-operatoria (tab 2).
| Tabella 2 Gestione anestesiologica peri-operatoria della sindrome di Cushing (16) |
|
| Periodo pre-operatorio | |
| Controllo cortisolemia | Inibitori steroidogenesi surrenalica (chetoconazolo, metirapone) |
| Ipertensione | Terapia farmacologica (ad eccezione di ACEI-inibitori e sartani) |
| Iperglicemia | Stop anti-diabetici orali e passaggio a insulina |
| Ipokaliemia | Spironolattone e supplementi di potassio |
| Ipercoagulabilità | Eparina a basso peso molecolare, calze elastiche e mobilizzazione precoce |
| Periodo intra-operatorio | |
| Piano anestesiologico dettagliato | Anestesia generale ± epidurale |
| Posizione | Protezione da fratture |
| Pre-medicazione | Evitare sedazione profonda |
| Rischio aspirazione gastrica | Induzione rapida, manovra di Sellick (compressione esterna sulla cricoide, per comprimere l’esofago sulla colonna cervicale) |
| Gestione vie aeree | Pre-ossigenazione, intubazione |
| Accessi venosi | Vena periferica di grosso calibro e catetere venoso centrale |
| Monitoraggio invasivo | Arteria radiale ed eventuale catetere di Swan-Ganz |
| Test ematici | Glicemia, elettroliti, pH |
| Insufficienza respiratoria | Estubazione vigile |
| Periodo post-operatorio | |
| Terapia del dolore | Aggressiva con oppioidi sistemici/epidurali |
| Test ematici | Glicemia, elettroliti, cortisolo e pH |
| Insufficienza respiratoria | Esercizi, anti-dolorifici, mobilizzazione |
| Trombosi venosa profonda | Eparina a basso peso molecolare, mobilizzazione precoce |
| Insufficienza surrenalica | Steroidi |
La terapia anti-ipertensiva assunta da quasi tutti i pazienti deve essere mantenuta fino al giorno dell’intervento: α-bloccanti, β-bloccanti, calcio-antagonisti, ma non ACE-inibitori e sartani, dotati di effetto sommatorio ipotensivo con i farmaci dell’induzione dell’anestesia.
L’iperglicemia è un fattore di rischio aumentato per morte, infezioni e ospedalizzazione protratta (17,18); nel peri-operatorio si consiglia di mantenere la glicemia tra 120–180 mg/dL (19).
La sedazione profonda è contro-indicata, a causa del rischio di ipossia e di intubazione difficile; per tale motivo, la fase di induzione dell’anestesia generale deve essere rapida e la gestione delle vie aeree deve prevedere la disponibilità di sistemi avanzati per l’intubazione oro-tracheale (video-laringoscopio e fibro-broncoscopio).
Il controllo del dolore post-operatorio deve essere adeguato: può essere utile il ricorso all’analgesia post-operatoria epidurale nei casi nei quali la somministrazione di oppioidi ad alto dosaggio può risultare a rischio di insufficienza respiratoria acuta (20).
Feocromocitoma
Rappresenta tuttora un impegno gravoso e costante per l’anestesista, che deve destreggiarsi durante quella che può essere definita una vera e propria tempesta, caratterizzata da picchi estremi di rialzi pressori e da crisi aritmiche complesse. L’induzione dell’anestesia è sicuramente la fase più a rischio, con picchi compresi tra il 25-50% di decessi (21). Il sistema cardio-vascolare è il bersaglio principale da valutare e monitorare e il trattamento pre-operatorio di scelta è con α1-bloccanti a breve durata d’azione (doxazosina 2-6 mg/die) (22). La fenossibenzamina, che determina ipotensione severa e prolungata dopo l’asportazione della ghiandola, deve essere sospesa 24-48 h prima della chirurgia. Le aritmie vengono trattate con β-bloccanti, insieme agli α-litici, mentre altri consigliano l’associazione di calcio-antagonisti, clonidina e magnesio solfato (23,24) (tab 3).
| Tabella 3 Farmaci vaso-attivi impiegati durante l’intervento per feocromocitoma (16) |
||
| Farmaco | Dosaggio | Osservazioni |
| Vaso-dilatatori | ||
| Propofol | Bolo 2-2.5 mg/kg Mantenimento 25-75 μg/kg/min |
Irritazione venosa, sindrome da infusione continua di propofol |
| Remifentanil | Bolo 1 μg/kg Mantenimento 0.05 μg/kg/min |
Depressione respiratoria, iperalgesia, vomito |
| Dexmetedomidine | Bolo 1 mg/kg Mantenimento 0.7 mg/kg/h |
Sedazione profonda |
| Nitroprussiato | 1-2 μg/kg/min | Ipotensione severa, tossicità cianati |
| Nitroglicerina | 25-250 μg/min | Tachicardia riflessa, metemoglobinemia |
| Nicardipina | 5 mg/h | Bradicardia, ipotensione severa, arresto cardiaco |
| Esmololo | Bolo 5-10 mg in 3-5 min | Blocco AV, iper-reflessia bronchiale |
| Labetalolo | Bolo 5-10 mg | |
| Urapidil | 10-15 mg/h | Ipotensione severa |
| Clonidina | 0.1-1.2 mg | Ipertensione di rimbalzo, secchezza fauci |
| Magnesio solfato | Carico 1-8 mg Mantenimento 1-4 mg/h |
Aumento effetto miorilassante |
| Vaso-costrittori | ||
| Epinefrina | 1-20 μg/min | Tachicardia |
| Norepinefrina | 1-30 μg/min | Bradicardia riflessa |
| Dopamina | 5-10 μg/min | Tachicardia, aritmia cardiaca |
| Fenilefrina | 10-100 μg/min | Bradicardia riflessa |
| Vasopressina | 0.1-0.4 U/min | Ischemia miocardica |
| Efedrina | 5-10 mg | Nessuno |
Al contrario dell’induzione anestesiologica nei pazienti con sindrome di Cushing, la pre-medicazione del paziente con feocromocitoma deve comportare una sedazione profonda, rispettando eventuali criticità delle vie aeree, mentre il mantenimento dell’anestesia generale deve escludere l’utilizzo di agenti con proprietà simpatico-mimetiche:
- sono da proscrivere la ketamina come ipno-induttore ed analgesico, il bromuro di pancuronio come mio-rilassante, i vapori alogenati come agenti ipnotici e analgesici intra-operatori;
- l’associazione farmacologica più indicata è dexmedetomidine per la sedazione, propofol come ipno-induttore, remifentanil come analgesico e rocuronium come mio-rilassante (25).
L’ipotensione post-operatoria può essere trattata con una delle amine simpatico-mimetiche riportate in tab 2, tenendo conto delle osservazioni a carico di ciascuna: fenilefrina e dopamina sono gli agenti di scelta della fase ipotensiva post-operatoria. Dopo circa 1-3 giorni il livello delle catecolamine evidenzia una diminuzione, per rientrare nella norma a distanza di circa 10 giorni dall’intervento chirurgico.
PANCREAS
I quadri clinici con ricadute importanti sulla gestione anestesiologica del paziente chirurgico sono essenzialmente due: l’ipoglicemia secondaria a deficit dietetico o iperinsulinismo (26) e l’iperglicemia secondaria a diabete mellito.
Ipoglicemia
Nel paziente ipoglicemico ci sono tre parametri caratteristici: quadro sintomatologico tipico, con stato di confusione e comportamento anomalo, glicemia compresa tra 40–45 mg/dL e miglioramento clinico dopo somministrazione di glucosio. L’iperinsulinismo secondario a insulinoma è caratterizzato dalla presenza della triade di Whipple (27): sintomi da ipoglicemia dopo esercizio fisico e digiuno, livelli di glicemia di 40-45 mg/dL e livello glicemico nella norma dopo somministrazione di glucosio per os o ev.
L’approccio anestesiologico peri-operatorio al paziente portatore di insulinoma si basa ovviamente sul mantenimento della glicemia entro i limiti desiderati: durante la notte precedente l’intervento chirurgico è indicato il destrosio al 5% nella prevenzione ipoglicemica.
Per quanto riguarda il periodo intra-operatorio, sono stati proposti due metodi differenti per monitorare l’iperglicemia da rimbalzo, sia dovuta all’asportazione dell’insulinoma che a un’eccessiva somministrazione di glucosio:
- sospensione della somministrazione di glucosio ev 2 ore prima dell’intervento chirurgico, riprendendola solo in caso di crollo della glicemia intorno a valori di 45 mg/dL;
- somministrazione controllata di glucosio al 10%, con monitoraggio ogni 15 min, mantenendo la glicemia in un range di 100-150 mg/dL, e l’eventuale somministrazione di insulina, per tassi glicemici troppo elevati.
Altri hanno proposto di mantenere una moderata ipoglicemia, in maniera da poter utilizzare l’aumento glicemico intra-operatorio come segno indiretto dell’asportazione dell’insulinoma, a volte di dimensioni particolarmente ridotte.
Diazossido e analoghi della somatostatina vengono somministrati fino alla mattina dell’intervento, per ridurre l’iperincrezione di insulina da stimolo chirurgico intra-operatorio (28).
Dal punto di vista dei farmaci dell’anestesia generale, il propofol rappresenta la scelta più corretta, quale agente ipno-induttore e possibile componente del mantenimento dell’anestesia generale, sia per la capacità di ridurre il consumo cerebrale di ossigeno che per l’assenza di ripercussioni sul rilascio di insulina e sulla regolazione della glicemia (29,30). Tra gli agenti alogenati, il desflurano sopprime il rilascio di insulina e quindi risulta indicato nella chirurgia dell’insulinoma (31). La tecnica chirurgica di scelta, quella video-laparoscopica, determina modificazioni emodinamiche, incluse riduzione della portata cardiaca, aumento della pressione sistemica e delle resistenze vascolari sistemiche, che causano rilascio di catecolamine e vasopressina (32). Per questi motivi, è importante mantenere la pressione di esercizio intra-addominale ≤ 12 mmHg, valore con effetti minimi sull’emodinamica.
Diabete mellito
Nel paziente chirurgico il diabete rappresenta una delle più frequenti patologie, con molteplici organi bersaglio, ciascuno dei quali può determinare un rischio aumentato e/o elevato di complicanze peri-operatorie. Queste patologie d’organo causate dal diabete possono quintuplicare la mortalità chirurgica rispetto alla popolazione non diabetica (33,34).
Le patologie degenerative sono soprattutto legate al diabete di tipo 2 (35), il rischio anestesiologico è in rapporto alle condizioni cliniche pre-operatorie e alle complicanze peri-operatorie collegate. L’apparato cardio-vascolare è quello più interessato da complicanze legate alla malattia diabetica: ipertensione arteriosa, lesioni coronariche, cardiomiopatia diabetica e neuropatia rappresentano altrettanti fattori critici nella gestione del paziente chirurgico.
L’inquadramento complessivo e la preparazione del paziente chirurgico diabetico sono obbligatori, al punto da rendere necessario posticipare, quando possibile, l’intervento chirurgico previsto (36). Un recente studio ha evidenziato un differente comportamento nei confronti di due tipologie di anestesia: i pazienti con normale sensibilità all’insulina hanno evidenziato un incremento della risposta all’insulina quando viene utilizzata l’associazione di anestesia generale ed epidurale; i pazienti con elevata resistenza all’insulina hanno invece presentato iperglicemia, sia prima che dopo l’intervento chirurgico. Questo consiglierebbe di usare la massima attenzione nell’utilizzo dell’insulina intra- e post-operatoria nei pazienti con normale sensibilità all’insulina (37).
L’iperglicemia è riscontrabile nel periodo peri-operatorio sia nei pazienti diabetici che non diabetici ed è legata di per sé a una sequela di complicanze post-operatorie. L’esito chirurgico risulta compromesso dalla ritardata guarigione delle ferite, dall’aumento delle complicanze infettive, dall’ospedalizzazione prolungata e, infine, da una più elevata mortalità post-operatoria. Lo stress chirurgico, l’anestesia e la malattia favoriscono la secrezione di ormoni contro-regolatori (cortisolo, glucagone, GH, catecolamine), che riducono la secrezione insulinica, aumentano la resistenza all’insulina stessa e riducono l’utilizzo periferico del glucosio, incrementando lipolisi e proteolisi. L’iperglicemia stimola la diuresi osmotica, con perdita di liquidi ed elettroliti, la chetogenesi e la circolazione di citochine pro-infiammatorie, con danno mitocondriale, endoteliale e disregolazione immunitaria (38). L’anestesia generale ha un impatto negativo su questi processi, e determina l’aumento del tasso glicemico. La chirurgia bariatrica rappresenta un caso emblematico: la condizione iperglicemica, sia nei pazienti diabetici che non, rappresenta un fattore di rischio aumentato per quanto riguarda le infezioni post-operatorie e l’esito chirurgico (39).
Nella preparazione anestesiologica del paziente diabetico alla chirurgia esistono tuttora delle controversie: SAMBA (Society for Ambulatory Anesthesia) consiglia di somministrare il 75% dell’insulina intermedia la sera prima dell’intervento chirurgico (40,41). La mattina dell’intervento dovrebbe essere somministrato il 50% della dose di insulina mista e a durata intermedia.
Nel paziente cosciente l’ipoglicemia (così come l’iperglicemia) può essere facilmente evidenziata grazie ai segni patognomonici classici (nausea, sete, poliuria, stato confusionale, fatica, ecc), mentre nel paziente in stato di anestesia generale la condizione di ipoglicemia risulta ben più difficile da interpretare. Per molti versi la condizione di ipoglicemia spinta è ben più grave dell’iperglicemia, potendo determinare alterazioni cerebrali fino alla morte. Come riferimento clinico, nel paziente diabetico il livello di 70 mg/dL rappresenta il livello di guardia per un trattamento immediato (41). In questo caso, nel paziente in anestesia generale, per valori ancora nei limiti di sicurezza si può optare per la somministrazione di 500 mL di destrosio 5%; in caso di urgenza, 50 mL di glucosio al 50%. In alternativa, si può ricorrere al glucagone per via sottocutanea: 1 U (1 mg), da dimezzare in caso di pazienti pediatrici.
L’iperglicemia pre-operatoria, sia nei pazienti in condizione di sedazione cosciente che in anestesia generale, non deve essere > 180 mg/dL, soprattutto in occasione di interventi in regime ambulatoriale o di day-surgery (41). L’iperglicemia è presente tra il 20 e il 40% dei pazienti di chirurgia generale e tra l’80 e il 90% dei pazienti cardio-chirurgici. Lo stress, insieme all’anestesia generale e alle patologie del paziente, innesca un’iperincrezione di ormoni contro-regolatori (catecolamine, cortisolo, ecc), i quali riducono l’increzione di insulina, aumentano i fenomeni di resistenza a quest’ultima, favorendo lipolisi e proteolisi e incrementando gluconeogenesi e glicogenolisi. A questo punto l’iperglicemia è responsabile della diuresi osmotica compensatoria, della chetogenesi e dell’attivazione delle citochine pro-infiammatorie. L’insulina regolare può essere somministrata per via sottocutanea o endovenosa; in quest’ultimo caso bisogna sempre ricordare che una parte della dose rimarrebbe legata alle pareti del deflussore dell’infusione e della soluzione infusionale, accorciando il tempo di azione. SAMBA suggerisce di utilizzare la regola di 1800 per l’insulina rapida e di 1500 per quella normale: questa regola permette, utilizzando il quantitativo di insulina giornaliera, di poter prevedere la riduzione del tasso glicemico (es. 1800: 60 UI = 30 mg/dL).
Il paziente diabetico dovrebbe essere operato come primo della seduta operatoria, per evitare fluttuazioni della glicemia, con il protrarsi del digiuno; inoltre, è noto che, in caso di somministrazione insulinica nell’immediato pre-operatorio, il rischio di ipoglicemia potrebbe verificarsi circa 1.5 ore dopo la dose di insulina rapida e 3-4 ore dopo quella intermedia (41). Questo spiega l’importanza della conoscenza delle caratteristiche farmaco-cinetiche e farmaco-dinamiche delle varie tipologie di insulina, con particolare riguardo alla gestione anestesiologica della chirurgia in regime ambulatoriale e di day-surgery.
Dovrebbe essere valutata con attenzione la somministrazione di desametasone nella fase che precede l’induzione dell’anestesia generale: il rapporto rischio/beneficio dovrebbe limitarne l’utilizzo, per evitare le complicanze da iperglicemia indotta (42).
L’anestesia loco-regionale, nelle sue diverse tipologie, centrali o periferiche, è in grado di modulare la risposta ormonale del paziente nei confronti dell’aggressione chirurgica; un’anestesia subaracnoidea può ridurre la secrezione di insulina residua, mentre un’anestesia epidurale inibisce la maggior parte degli ormoni da stress e la secrezione delle catecolamine intra- e post-operatorie.
I pazienti diabetici oftalmo-chirurgici possono presentare molte complicanze vascolari periferiche diabete-indotte a livello oculare (emorragia coroidale, endoftalmite, edema cistoide maculare), ma, nonostante queste premesse, le revisioni sull’argomento hanno escluso un rapporto causa/effetto (43,44). Peraltro, la correzione rapida pre-operatoria della glicemia si è dimostrata a rischio per la progressione della maculopatia retinica (45,46).
Neanche il controllo dell’HbA1c nei mesi precedenti l’intervento chirurgico ha evidenziato una riduzione significativa delle complicanze post-operatorie e dell’esito (47), così come la sua elevata concentrazione ha sollevato pareri discordi circa l’incremento della morbilità e mortalità post-operatoria nella chirurgia non cardiaca (48,49). Al contrario, valori di HbA1c intorno al 7% sono stati associati alla riduzione delle infezioni post-operatorie. A tal proposito, le linee guida inglesi raccomandano di mantenere un livello pre-operatorio di HbA1c < 8.5% (69 mmol/mol), compatibile con l’esecuzione dell’intervento chirurgico (48,50).
BIBLIOGRAFIA
- Burkhardt T, Rotermund R, Schmidt NO, et al. Dexamethasone PONV prophylaxis alters the hypothalamic-pituitary-adrenal axis after transsphenoidal pituitary surgery. Neurosurg Anesthesiol 2014, 26: 216-9.
- Borg H, Siesjö P, Kahlon B, et al. Perioperative serum cortisol levels in ACTH sufficient and ACTH deficient patients during transsphenoidal surgery of pituitary adenoma. Endocrine 2018, 62: 83-9.
- Prabhakar H, Mahajan C, Kapoor I. Anesthesia for minimally invasive neurosurgery. Curr Opin Anaesthesiol 2017, 30: 546-50.
- Gemma M, Tommasino C, Cozzi S, et al. Remifentanil provides hemodynamic stability and faster awakening time in transsphenoidal surgery. Anesth Analg 2002, 94: 163-8.
- Benson DW. Anesthesia for thyroid surgery. Semin Anesth 1984, 3: 168.
- Nair GC, Babu MJC, Menon R, Jacob P. Preoperative preparation of hyperthyroidism for thyroidectomy. Role of supersaturated iodine and lithium carbonate. Indian J Endocrinol Metab 2018, 22: 392–6.
- Duggal J, Singh S, Kuchinic P, et al. Utility of esmolol in thyroid crisis. Can J Clin Pharmacol 2006, 13: e292-5.
- Dalan R, Leow MK. Cardiovascular collapse associated with beta blockade in thyroid storm. Exp Clin Endocrinol Diabetes 2007, 115: 392-6.
- Misal US, Joshi SA, Shaikh MM. Delayed recovery from anesthesia: a postgraduate educational review. Anesth Essays Res 2016, 10: 164-72.
- Biondi B, Klein I. Hypothyroidism as a risk factor for cardiovascular disease. Endocrine 2004, 24: 1-13.
- Braunfeld M. Ipercalcemia. In: Roizen MF, Fleisher LA (eds). Essenza della pratica anestesiologica. Verduci, Roma, 1998: p.167.
- Cinamon U, Gavish D, Ovnat Tamir S, et al. Effect of general anesthesia and intubation on parathyroid levels in normal patients and those with hyperparathyroidism. Head Neck 2018, 40: 555-60.
- Krausz MM, Younis O, Mahamid A, et al. Minimally invasive parathyroidectomy (MIP) under local anesthesia for treatment of primary hyperparathyroidism (PHPT) caused by single adenoma. Harefuah 2017, 156: 14-8.
- Sen S, Cherian AJ, Ramakant P, et al. Focused parathyroidectomy under local anesthesia - A feasibility study. Indian J Endocrinol Metab 2019, 23: 67-71.
- Benhami A, Chuffart E, Christou N, et al. Ambulatory surgery under local anesthesia for parathyroid adenoma: feasibility and outcome. J Visc Surg 2018, 155: 253-8.
- Domi R, Sula H, Kaci M, et al. Anesthetic considerations on adrenal gland surgery. J Clin Med Res 2015, 7: 1-7.
- Bochicchio GV, Sung J, Joshi M, et al. Persistent hyperglycemia is predictive of outcome in critically ill trauma patients. J Trauma 2005, 58: 921-4.
- Carson JL, Scholz PM, Chen AY, et al. Diabetes mellitus increases short-term mortality and morbidity in patients undergoing coronary artery bypass graft surgery. J Am Coll Cardiol 2002, 40: 418-23.
- Moghissi ES, Korytkowski MT, Di Nardo M, et al. American Association of Clinical Endocrinologists and American Diabetes Association consensus statement on inpatient glycemic control. Endocr Pract 2009, 15: 353-69.
- Svircevic V, van Dijk D, Nierich AP, et al. Meta-analysis of thoracic epidural anesthesia versus general anesthesia for cardiac surgery. Anesthesiology 2011, 114: 271-82.
- Del Pizzo JJ, Schiff JD, Vaughan ED. Laparoscopic adrenalectomy for pheochromocytoma. Curr Urol Rep 2005, 6: 78-85.
- Kinney MA, Narr BJ, Warner MA. Perioperative management of pheochromocytoma. J Cardiothorac Vasc Anesth 2002, 16: 359-69.
- Lebuffe G, Dosseh ED, Tek G, et al. The effect of calcium channel blockers on outcome following the surgical treatment of phaeochromocytomas and paragangliomas. Anaesthesia 2005, 60: 439-44.
- James MF, Cronje L. Pheochromocytoma crisis: the use of magnesium sulfate. Anesth Analg 2004, 99: 680-6.
- Bryskin R, Weldon BC. Dexmedetomidine and magnesium sulfate in the perioperative management of a child undergoing laparoscopic resection of bilateral pheochromocytomas. J Clin Anesth 2010, 22: 126-9.
- Comi RJ. Approach to acute hypoglycemia. Endocr Metab Clin North Am 1993, 22: 247-62.
- Whipple AO, Frantz VK. Adenoma of islet cells with hyperinsulinism. Ann Surg 1935, 101: 1299–365.
- Vaidakis D, Karoubalis J, Pappa T, et al. Pancreatic insulinomas: current issues and trends. Hepatobiliary Pancreat Dis Int 2010, 9: 234–41.
- Grant F. Anesthetic considerations in the multiple endocrine neoplasia syndromes. Curr Opin Anaesthesiol 2005, 18: 345–52.
- Kunisawa T, Takahata O, Yamamoto Y, et al. Anesthetic management of two patients with insulinoma using propofol in association with rapid immunoassay for insulin. Masui 2001, 50: 144–9.
- Matsumoto M, Sakai H. Sevoflurane anesthesia for a patient with insulinoma. Masui 1992, 41: 446-9.
- Joris JL. Miller’s Anesthesia. 7th Philadelphia: Churchill Livingstone Elsevier. Anesthesia for Laparoscopic Surgery 2010: 2185-202.
- Walsh DB, Eckhauser FE, Ramsburg SR, et al. Risk associated with diabetes mellitus in patients undergoing gallbladder surgery. Surgery 1982, 91: 254-7.
- Burgos LG, Ebert TJ, Assidao C, et al. Increased intraoperatory cardiovascular morbidity in diabetics with autonomic neuropathy. Anesthesiology 1989, 70: 591-7.
- Walters DP, Gatling W, Houston AC, et al. Mortality in diabetic subjects: an eleven-year follow-up of community-based population. Diabet Med 1994, 11: 968-73.
- Sreedharan R, Abdelmalak B. Diabetes mellitus. Preoperative concerns and evaluation. Anesthesiol Clin 2018, 36: 581-97.
- Donatelli F, Nafi M, Pietropaoli L, et al. Postoperative insulin secretion is decreased in patients with preoperative insulin resistance. Acta Anaesthesiol Scand 2019, 63: 232-9.
- Dogra P, Jialal I. Diabetic perioperative management. StatPearls Publishing, Treasure Island (FL). Last Update: November 13, 2019.
- Meister KM, Hufford T, Tu C, et al. Clinical significance of perioperative hyperglycemia in bariatric surgery: evidence for better perioperative glucose management. Surg Obes Relat Dis 2018, 14: 1725-31.
- Aldam P, Levy N, Hall GM. Perioperative management of diabetic patients: new controversies. Br J Anaesth 2014, 113: 906–9.
- Joshi GP, et al. Society for Ambulatory Anesthesia consensus statement on preoperative blood glucose management in diabetic patients undergoing ambulatory surgery. Anesth Analg 2010, 111: 1378–87.
- Duggan E, Chen Y. Glycemic management in the operating room: screening, monitoring, oral hypoglycemics, and insulin therapy. Curr Diab Rep 2019, 19: 134.
- Wielders LH, Lambermont VA, Schouten JS, et al. Prevention of cystoid macular edema after cataract surgery in nondiabetic and diabetic patients: a systematic review and meta-analysis. Am J Ophthalmol 2015, 160: 968–81.
- Kumar CM, Eke T, Dodds C, et al. Local anaesthesia for ophthalmic surgery — new guidelines from the Royal College of Anaesthetists and the Royal College of Ophthalmologists. Eye 2012, 26: 897–8.
- Suto C, Hori S, Kato S, et al. Effect of perioperative glycemic control in progression of diabetic retinopathy and maculopathy. Arch Ophthalmol 2006, 124: 38–45.
- Lipshutz AK, Gropper MA. Perioperative glycemic control: an evidence-based review. Anesthesiology 2009, 110: 408–21.
- Dhatariya K, Levy N, Kilvert A, et al, for the Joint British Diabetes Societies. NHS diabetes guideline for the perioperative management of the adult patient with diabetes. Diabet Med 2012, 29: 420–33.
- Rollins KE, Varadhan KK, Dhatariya K, Lobo DN. Systematic review of the impact of HbA1c on outcomes following surgery in patients with diabetes mellitus. Clin Nutr 2016, 35: 308–16.
- Avci BS, Saler T, Avci A, et al. Relationship between morbidity and mortality and HbA1c levels in diabetic patients undergoing major surgery. J Coll Physicians Surg Pak 2019, 29: 1043-7.
- O’Sullivan CJ, Hynes N, Mahendran B, et al. Haemoglobin A1c (HbA1C) in non-diabetic and diabetic vascular patients. Is HbA1C an independent risk factor and predictor of adverse outcome? Eur J Vasc Endovasc Surg 2006, 32: 188–97.
Terapie chirurgiche della regione cranica
Gestione peri-operatoria adenomi ipofisari
Terapia neurochirurgica prolattinomi
Terapia neurochirurgica dell'acromegalia
Terapia neurochirurgica del Cushing
Terapia neurochirurgica del TSHoma
Terapia neurochirurgica del craniofaringioma
Chirurgia decompressiva per l'orbitopatia di Graves
Terapie chirurgiche della regione del collo
Scelta del tipo di trattamento chirurgico nella patologia nodulare tiroidea
Terapia chirurgica tradizionale per la patologia tiroidea benigna
Terapia chirurgica mini-invasiva per la tiroide
Chirurgia robotica per la patologia tiroidea
Terapia chirurgica dei tumori tiroidei differenziati
Terapia chirurgica del carcinoma midollare
Chirurgia radio/ecoguidata delle recidive locali
Salvataggio delle vie aeree e delle vie digestive superiori
Terapia chirurgica dell'iperparatiroidismo primitivo
Quale tipo di intervento chirurgico per l'iperparatiroidismo nell'ambito della MEN-1
Terapia chirurgica per l'iperparatiroidismo nell'ambito della MEN 2: quando e quale?
Tiroidectomia profilattica nell'ambito della MEN-2: a chi e quando
Terapie chirurgiche della regione addomino-pelvica
Terapia chirurgica per la disfunzione erettile
La riattribuzione chirurgica del sesso nella disforia di genere
Chirurgia bariatrica e diabete
Trapianto di pancreas e di insule
Terapia chirurgica per i NET pancreatici
Terapia chirurgica per i NET intestinali
NET duodeno-pancreatici nell'ambito della MEN-1: devono essere trattati tutti con chirurgia?

